2016 年 15 巻 5 号 p. 170-176
2016 年 15 巻 5 号 p. 170-176
Quantum effect is manifest for hydrogen atoms on surfaces as well as for those in solution and solids. The excited states of a hydrogen atom directly adsorbed on metal surfaces are beyond the diffusion barrier, thus being delocalized to the next sites, and even spread over the entire surface in the low-coverage limit. In addition, water and hydroxyl group on the surfaces show significant quantum effect, due to tunneling and zero-point motion of the hydrogen atom. We briefly review some experimental and theoretical studies that revealed the quantum effect of the hydrogen atom on the surfaces.
水素原子が物質科学において中心的な役割を果たすことに疑いの余地はないであろう.固体表面においても水素原子は普遍的に存在しており,触媒反応や電極反応における主役である.金属表面における水素原子の吸着状態については,表面科学の分野で古くから研究が進められている [1].当初は表面上の特定サイトに局在していると考えられていた水素原子であるが,特に被覆率が低い場合は表面上の各サイトに留まらず(特に励起状態),二次元周期ポテンシャルの中でプロトンバンドを形成すると提案された [2].これが固体表面における「量子水素」に関する最初の報告である.その後,振動分光法により表面における量子水素の存在が検証され,さらに顕微鏡によって水素原子の量子拡散が直接観察されるに至った.一方,これら表面に直接吸着した水素原子とは別に,表面に吸着した分子(例えば水分子)の水素原子が量子効果を示すことも報告されている.このような水素は分子間の水素結合に関与することが多く,表面における水素移動や電極反応と密接に関係していると考えられる.本稿では物質科学において普遍的に観測,提案されている「量子水素」の中で,固体表面に存在する水素原子の量子論的振る舞いに焦点を当てて概説する.
金属表面に吸着した水素原子の吸着状態が種々の表面分光法により研究されてきた.水素原子は価電子の状態が明らかでなく(表面との相互作用を通して金属の連続電子状態へと非局在化する),そのため光電子分光が不向きであり,主に振動分光を用いて調べられている.電子エネルギー損失分光(Electron energy loss spectroscopy; EELS)は単色化した電子線を表面に入射し,反射した電子の損失エネルギーを計測することで,表面吸着原子•分子の振動分光を行うものである [3].水素原子は一般に表面の特定サイトに吸着するが,そのポテンシャル井戸の中で振動の自由度を有しており,その振動エネルギーから吸着サイトに関する情報を得ることができる.遷移金属表面において水素原子は主に3配位サイトや4配位サイトに吸着する.一方,水素原子は表面に沿ってサイトからサイトへと移動でき,その拡散障壁はそれほど高くない(約100 meV).これにより水素原子の振動状態(主に励起状態)は一つのサイトに留まらず,表面に沿って非局在化すると提案された [2,4,5].Figure 1は水素原子の非局在化した振動状態(波動関数)を模式的に表したもので,波動関数が基底状態(n = 0)では各吸着サイトに局在しているのに対し,励起状態(n = 1,2,..)では隣のサイト間で重なり,その結果,非局在化する様子を示している.すなわち,電子が周期ポテンシャルの中でエネルギーバンドを形成してその固有状態が結晶内に広がるのと同様に,水素原子も周期ポテンシャルの中でエネルギーバンドを形成し,その振動状態(もはや振動とは言えないが),が表面に沿って広がるというアイデアである.この水素原子の非局在化は振動分光によって検証が可能である.すなわち,非局在化により振動準位はバンドを形成して広がるので,振動ピークも広がって観測されるはずである.実際,Cu(110)およびPd(110)表面に吸着した低被覆率の水素原子に対するEELSの結果は,このような非局在化を支持している [6,7].また有限被覆率では水素原子間の反発により,水素原子は表面全体に非局在化せず,表面上の有限サイト間で非局在化すると提案されている.Figure 2はPt(111)における水素原子(0.25 被覆率)に関する第一原理計算の結果である [8].水素原子(左)と重水素原子(右)の各固有状態についてその位置分布を示してある.基底状態(最上段)では古典的に最も安定なPt原子の3配位サイトに局在している.しかし,第一励起状態(上から2段目)はすでに隣の3配位サイトにも分布しており,水素原子の非局在化を示している.非局在化した励起状態はEELSにおいて特異な振動ピークとして観測されている [9,10].このように,水素原子は金属表面において2次元的に非局在化することが理論計算および振動分光により示唆された.さらに,表面における量子水素の存在は,走査トンネル顕微鏡(Scanning tunneling microscope; STM)による水素原子の直接観察により決定的となった.Lauhonら [11]はCu(100)表面に吸着した一つの水素原子を観察することに成功し,その拡散挙動の温度依存性を詳細に調べた.その結果,拡散速度のアレニウスプロットにおいて80 K付近に熱的拡散と量子拡散の転移が観測され,水素原子がトンネル効果によって表面を移動することがわかった.これは表面における量子水素の存在を直接明らかにしたものといえる.

Schematic representation of a simple one-dimensional model illustrating the quantum delocalization of a hydrogen atom on a metal surface (reprinted with permission from Ref [4]).

Probability distributions as projected on the plane of the Pt(111) surface for H and D at the fcc site for the ground state (0), and the excited states (1)–(5), evaluated at the center of the Brillouin zone. The excitation energy for the vibrational states for H(D) is: (1),(2) 44 meV (39 meV), (3) 65 meV (49 meV), (4) 111 meV (74 meV), (5) 141 meV (96 meV). The potential energy surface is calculated for 0.25 of a monolayer of H and the symmetry is C3v. The excited states (1)–(2) have E symmetry while the ground state and the excited states (3)–(5) have A1 symmetry (reprinted with permission from Ref [8]).
前章の最後に紹介したように,STMは表面の吸着種を単原子•単分子レベルで直接観測できることから,近年,表面科学における中心的手法として広く用いられるようになった.STMを用いて金属表面に吸着した水酸基(OH)が観測され,そのダイナミクスが水素原子の量子効果によって支配されることが明らかにされている [12,13].Figure 3 (a)はCu(110)表面に吸着した水酸基のSTM像であり,基板結晶の[001]方向に並んだ二つの「三日月」として観測される.像はC2vの対称性を示しており,従って水酸基の吸着構造はC2vの点群に属しているように見える.次に水酸基の吸着構造について第一原理計算が行われた.その結果,Figure 3 (b)に示すように水酸基はOH軸を[001]方向に傾けて吸着することがわかった [12].しかし,この計算結果はSTM像から示唆されるC2vの吸着構造と矛盾しているように見える.そこで筆者らは,OH軸がHのトンネル効果によって高速にフリップしていると考え,STM像はFigure 3 (b)の左右に示す2状態間の重ね合わせであると予想した.フリップに必要な活性化エネルギーを計算し(140 meV),この障壁の値と,計算により求めた反応モード(OH軸の変角モード)の零点エネルギー,および反応距離に基づいた単純なWKB近似により,そのフリップ速度が106 s−1のオーダーであることを示した.すなわち,OHはSTMの測定時間に対して十分速くフリップ運動しており,C2vのSTM像が2状態間の重ね合わせであることが支持された.この結果は,Cu(110)に吸着した水酸基のダイナミクスが水素原子の量子効果により支配されていることを強く示唆している.
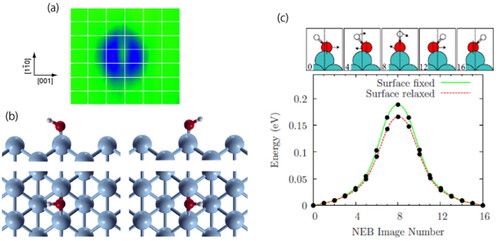
(a) STM image of OH on Cu(110) [12]. (b) Two equivalent stable structures of OH [12]. (c) MEP (minimum-energy path) obtained from a 15-image NEB (nudged elastic band) calculation for the OH flip process on Cu(110). The red and green curves correspond to the converged MEP with the top two layers of the surface relaxed or fixed in their bulk truncated configuration, respectively. The relaxed and fixed models predict transition barriers of 166 and 187 meV, respectively. The cartoons at the top of the graph are schematic illustrations of how the molecule moves during the flipping process, with the arrows indicating how the molecule moves from one step to the next. Although the difference in position between the O atom in the initial and final states is very small along the MEP the oxygen undergoes a large displacement before passing through the transition state. It is this supplementary oxygen movement which greatly suppresses the tunneling rate along the MEP [For (c), reprinted with permission from Ref [13]].
この単純な系の量子ダイナミクスについて,酸素原子の運動も考慮した第一原理計算が報告されている.Davidsonら [13]は上記OHのフリップ運動について,(古典的な)最小エネルギー経路を計算し,それには酸素原子の運動がかなり含まれていることを示した.Figure 3 (c)はNEB (nudged elastic band)法により計算されたOHの反応(フリップ)経路であり,酸素の変位が大きいことがわかる.その障壁はCu基板の緩和を考慮すると166 meV (赤線), 固定すると187 meV (緑線)であった.彼らはこの最小エネルギー経路に沿った水酸基の(酸素の運動も含めた)トンネル速度をWKB近似から求め,明らかに実験よりも低いフリップ速度を得た.これは質量の増大と長い反応経路に起因している.そこで最小エネルギー経路ではなく,ポテンシャルエネルギー面の最短距離を通って水酸基がフリップすることで酸素の運動が最小限に抑えられ,その結果,フリップ速度が実験と一致することを見出した.一般に,重い原子(酸素原子など)を含む系のトンネル現象は,古典的な最小エネルギー経路(minimum-energy path; MEP)をショートカットすることで重い原子の運動を抑えて進行できると提案している.
金属表面における水の吸着層には水酸基が含まれることが多く,その中で水分子と水酸基は安定な水素結合を形成する.一般に,水酸基はアクセプタとして水分子の水素を受け入れる.Figure 4 (a)はCu(110)に吸着した水分子と水酸基一つずつから形成される複合体のSTM像である [14].STM像は対称性の高い楕円形であり,このことは複合体がC2vの対称性を持つことを示唆している.この複合体について第一原理計算が行われ,Figure 4 (b)に示す最安定構造が得られた.[001]方向に傾いた水酸基に対して水分子が水素結合を供与することで安定な水素結合を形成する.しかし,このドナー•アクセプタ構造はFigure 4 (a)のSTM像が示すC2v対称性と合致しない.そこで筆者らはFigure 4 (c)に示すように共有されている水素原子が酸素間を移動して複合体の中央に位置することで,対称性を向上させていると考えた.すなわち,水分子と水酸基の区別がなくなって対称な水素結合が形成されていると予想した.水素移動のポテンシャルエネルギー変化を計算したところ,移動に必要な活性化エネルギーが20 meVにも満たないことが明らかとなった[Figure 4 (d)].このとき,水素原子のゼロ点振動レベルが障壁を越えるため,水素原子は中央に位置することになる.すなわち,古典的には非対称な水素結合が安定であるが[Figure 4 (b)],量子論的には(ゼロ点振動の影響で)対称な水素結合が形成されることになる.一般に水素結合の様式は酸素原子間の距離に応じて変化し,O-O距離が2.8 Åで通常の非対称な水素結合を形成する.O-O距離が短くなるにつれて障壁が低下し,2.5 Åでゼロ点エネルギーが障壁を超えて水素原子は酸素原子間で非局在化するようになる.今回計算した水分子と水酸基の複合体のO-O距離は2.5 Åであり後者に属する.このような水素結合は低障壁水素結合と呼ばれており,酵素の反応過程 [15]や高圧下の氷 [16]において現れる.また,水溶液中のプロトンのモデルとしてZundel cation [(H2O–H-OH2)+]がよく知られているが [17],複合体の対称水素結合とよく類似しており,プロトン移動の前駆体と位置付けられる.

(a) STM images of a water-OH complex on Cu(110). The image appears as belonging to C2v point group. (b) Calculated structure of the complex. (c) H-atom transfer between water and OH. (d) Potential energy for the transfer.
水分子と水酸基の間に形成される水素結合における量子性が,基板表面により強く影響を受けることが分子動力学計算により明らかにされた [18].Figure 5は遷移金属表面の最密面に形成される水分子と水酸基を同数含む吸着層の模式図である.それら3つずつからなる六角形を基本として,吸着層は周期構造を形成する.酸素原子はほぼ金属原子の真上に位置する.水分子と水酸基の水素結合のうち,水分子がドナーである水素結合の距離は短く(short),水分子がアクセプタである水素結合の距離は比較的長い(long).すなわち,六角形は短い辺と長い辺からなる構造をもつ.この吸着層について経路積分法を用いた分子動力学計算が行われた.特に水素原子を量子論的に扱うことで,その量子分布が調べられた.Figure 6は,基板金属がPt(111), Ru(0001), Ni(111)の場合の計算結果であり,それぞれ金属の最近接原子間距離は2.77, 2.65, 2.49 Åである.酸素原子は金属原子の真上に位置するので,基板金属の種類によって酸素原子間距離が変化する.前節で述べたように,水素結合に共有された水素原子の局在•非局在性は酸素原子間距離に強く依存する.従って,基板金属の種類は水素原子の量子分布に影響を与えると予想される.Figure 6 (a)はPt(111)上の吸着層について,酸素と水素の距離(RO–H)の分布を計算したもので,黒線は水素原子を古典的に扱った計算結果,赤線は量子論的に扱った計算結果を示している.1 Å付近のピークは共有結合のO–H距離に対応している.加えて,古典的な計算では1.8および2.1 Å付近にピークが現れており,これらは上述した短い水素結合と長い水素結合にそれぞれ対応している.一方,量子論的な計算では,短い水素結合の分布が消えて,その代わりに1∼1.5 Åにかけて新たな構造が現れている.これは短い水素結合,すなわち水分子が供与した水素原子が水酸基へと非局在化していることを表している.このときの水素原子の空間分布がFigure 6 (g)に示されている.水分子から水酸基へ供与された水素原子がそれらの中間に分布して,“H3O2”複合体を形成しているのがわかる(黄色の楕円).Figure 6 (e)に示すNi(111)の場合は,O-O間距離がより短いために,水素結合に関するO–H距離の分布は1.5 Åの単一ピークとなっている.Pt(111)と同様に水素原子が非局在化して,酸素原子の中間に分布する.Figure 6 (i)に示すように,Ni(111)では水素結合に含まれるすべての水素原子が非局在化する.従って,もはや共有結合と水素結合の区別はつかない.

Structure of the water-OH overlayer (with classical nuclei) that forms on metal surfaces. Side views when the proton is donated from water to hydroxyl (upper, labeled ‘‘short’’) and from hydroxyl to water (lower, labeled ‘‘long’’) are shown on the right. Classically, at the ground state, the short and long H bond lengths are ~1.7 and ~2.1 Å on Pt, ~1.6 and ~1.9 Å on Ru, and ~1.4 and ~1.6 Å on Ni, respectively (reprinted with permission from Ref [18]).

Selected structural properties of the classical and quantum overlayers. Probability distributions of O-H [(a), (c), (e)] and O-O distances [(b), (d), (f )] on Pt, Ru, and Ni at 160 K, as obtained from MD with classical nuclei (labeled classical, black solid lines) and PIMD (path-integral MD) [labeled quantum, (red) dashed lines]. On the bottom [(g)–(i)] snapshots for typical spatial configurations of the overlayer on Pt (left), Ru (middle), and Ni (right) obtained from PIMD are shown. On Pt and Ru at any given snapshot one proton is equally shared by two of the Os yielding an intermediate ‘‘H3O2’’ complex. On Ni at any given snapshot several protons can simultaneously be shared between the oxygens (reprinted with permission from Ref [18]).
本稿では金属表面に存在する水素原子のうち,表面に直接吸着した水素原子,および水分子と水酸基に共有される水素原子の二つについて,その量子効果に関する研究を紹介した.これらは水素原子の量子性の中で,それぞれトンネル効果とゼロ点振動に起因する現象である.表面上の水素原子はこの他にも量子統計性や非断熱性に起因する量子効果を示すことも知られている [5].STMは実空間で水素の挙動を観察できる実験手法であり,水素原子のリレー移動 [19],協奏移動 [20],など重要な素過程が直接観測されるようになってきている.一方,本稿で取り上げたように,核の量子効果を取り入れた動力学計算が表面吸着系に応用され,その結果,水素原子の特異な挙動が明らかにされつつある.実験と理論の協力によって,表面における量子水素の研究がますます進められることが期待される.