2017 年 16 巻 4 号 p. 112-115
2017 年 16 巻 4 号 p. 112-115
Electric double layer capacitor (EDLC) is a storage device based on the interfacial interaction between electrode and electrolyte. We have conducted molecular dynamics simulations to study the atomistic origin of storage capacity. Electric double layer structures are studied by changing the electric field applied to the electrolyte. Charge density distribution in the electrolyte phase derived on the basis of molecular dynamics simulation is used to discuss the capacitance-voltage characteristics for different electrolyte species.
電気二重層キャパシタ(Electric Double Layer Capacitor:EDLC)は電極表面と電解液の界面近傍の相互作用を利用した蓄電デバイスであり,分子動力学(MD)の立場からもその容量-電圧(C-V)特性の解析 [1],電極の材料,構造による高容量化の性能試算 [2,3]などが行われている.EDLCでは電極間に外部電場が無くても,電極-電解液界面の張力によりPotential of Zero Charge (PZC)と呼ばれる電位分布が生じる.蓄電性能の解析に当たっては,このPZCの影響を把握することが重要となる.本研究では平行板グラファイト電極とLiClなどを溶質とする水系電解液から成るEDLCを対象に,MD法を用いて外部電場の有無による電気二重層のナノ構造の変化を調べた.これよりPZCを求め,EDLCの容量特性への影響を解析した.また電解液の溶質としてLiClの他にNaCl, CsClなどを取り上げイオン種によって生じる差異についても比較した.
本解析では,Figure 1に示すようなEDLCのモデルを用いた.力場は水分子にはSPC/E [4],グラファイトにはcvff [5]を適用し,イオン,水分子間の相互作用はクーロンポテンシャルとLennard-Jonesポテンシャルにより記述し,Dangら [6]によるパラメータ値を用いた.外部電場の強度はグラファイト電極の表面層に与える電荷量 ± q (e/C- atom, e:電子電荷)により変化させた.MD計算はLAMMPS [7]を用い,周期境界の下,300 K, NVTアンサンブルの条件で行った.定常状態の解析は,5 nsの定常化の後15 nsのサンプリングにより実施した.まず電解液を構成する原子(水分子の水素原子と酸素原子,および電解質のイオン)それぞれについて電荷qによって生じる電極表面に垂直な方向の数密度の分布Np(z) を求めた.次にこの数密度分布データを用いて電極間の電位分布V(z)を計算した. V(z) は1次元のPoisson方程式
| (1) |
| (2) |
| (3) |
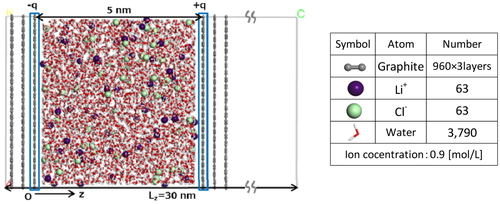
A typical model employed in the MD simulation.
Figure 2 (a)はLiCl水電解液において電場の無い場合(q = 0)の水分子,各イオンの数密度分布を計算した結果を示す.この状態においても,電極表面の最近傍に水単分子層とイオンによる層状構造が形成されていることがわかる.これは電極表面と水溶液界面に生じる界面張力の影響を反映したものと考えられる.次に電極の電荷量qを変化させて電場の影響を調べた.Figures 2 (b), (c)は,q = ± 0.005 e/C-atomの場合の負極側,正極側の数密度分布を示す.同図(a)と比較すると電場の影響により,負極側では電極近傍のLiイオン密度のピークが増大,Clイオン密度は減少し,正極側ではその逆の挙動が確認された.次に電解液の溶質をCsClに代えて同様の計算を行った結果をFigure 3に示す.CsClにおいても電極表面の最近傍に水分子層とイオンによる層状構造が形成されているが,Figure 2のLiイオンの分布は水分子層に接して単峰のピークを持つのに対して,Figure 3のCsイオンは水分子層の内部と外側にピークを有する双峰性の広がった分布になっている.また正極側のClイオンの分布はFigures 2, 3いずれの場合も双峰性を示し,この傾向は溶質の陽イオンによらないこともわかった.
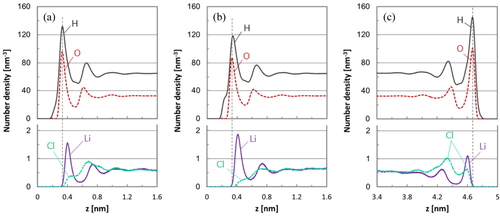
Number density of atoms in LiCl aqueous electrolyte as a function of distance from the electrode surface with a charge of (a) 0, (b) −0.005 (cathode), and (c) +0.005 e/C-atom (anode).
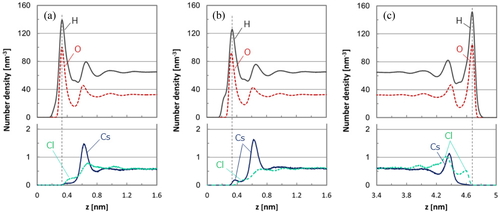
Number density of atoms in CsCl aqueous electrolyte as a function of distance from the electrode surface with a charge of (a) 0, (b) −0.005 (cathode), and (c) +0.005 e/C-atom (anode).
続いてFigures 2, 3の各数密度分布に対する電位分布を計算,比較した.Figure 4 (a)は溶質がLiCl, (b)はCsClの場合についてq = 0, ± 0.005 e/C-atomでの各数密度分布に対する電位分布を比較した結果を示す.電場の無いq = 0においても電極表面と電解液中央部との間には電位差PZCが生じ,各々0.39 V, 0.31 Vと求まり,PZCはイオン種によって異なることがわかった.Figure 5は溶質の陽イオンによるPZCの差異を比較したものである.陽イオンのサイズを増すに従って,PZCは0.39∼0.31 Vまで低下することがわかった.これらの値は水電解液の電位窓1.2 Vに対して33∼25%程度となるため,式(3)によるEDLCの静電容量CSの見積りにはその影響に注意する必要がある.
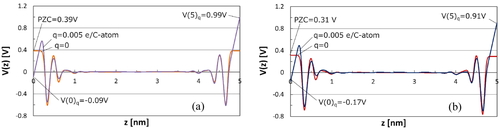
Electrostatic potential distributions for (a) LiCl and (b) CsCl aqueous electrolyte with a charge of 0 and ±0.005 e/C-atom.
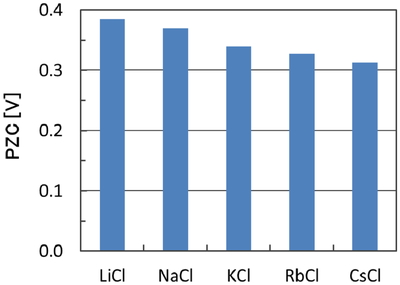
PZCs for different aqueous electrolytes.
Figure 4よりEDLCの中央部(z = 1.5∼3.5 nm)には電位差がほとんど発生しておらず,V (z)∼0 Vであることがわかる.このことからEDLCは正/負電極それぞれの近傍に個別のEDLCを形成していると見なすことができる.個々の静電容量をCSc, CSaとすると式(3)に対応して
| (3') |
| (3") |
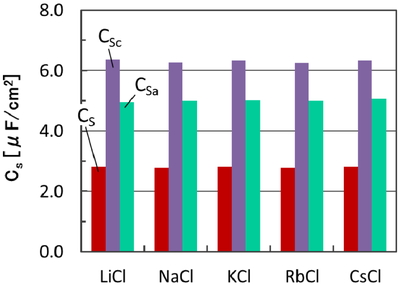
Electrostatic capacitances for different aqueous electrolytes with a charge of ±0.005 e/C-atom.
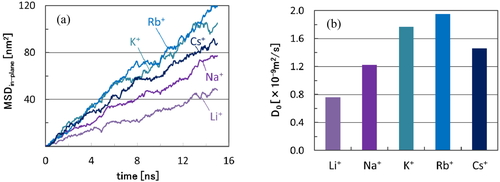
(a) In-plane mean-squared displacement (MSD) for the different cations in aqueous electrolytes and (b) self-diffusion coefficients D0 determined by each slope of MSD curves.
稲盛フロンティア研究センターの研究活動は,京セラ(株)の支援により行われた.本研究は,JSTALCAの助成により行われた.関係各位に感謝する.