2020 年 84 巻 9 号 p. 285-294
2020 年 84 巻 9 号 p. 285-294
Researches on appropriate hydrogen charging methods for simulating hydrogen absorption in low alloy steels, stainless steels and high Ni alloy, from actual environments were overviewed. Both absorbed hydrogen concentrations and hydrogen desorption profiles were compared between various hydrogen charging conditions using thermal desorption analysis (TDA) on hydrogen-charged samples. For low alloy steels, immersion or cathodic hydrogen charging in aqueous solutions were appropriate for simulating hydrogen absorption from atmospheric corrosion or high pressure gaseous hydrogen environments. Absorbed hydrogen concentration could be controlled by adding appropriate amount of hydrogen-promoter or adjusting cathodic current density and applied potential in aqueous solutions. Comparisons in TDA profiles showed that the ratio of strongly-trapped hydrogen and weakly-trapped hydrogen changed depending upon the total amount of absorbed hydrogen. This result means the state of hydrogen in steels can change according to the amount of absorbed hydrogen. For stainless steels or high Ni alloy, cathodic hydrogen charging in aqueous solutions was appropriate for simulating high pressure gaseous hydrogen environments or galvanic coupling conditions. TDA profiles apparently differed depending on hydrogen charging temperature or duration. However, numerical simulation indicated that these profiles were decided by initial hydrogen distribution in specimens, not by trapped hydrogen, contrary to low alloy steels.
水素脆化は種々の金属材料で起こり得るが1),高強度の鉄鋼材料で特に大きな問題となる2,3).水素脆化の多くは外部環境から材料中に侵入する水素により引き起こされる2,3).よって,水素脆化の評価は実験室内で試験片に水素を添加し,さらに必要に応じて応力やひずみを加える方法により行われる3).金属材料への水素添加法には,水溶液中への浸漬3)や水溶液中で試験片を分極し試験片上で水素発生を起こさせる陰極水素チャージ4,5)などが挙げられる.ただし,水素脆化特性の適正な評価には,材料の実使用環境における水素侵入を再現できる水素添加法が必要となる.すなわち,実験室内の水素添加が実環境と比べてどの程度厳しいのか,実環境を適正に再現する水素チャージ法は何か,を把握する必要がある.
本報では,低合金鋼,ステンレス鋼,高合金を用いて種々の方法で水素添加を行い,実環境における水素侵入を再現するための水素添加法を検討した研究例を概説する.
低合金鋼は種々の環境で使用されるが,高力ボルトなどの高強度鋼は大気環境において遅れ破壊と呼ばれる水素脆化を起こすことが広く知られている3).遅れ破壊の評価には,酸浸漬試験が過去多く行われている3).また,PC(Pre-stressed Concrete)鋼棒もコンクリート環境で水素脆化を起こし,この評価には,Fédération Internationale de la Précontrainte(FIP)浴6)と呼ばれるチオシアン酸アンモニウム(NH4SCN)水溶液への浸漬試験が多く用いられる.これらの試験では腐食反応を使って鋼材表面に水素を発生させ,その水素を鋼材中に侵入させる.一方,櫛田らは鋼材を腐食させることなく水素を添加する方法として,陰極電解法による遅れ破壊の評価法を提案した4).隙間部や孔食底のpHが3.5程度まで低下し得ることを考慮し,pH3.5の酸環境における水素侵入を陰極水素チャージにより再現する方法である.山崎らは,鋼材が遅れ破壊を起こさない最大の水素濃度(限界水素濃度)を陰極チャージ後の定荷重試験により求め,環境からの吸蔵水素濃度と比較し,その大小関係に基づき実ボルトの遅れ破壊を評価する方法を提案した5).陰極チャージには水素侵入促進の目的でNH4SCNを加えた水溶液を用いて,電流密度や時間を制御し,所望の量の水素を鋼材に添加する.環境からの吸蔵水素濃度には,乾湿繰り返し試験を行い鋼材中に吸蔵された水素濃度を測定し用いている.
水素脆化が問題となるその他の用途としては,NH4SCNと同様に水素侵入促進作用を持つ硫化水素(H2S)を含む湿潤環境で用いられる油井管7,8)やラインパイプ,燃料電池自動車に水素を供給する水素ステーションに設置される蓄圧器9,10)などが挙げられる.
諸分野における材料の高強度化に伴い,水素脆化の研究は活況を見せており,2009-2012年の間,日本鉄鋼協会にて「水素脆化研究の基盤構築」研究会が実施された11).その中のAグループでは「水素脆化を適正に評価できる水素添加法の提案」を目標に活動が行われ,共通素材を用いて多数の研究機関が種々の方法で水素チャージと水素分析を行う共同研究を実施した12-15).以下にその成果の中から,低合金鋼の共通素材を用いて種々の水素添加法により実環境からの水素侵入の再現を検討した結果を紹介する12).
共通素材には,引張強さが1100 MPa級のCr-Mo含有鋼(JIS-SCM435鋼,0.35%C-0.8%Mn-1.1%Cr-0.15%Mo,数値は重量%を示す)ならびに引張強さが1400 MPa級のCr-Mo-V鋼(0.4%C-0.7%Mn-1.2%Cr-0.65%Mo-0.30%V)を用いた.いずれも焼入れ焼戻し処理により強度を調整し,焼戻しマルテンサイト組織を有する鋼である.Cr-Mo鋼については,焼入れ焼戻し後に冷間伸線した材料(予ひずみ材)も評価に供した.供試材から直径8 mm,長さ30 mmの試験片を採取し,600番エメリー紙まで研磨を行った後に,以下に述べる浸漬試験,陰極チャージ試験,乾湿繰り返し試験(Cyclic Corrosion Test,CCT),高圧水素ガス中の曝露試験,に供した.浸漬試験および陰極チャージ試験は人為的に制御された水素添加法,CCTおよび高圧水素ガス中の曝露試験は実環境における水素吸蔵を評価する方法に相当する.
浸漬試験には,前述のFIP浴6)および塩酸を用いた.FIP浴中の浸漬には,50℃の20%NH4SCN水溶液を用いた.塩酸浸漬試験には常温の0.36%(0.1 N)塩酸と5%(1.4 N)塩酸の2種の溶液を用いた.陰極チャージ試験には,常温の3%NaCl水溶液,および3 g/LのNH4SCNを加えた3%NaCl水溶液を用いて,カソード電流密度を0.01-1 mA/cm2の範囲で制御した定電流試験,または電位を−0.9~−1.5 V(vs. 飽和Ag/AgCl電極)の範囲で制御した定電位試験を48 hの期間行った.CCTではJASO M 609-9116)の規定に従い,塩水噴霧(35℃,5%NaCl)2 h,乾燥(60℃,RH20-30%)4 h,湿潤(50℃,RH95%以上)2 hの繰り返し試験を最長336 hの期間行った.高圧水素ガス中曝露試験では,水素圧98 MPaおよび140 MPa,温度85℃のオートクレーブ中に試験片を1000 hの期間曝露した.燃料電池自動車や水素ステーションにおける金属材料の使用は通常,温度の上限は85℃,水素ガス圧は最大で100 MPa程度であり,それらを考慮して曝露試験条件を決定した.いずれの試験においても試験直後の試験片は,水素の逃散を防止するため液体窒素または−80℃の冷凍庫にて保管した.その後,試験片中に吸蔵された水素濃度を昇温脱離法により測定した.水素分析前にはエメリー紙を用いて試験片を研磨し,アセトン洗浄,乾燥を行った.分析器にはガスクロマトグラフもしくは四重極質量分析装置を用いた.
Fig. 1に種々の条件で水素チャージを行った試験片の昇温脱離水素分析曲線を示す.Fig. 1(a)はFIP浴中浸漬試験,Fig. 1(b)は陰極チャージ試験,Fig. 1(c)はCCT,Fig. 1(d)は高圧水素中曝露試験である.Fig. 1(a)-Fig. 1(d)に共通の特徴として,Cr-Mo鋼無ひずみ材のピーク温度が最も低いこと,Cr-Mo鋼の予ひずみ材は複数のピークを持つこと,Cr-Mo-V鋼はCr-Mo鋼無ひずみ材よりもピーク温度が高くCr-Mo鋼予ひずみ材と同様に約300℃まで水素放出があること,が挙げられる.また,Cr-Mo鋼予ひずみ材の特徴として,ピーク形状が各チャージ法間で異なることが確認された.すなわち,Fig. 1(b)およびFig. 1(c)では高温側(250℃)のピークが低温側(100-150℃)のピークより高く,Fig. 1(a)およびFig. 1(d)では逆に低温側のピークが高温側のピークより高かった.この機構は,昇温脱離曲線の数値解析により以下のように説明されている13).Fig. 1(b)やFig. 1(c)の条件は吸蔵される総水素濃度が少なく,まず250℃の高温側のトラップサイトに優先的に水素が充填される.一方,Fig. 1(a)やFig. 1(d)のように総水素濃度が多い条件では,250℃のトラップサイトが水素で飽和した後に,より低温側の100-150℃のサイトにも水素がトラップされる.低温側(100-150℃)の水素放出ピークは転位(水素との結合エネルギー27 kJ/mol),高温側(250℃)の水素放出ピークは空孔(結合エネルギー41.5 kJ/mol)への水素トラップを反映すると推察されている13).すなわち,材料によっては水素濃度に応じて水素の存在状態が変化する場合があることに注意を要する.

Profiles of thermal desorption analysis of hydrogen at 100℃/h: (a) FIP, (b) cathodic charging, (c) CCT, (d) high pressure H2.
Fig. 1の昇温脱離曲線で,常温から第一ピークの放出完了温度(350℃)までの水素を積分し,これを室温拡散性水素濃度と解釈した.ただし,Cr-Mo鋼予ひずみ材については,前述の低温および高温ピークの両方を含む値となる.Fig. 1(a)の浸漬試験,Fig. 1(c)のCCT,Fig. 1(d)の高圧水素ガス中曝露試験による水素濃度については後述するが,まずFig. 1(b)の陰極チャージによる水素濃度をFig. 2にまとめた.Fig. 2には定電流および定電位の陰極チャージ試験の両方の結果を併記した.下横軸は定電流試験におけるカソード電流密度であり,相当するデータ点はFig. 2中の大きなマークである.カソード電流密度の増加に伴い水素濃度は増加した.溶液中に水素侵入促進の触媒(NH4SCN)が無い場合(Openマーク)に比べ,NH4SCNを加えると(Solidマーク)水素濃度は増加した.また,Cr-Mo鋼無ひずみ材,Cr-Mo鋼予ひずみ材,Cr-Mo-V鋼の順に水素濃度は増加した.上横軸は定電位試験における電位を示し,相当するデータ点はFig. 2中の小さなマークである.電位の低下により水素濃度は増加した.NH4SCNおよび材質の影響についても,定電流試験と同様の傾向を示した.なお,定電流試験の際の電位変化や,定電位試験の際のカソード電流密度も別途記録しており,各溶液や各材質について,Fig. 2に示す下横軸と上横軸の対応を示すことが確認されている.よって,適切な水溶液の選定,およびカソード電流密度もしくは電位の設定により,各供試材に狙いの量の水素を吸蔵させることができる.

Effect of cathodic current density and applied potential on hydrogen absorption under cathodic hydrogen charging.
Fig. 3に各種水素チャージ法による吸蔵水素濃度を比較した.塩酸(HCl)浸漬試験およびFIP試験については,最長96 hまでの試験を行い,測定された飽和値もしくは最大値をFig. 3にはプロットした.上下のバンドは測定機関間の測定値の差異を示す.塩酸浸漬試験は0.36%(0.1 N)塩酸と5%(1.4 N)塩酸の2条件で実施したが,水素濃度に大きな差は無かった12)ため,Fig. 3には両方の結果をまとめて示した.陰極チャージ試験の上下のバンドは誤差ではなく,Fig. 2に示した人為的に可変な範囲を示す.CCTでは試験期間(乾湿の繰り返し数)の増加に伴っていずれの鋼種においても水素濃度は経時的に増加したが,336 hの時点で水素濃度は飽和傾向にあることが確認されている12).336 hを超えた期間の試験は行っていないが,336 h以降に水素濃度が大きく増加することはないと予想されたため,336 hの試験後の値をFig. 3にはプロットした.高圧水素ガス中の曝露試験は水素圧98 MPaおよび140 MPaの2条件で行っており,両方の結果をFig. 3には示したが,両者の値は非常に近かった12).この試験では試験時間を1000 hとしたが,素材の水素拡散係数を考慮すると試験片の中心部まで水素は充填されており12),1000 hを超えて試験をしても水素濃度はFig. 3と同等と推定される.
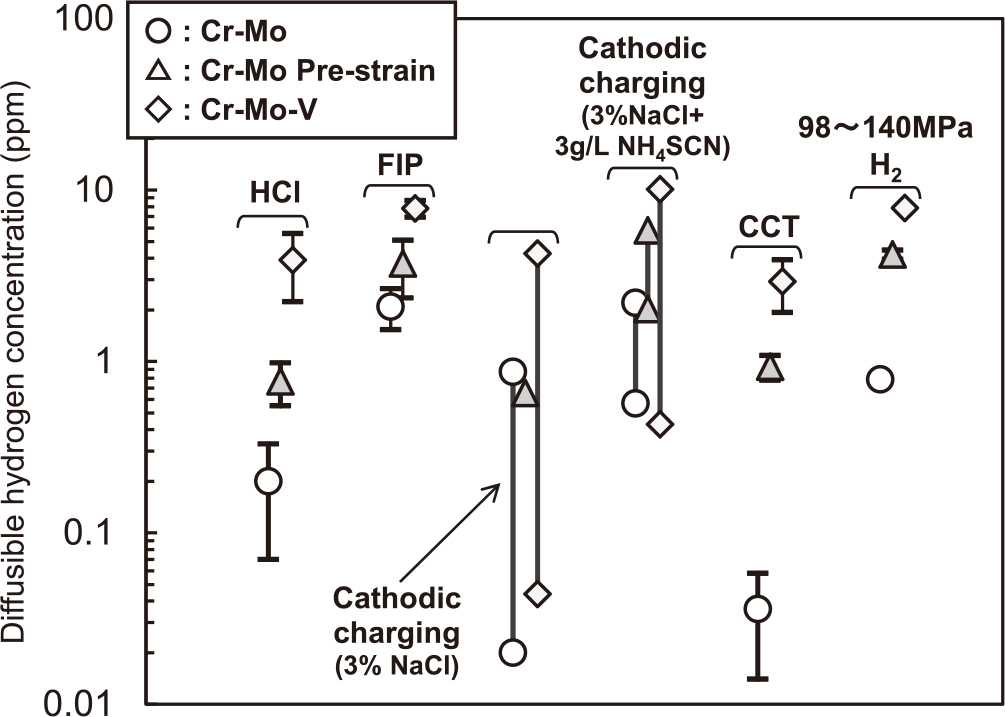
Comparison in absorbed hydrogen concentration between hydrogen charging methods.
Fig. 3から,鋼材の実使用環境として大気腐食環境を想定し,大気腐食模擬環境(CCT)における水素吸蔵を再現する水素チャージ方法としては,塩酸浸漬または3%NaCl中陰極チャージが適当である.塩酸浸漬については,前述のように0.36%(0.1 N)塩酸と5%(1.4 N)塩酸の2条件で水素濃度に差が無かったため,どちらの溶液を用いても良いが,Fig. 3にバンドで示すばらつきが生じた.また,Cr-Mo鋼無ひずみ材では,塩酸浸漬の方がCCTよりも多くの水素を吸蔵した.陰極チャージについては,CCTにおける水素吸蔵を再現する具体的な条件はFig. 2から導かれる.例えばCr-Mo無ひずみ材では3%NaCl中の定電位−0.9~−1.0 V(vs. 飽和Ag/AgCl電極)もしくは定電流0.03-0.1 mA/cm2が,Cr-Mo-V鋼やCr-Mo鋼予ひずみ材では3%NaCl中の定電位−1.0~−1.2 V(vs. 飽和Ag/AgCl電極)もしくは定電流0.1-1 mA/cm2が,それぞれ適切な条件となる.NH4SCNを含む溶液中でも,より高電位もしくは低電流とすることでCCTにおける水素吸蔵を再現することは可能だが,Fig. 2からわかるようにこれらの条件は水素濃度の変動が大きい領域に相当し,水素濃度のばらつきが大きくなる可能性がある.また,試験時間については塩酸浸漬および陰極チャージともに,素材の水素拡散係数と寸法(厚さや径)を考慮し,試験片の中心部まで水素を充填できる時間以上であれば良いと考えられる.
高圧水素ガス中曝露試験ではさらに多量の水素が吸蔵され,これを再現するにはFIP浴またはNH4SCNを添加した溶液中での陰極チャージが適切である.FIP浴は,Cr-Mo鋼予ひずみ材およびCr-Mo-V鋼では,高圧水素ガス環境における水素侵入量を再現できている.ただし,Cr-Mo鋼無ひずみ材では,FIP浴では高圧水素ガス環境よりも多くの水素を吸蔵した.ただし,FIP浴ではNH4SCNの濃度を変化させることにより,水素濃度を変化させることも可能であり17,18),Cr-Mo鋼無ひずみ材ではNH4SCNの濃度を低減することで,高圧水素ガス環境からの水素吸蔵を再現できると推定される.NH4SCNを添加した溶液中での陰極チャージについては,具体的な最適条件はFig. 2から導かれ,例えばCr-Mo無ひずみ材では定電位−0.9~−1.0 V(vs. 飽和Ag/AgCl電極)もしくは定電流0.03-0.1 mA/cm2が,Cr-Mo-V鋼やCr-Mo鋼予ひずみ材では定電位−1.0~−1.5 V(vs. 飽和Ag/AgCl電極)もしくは定電流0.1-1 mA/cm2が,それぞれ適切な条件となる.
いずれの水素チャージ条件においても,Cr-Mo鋼無ひずみ材に対して,予ひずみ材の水素濃度は高かった.ひずみ付与は転位や空孔の密度を増加させ,転位や空孔が水素トラップサイトとして働くことがこの理由と考えられる.Vを含有させたCr-Mo-V鋼は,無ひずみでもCr-Mo鋼予ひずみ材以上の水素を吸蔵した.V系の微細炭化物が水素をトラップする効果4,5)がこの理由と推定される.ただし,Fig. 3からわかるように,水素濃度が少ないチャージ法(HCl浸漬,3%NaCl水溶液中の陰極チャージ,CCT)では各材質の水素濃度の違い(比率)が大きいのに比べて,水素濃度が多いチャージ法(FIP浴中浸漬,NH4SCN入り溶液中の陰極チャージ,高圧水素ガス中の曝露試験)では各材質の違いは小さい.この理由には前述のように,水素濃度が少ないチャージ法では,Cr-Mo鋼予ひずみ材やCr-Mo-Vでは安定な(昇温脱離曲線で高温側にピークがある)サイトに水素がトラップされ,その効果によりCr-Mo鋼よりも顕著に水素濃度が増すことが考えられる.すなわち,安定なトラップサイトに水素を補足し水素脆化を防止する手法は,吸蔵水素濃度が低い場合に有効であることが示唆される.逆に水素濃度が多いチャージ法では安定なトラップサイトが早期に飽和し,各材質間の水素濃度の違いが小さくなると考えられる.
ステンレス鋼は一般に耐食性に優れ,腐食に伴う水素侵入の懸念はほとんど無いが,水素ガス環境で使用された場合には水素脆化の可能性がある.この現象は水素環境脆化(Hydrogen Environment Embrittlement)または水素ガス脆化(Hydrogen Gas Embrittlement)と呼ばれる19-21).近年,来るべき水素社会の到来に向け,水素を燃料として走行する燃料電池自動車や,高圧の水素ガスを貯蔵または供給する水素ステーションの実用化研究が進められており,2章に述べた低合金鋼とともに,ステンレス鋼もこれらの用途に広く使用されている.水素ガス脆化の評価には,高圧の水素ガス環境中で機械試験を行う方法22-25)や,高温高圧の水素ガス中に試験片を曝露して水素を吸収させ,その試験片を取り出した後に大気中で機械試験を行う方法26-30)がある.後者は厳密には吸収した水素による可逆的な水素脆化(水素を逃散させれば脆化は起こらない)という意味で,内部可逆水素脆化(Internal Reversible Hydrogen Embrittlement)19)と呼ばれる.これらの高圧水素ガスに起因した脆化に関しても,外部環境からの水素侵入に着目した解析や,それを再現した評価法が重要となる31-33).前述の鉄鋼協会の研究会において,ステンレス鋼に関しても陰極チャージ試験と高圧水素ガス中の曝露試験の対比が行われており14,15),種々の条件の陰極チャージ試験により高圧水素ガス環境からの水素吸蔵の再現を検討した結果を以下に紹介する14).
共通素材には安定オーステナイト系ステンレス鋼のSUS316Lおよび準安定オーステナイト系ステンレス鋼のSUS304の市販の固溶化熱処理板を用いた.いずれも厚さは0.77 mmである.ひずみの影響の調査のため,無ひずみ材に加えて10%および40%の引張ひずみを付与した予ひずみ材も試験に供した.なお,透磁率測定およびX線回折により,304の40%予ひずみ材ではひずみ誘起マルテンサイトが生成していることが確認されている14,15).陰極チャージについては,2章の低合金鋼と同様に常温の3%NaCl水溶液および3 g/LのNH4SCNを加えた3%NaCl水溶液を用いて,カソード電流密度0.1-10 mA/cm2の定電流試験,保持電位−1.0~−1.5 V(vs. Ag/AgCl)の定電位試験を48 hの期間行った.高圧水素ガス中の曝露試験については,水素圧98 MPa-温度250℃-試験時間72 h,水素圧98 MPa-温度85℃-試験時間1000 h,水素圧140 MPa-温度85℃-試験時間1000 hの3条件で行った.試験後には2章と同様の要領で試験片を冷凍保管した後に,昇温脱離法により吸蔵水素濃度を測定した.
Fig. 4に昇温脱離曲線の例を示す.Fig. 4(a)は316Lの陰極チャージ試験,Fig. 4(b)は316Lの高圧水素ガス中の曝露試験後の分析結果を示す.無ひずみ材,10%ひずみ材,40%ひずみ材の間に,顕著な差は見られなかった.ただし,Fig. 4(a)とFig. 4(b)を比較すると曲線の形状が大きく異なった.また,Fig. 4(c)は304の陰極チャージ試験,Fig. 4(d)は304の高圧水素ガス中の曝露試験後の分析結果を示す.304無ひずみ材および10%ひずみ材は,Fig. 4(a)およびFig. 4(b)の316Lと同様の傾向を示した.一方,304の40%ひずみ材は特異な形状を示し,Fig. 4(c)では無ひずみ材や10%ひずみ材よりも高い値(多い水素濃度)となり,Fig. 4(d)では無ひずみ材や10%ひずみ材と曲線形状(ピーク温度)が異なっていた.これらの挙動はいずれも,以下に述べるように昇温脱離曲線の数値解析に基づき説明できる15).

Profiles of thermal desorption analysis of hydrogen at 100℃/h: (a)-(b) Type 316L, (c)-(d) Type 304.
まず,Fig. 4(a)とFig. 4(b)の違いの機構は以下のように説明できる.面心立方(face centered cubic,fcc)構造のオーステナイト相では水素拡散係数は非常に小さいため,水素添加条件によっては試験片の厚さ方向に水素濃度の分布を生じる.水素濃度分布は,水素拡散係数,試験時間,試験片厚さに応じて決まり34),水素濃度の厚さ方向の分布を計算32,33)するとFig. 5となる.ただし,Fig. 5の縦軸は表面水素濃度を1としたときの相対値,横軸は試験片厚さを2とした場合の相対位置を示す.316Lと304の水素拡散係数には,どちらも4.41 × 10−3exp(−53510/RT)(cm2/s)35)の値を用いた.Rは気体定数(8.31 J/mol),Tは温度(K)である.2章および後述の4章における議論も同様の考え方に基づいているが,試験片の最表面は速やかに環境と平衡する水素濃度に到達し,試験片中の平均水素濃度は,試験片の中心部まで水素が充填される時間で決まる.Fig. 5(a)は常温の陰極チャージ試験の場合の水素濃度分布を示す.この試験は常温で短期間で行っているため,水素は試験片の中心部には到達できず,表面に局在化する.Fig. 5(b)は85℃の高圧水素ガス中の曝露試験の場合の分布を示す.この試験では表面近傍の水素濃度が高いものの,試験片の中心部にもある程度の水素が浸透している.図示略すが,98 MPa水素-温度250℃-72 hの試験では,試験片の内部まで完全に水素が充填されている結果となる.これらの初期水素濃度分布と水素拡散係数の温度依存性に基づき,昇温脱離曲線の数値解析が可能である15).計算の結果,Fig. 5(a)のサンプルを昇温すると速やかに水素は脱離し,Fig. 4(a)のように低温(100℃近傍)にピークを示すことが示されている.一方,Fig. 5(b)のサンプルを昇温すると,Fig. 4(b)のように最表面の水素が脱離する(200℃のピーク)一方で,最表面の一部の水素は試験片の内部に移動し,少し遅れて再び試験片の最表面に再移動し,試験片から放出される(350℃のピーク).図示略すが,98 MPa水素-温度250℃-72 hの曝露材では,昇温脱離分析では高温(350℃ピーク)での放出のみが見られる.これらの計算から,Fig. 4(a)とFig. 4(b)の昇温脱離曲線の形状の違いは試験片中の初期水素濃度分布の違いのみで決まっており,2章の低合金鋼のような水素トラップ状態の違いを反映しているわけではないことが結論付けられている15).なお,SUS316LおよびNi基合金を用いた検討で,試験片の厚さと水素チャージの温度および時間を同一にすると,陰極水素チャージと高圧水素ガス中の曝露試験で昇温脱離曲線は同形状になることが確認されている36).

Distribution of hydrogen in a plate specimen: (a) cathodic charging at RT for 48 h, (b) exposure in 98 MPa H2 at 85℃ for 1000 h.
Fig. 4(c)とFig. 4(d)の304の40%予ひずみ材の特異な挙動も,同様の解析で説明できる15).304の40%ひずみ材ではひずみ誘起マルテンサイト相が生じており,これが水素の拡散パスとして働くと考えられる.実際に304の冷間加工材を用いた水素透過試験では,冷間加工により水素拡散係数が大きくなる35)ことが報告されている.この拡散係数の温度依存性35)を用いて昇温脱離分析曲線の数値解析を行うと,Fig. 4(c)とFig. 4(d)の304の40%予ひずみ材の放出曲線が再現できる15).
Fig. 4の昇温脱離曲線で,常温からの第一ピークの放出完了温度(450℃)までの水素を積分し,この値を吸蔵水素濃度とした.まず,Fig. 4(a)およびFig. 4(c)の陰極チャージ試験による水素濃度をFig. 6にまとめた.Fig. 6は304および316Lの,いずれも無ひずみ材を用いた定電流密度および定電位の試験結果である.Fig. 2と同様に,下横軸は定電流試験におけるカソード電流密度であり,相当するデータ点はFig. 6中の大きなマークである.カソード電流密度の増加に伴い水素濃度は増加した.また,NH4SCN無しの溶液中(Openマーク)よりも,NH4SCNを加えた溶液中(Solidマーク)では水素濃度は増加した.316Lと304の間に顕著な差は認められなかった.上横軸は定電位試験における電位を示し,相当するデータ点はFig. 6中の小さなマークである.電位の低下により水素濃度は増加し,NH4SCNの影響についても定電流試験と同様であった.低合金鋼と同様に,別途実施したカソード分極試験により,下横軸の電流密度と上横軸の電位はFig. 6の対応を示すことが確認されている.よって,適切な溶液の選定と,カソード電流密度もしくは電位の設定により,狙いの量の水素を吸蔵させることができる.

Effect of cathodic current density and applied potential on hydrogen absorption under cathodic hydrogen charging.
Fig. 7に高圧水素ガス中の曝露試験による水素濃度を,陰極チャージ試験と比較して示す.横軸は予ひずみ量である.Fig. 7中の大マークは高圧水素ガス中の曝露試験,小マークは陰極チャージ試験の結果を示す.大マークのOpenは98 MPaH2-85℃-1000 h,Solidは98 MPaH2-250℃-72 hの条件の試験結果である.小マークのOpenは3%NaCl水溶液中の定電流試験,SolidはNH4SCNを加えた3%NaCl水溶液中の定電流試験の結果である.まず,大マークの高圧水素ガス中の曝露試験に比べ,小マークの陰極チャージ試験では,水素濃度は低くなった.試験片中の水素はFig. 5の分布をしていると推定され,Fig. 7の縦軸はFig. 5の濃度分布を持つ試験片で測定された平均水素濃度である.よって,Fig. 5の最表層の水素濃度を比較すると,Fig. 7とは異なる傾向を示す可能性があり,詳細は後述する.また,各材質の挙動の違いとして,316Lは高圧水素ガス中曝露試験および陰極チャージ試験の両方において,予ひずみの影響は小さいことがわかる.オーステナイト系の材料では,水素の格子間固溶による結合エネルギーが大きく,転位との結合エネルギーは小さいと言われており37),2章の低合金鋼とは異なり,予ひずみが水素吸蔵に及ぼす影響は小さいと考えられる.一方,304ではNH4SCN有無の陰極チャージ試験ならびに98 MPaH2-85℃-1000 hの水素ガス中曝露試験では,予ひずみにより水素濃度は増加した.これに対して,98 MPaH2-250℃-72 hの水素ガス中曝露試験では,予ひずみにより水素濃度は減少した.前者の条件では水素が試験片の内部まで充填されていないために,拡散パスとなるマルテンサイト相を有する予ひずみ材の方が,水素濃度が多くなったと考えられる15).一方,後者の条件では前者よりも水素拡散係数が大きく,試験片の内部まで水素が完全に充填されているため,水素の固溶度の小さいマルテンサイト相を有する予ひずみ材の方が,水素濃度が小さくなったと考えられる15).また,40%予ひずみ材では98 MPaH2-85℃-1000 hの試験と98 MPaH2-250℃-72 h試験で水素濃度がほぼ等しい.本来なら試験温度が高い方が水素濃度は多いと考えられ,この機構は現時点では不明である.ただし4章で後述するように,マルテンサイト系ステンレス鋼,オーステナイト系材料ともに表面水素濃度で評価すると,80-300℃の温度範囲では水素濃度の変化は小さい場合が多い.
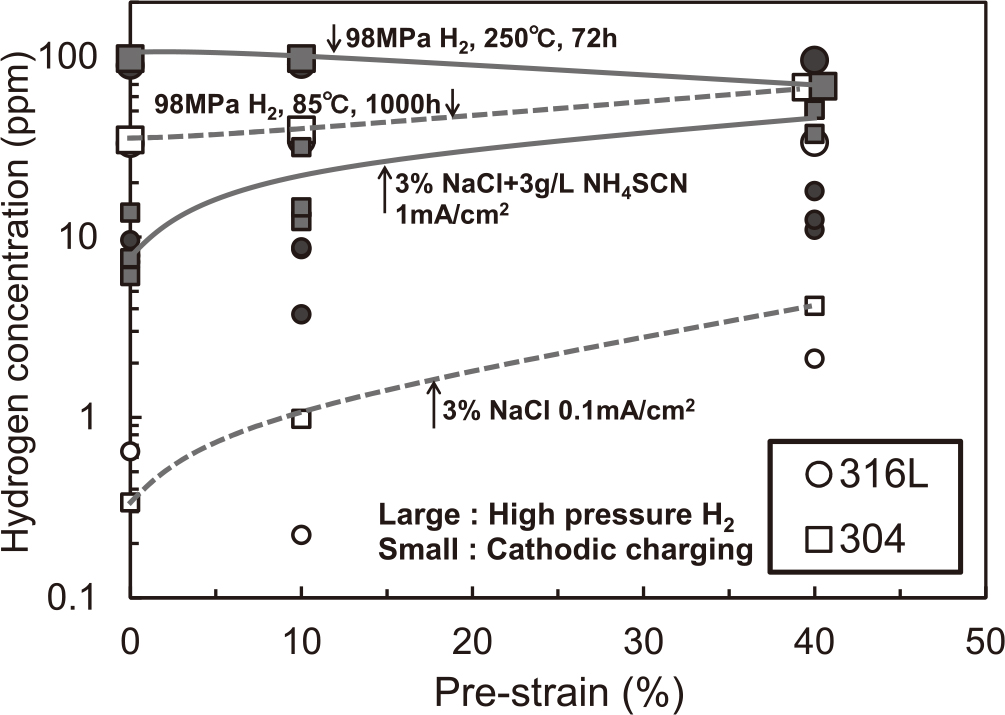
Effect of applied pre-strain on hydrogen absorption.
ここで,Fig. 6-Fig. 7における水素濃度は,Fig. 5の水素濃度分布を有する試験片を用いて分析して得た平均水素濃度である.これらの濃度分布の異なる水素添加法の間の水素濃度を比較するため,Fig. 5の平均水素濃度が実測値に等しくなるとして,Fig. 5の最表面(縦軸が1)の水素濃度を求めた32,33).陰極チャージ試験では平均水素濃度の41倍,85℃の高圧水素ガス中の曝露試験では2.2倍が表面水素濃度となる.250℃の高圧水素ガス中の曝露試験では前述のように試験片中の水素濃度分布は均一のため,平均水素濃度と表面水素濃度は等しい.陰極チャージ試験と高圧水素ガス中の曝露試験による無ひずみ材の表面水素濃度をFig. 8に比較した.高圧水素ガス環境の表面水素濃度は,Fig. 6中の適切な陰極チャージの条件の選定により再現可能である.具体的には,Fig. 6の縦軸の平均水素濃度が1.5-3 ppmとなる条件を選べば,Fig. 8の高圧水素ガス環境の表面水素濃度を再現できる.すなわち,3%NaCl水溶液中であれば定電位−1.2~−1.5 V(vs. 飽和Ag/AgCl電極)もしくは定電流0.1-1 mA/cm2が,NH4SCNを含む水溶液中では定電位−1.0 V(vs. 飽和Ag/AgCl電極)もしくは定電流0.1-1 mA/cm2が,それぞれ適切な条件となる.ただしNH4SCNを含む溶液中では電位および電流値が水素濃度の変動が大きい領域に相当し,水素濃度のばらつきが大きくなる可能性がある.また,これらは最適条件の例であり,NH4SCN量と電位または電流密度の組合せにより,他にも最適条件が存在しうる.このようにステンレス鋼では3%NaCl水溶液中の陰極チャージにより高圧水素ガス環境からの水素吸蔵を再現できるが,低合金鋼では2章で述べたようにNH4SCNを含む溶液を用いるのが望ましい.鋼種により最適な溶液が異なる理由は現時点では不明である.なお,304と316Lについては,高圧水素ガス環境で吸収された水素による脆化挙動を,同じ表面水素濃度となる陰極チャージ下の引張試験で再現できることが確認されている32).一方,A286(JIS SUH660)やA718などの析出強化型のオーステナイト系材料では,高圧水素ガス中の曝露試験と陰極チャージ試験で,同じ表面水素濃度下でも脆化特性が一致しないことも確認されている33).

Comparison in surface hydrogen concentration between hydrogen charging methods.
高合金も3章のステンレス鋼と同様に,腐食に伴う水素侵入の懸念は無いが,炭素鋼などの腐食し易い異種金属と接触した場合に,カソードサイト(水素発生サイト)となることにより,水素が侵入する場合がある38).また,高圧水素ガス環境で使用された場合にも水素脆化の危険性がある.低合金鋼,ステンレス鋼,高Ni合金などの広範囲の材料を用いて,種々の条件の陰極チャージにより実環境(油井環境,高圧水素ガス環境)における水素吸蔵の再現を試みた例を以下に紹介する.なお,本章に述べる内容は新規の検討結果である.
供試材には,降伏強さが758 MPa級のCr-Mo含有鋼(0.27%C-1.3%Mn-0.5%Cr-0.1%Mo)8)およびCr-Mo-V含有鋼(0.27%C-1%Cr-0.7%Mo-0.1%V)7,8),降伏強さ668 MPa級の13%のCrを含有するマルテンサイト系ステンレス鋼(0.2%C-13%Cr)39),降伏強さ862 MPa級の二相ステンレス鋼(25%Cr-7%Ni-3%Mo-2%W-0.3%N)40),降伏強さ758 MPa級の高Ni合金(25%Cr-31%Ni-3%Mo)41)の,いずれも実鋼管を用いた.Cr-Mo鋼,Cr-Mo-V鋼,13%Cr鋼は単相の焼戻しマルテンサイト組織,二相ステンレス鋼はフェライトとオーステナイトの二相組織,高Ni合金は単相のオーステナイト組織を有する.Cr-Mo鋼,Cr-Mo-V鋼,13Cr鋼からは厚さ2 mm,二相ステンレス鋼と高Ni合金からは厚さ0.5 mmの薄板試験片を採取した.試験片の表面を600番エメリー紙まで湿式研磨後,水素チャージ試験に供した.試験後の試験片は冷凍保管し,昇温速度10℃/minで昇温脱離水素分析を行った.分析器には四重極分析装置を用いた.Cr-Mo鋼,Cr-Mo-V鋼,13Cr鋼については,マルテンサイト系材料の3種については400℃までに放出された水素を室温拡散性水素と解釈した.二相ステンレス鋼と高Ni合金については600℃までに放出された水素を積分し水素濃度を求めた.
まず,陰極チャージ試験には25℃の3%NaCl水溶液に最大30 g/LのNH4SCNを加えた溶液を用いて,保持電位−1.2 V(vs. 飽和Ag/AgCl電極)で48 hの定電位試験を行い,その後に昇温水素分析を行った.ここで3章で述べたように,水素の拡散が遅い材料では,今回の陰極チャージ時間(48 h)では試験片の内部まで水素が充填されていない可能性がある.各素材の25℃における水素拡散係数Dを,Cr-Mo鋼は1 × 10−5 cm2/s4),Cr-Mo-V鋼は3 × 10−6 cm2/s4),13Cr鋼は3 × 10−7 cm2/s39),二相ステンレス鋼は3 × 10−9 cm2/s40),高Ni合金は1 × 10−11 cm2/s41,42)とし,3章と同様の方法でFig. 5のような試験片中の水素濃度分布を計算した.ここで二相ステンレス鋼については,文献中40)の陰極チャージ下における吸蔵水素濃度の時間変化と飽和値から,水素拡散係数を見積もっている.計算の結果,Cr-Mo鋼,Cr-Mo-V鋼,13Cr鋼では水素は完全に試験片中に充填され,二相ステンレス鋼ではわずかに水素濃度分布が生じ,高Ni合金では試験片の表面付近にしか水素が吸蔵されていないと推定された.水素の充填率(Fig. 5の最表層の水素濃度に対する平均水素濃度の比率)は,Cr-Mo鋼,Cr-Mo-V鋼,13Cr鋼では100%,二相ステンレス鋼では98.6%,高Ni合金ではわずかに8.5%であった.水素濃度の分布と実測された試験片中の平均水素濃度から表面の水素濃度を求め,主要な合金元素の含有量(Cr,Ni,Moの合計量,mass%)で整理してFig. 9に示す.同じ陰極チャージ条件では,Cr-Mo鋼に比べCr-Mo-V鋼の水素濃度は1桁大きく,これは2章でも述べたように微細なV系炭化物による水素トラップ効果が表れていると考えられる.13Cr鋼はCr-Mo鋼やCr-Mo-V鋼よりもさらに多くの水素を吸蔵し,これは固溶合金元素による水素トラップ効果39)が理由と推定される.二相ステンレス鋼(Duplex Stainless Steel,DSS)と高Ni合金(Ni alloy)は,13Cr鋼よりもさらに多くの水素を吸蔵した.これは,体心立方(body centered cubic,bcc)構造のマルテンサイト相よりも,fcc構造のオーステナイト相の方が水素の固溶度が大きい1)ためと考えられる.また,各材料とも溶液中のNH4SCN量が増すと吸蔵水素濃度は増加した.ただし,NH4SCN量に対する水素濃度の増加割合は,Cr-Mo鋼が最も比率としては最も大きく,次がCr-Mo-V鋼であり,13Cr鋼,二相ステンレス鋼,Ni基高合金では小さくなった.2章のFig. 3では,Cr-Mo鋼無ひずみ材では水素濃度が少ないチャージ法に比べ,水素濃度が多いチャージ法による水素濃度の増加代が大きく,Cr-Mo鋼予ひずみ材やCr-Mo-V鋼では増加代が小さい.この理由は2章で述べたように,異なるトラップエネルギーを持つサイト間の水素濃度の分配の違いで説明できる.Fig. 9中のマルテンサイト系の3種の材料に関しても同様の機構が働いたと推定され,Cr-Mo-V鋼や13Cr鋼などの水素トラップ能の強い鋼種では,通常鋼(Cr-Mo鋼)に比べマイルドな水素添加条件でも多くの水素を吸蔵し,NH4SCNの影響が小さく表れたと推定される.また,Fig. 9中で二相ステンレス鋼やNi基合金では水素濃度に及ぼすNH4SCNの影響が他の材料に比べ小さかったが,3章で述べたステンレス鋼も2章の低合金鋼に比べ,水素濃度のNH4SCN量への依存性が小さかった.この機構は現時点では不明だが,オーステナイト相中の水素の拡散の活性化エネルギーは後述のように47-54 kJ/mol程度と報告されており35,41),2章で述べたマルテンサイト系材料の各種サイトによるトラップエネルギーよりも大きいことから,外部環境の過酷度(NH4SCN量)に対する材料中の水素濃度の変化代が小さくなっている可能性がある.なお,Fig. 9中には後述する高圧水素ガス中の曝露試験による吸蔵水素濃度も併記したが,各材料の吸蔵水素濃度の大小の順列は,陰極チャージ試験と同様であった.また,両者の方法間の水素濃度の対応については本章の末尾で後述する.

Effect of the amount of NH4SCN on surface hydrogen concentration under cathodic hydrogen charging.
実環境における吸蔵水素濃度に関して,2-3章では大気腐食環境および高圧水素ガス環境を想定した.一方,本章で用いた材料は油井管としても用いられるため,油井(模擬)環境において報告されている水素濃度とFig. 9の陰極チャージによる水素濃度を以下のように比較した.Cr-Mo-V鋼については,常温の1-15 barの湿潤硫化水素環境の自然浸漬で2.3 ppm7),100 bar-107℃の高温高圧硫化水素環境の自然浸漬で1.5 ppm8)との報告例があり,Fig. 9のように10-30 g/LのNH4SCNを添加した溶液中の陰極チャージでこれらの水素吸蔵を再現できる.13Cr鋼については,1 barの湿潤硫化水素環境中の自然浸漬で最大5 ppmの水素吸蔵が確認されており43),3-10 g/LのNH4SCNを添加した溶液中の陰極チャージでこの水素吸蔵が再現できる.二相ステンレス鋼の実鋼管では,炭素鋼との異種金属接触で30 ppmの水素吸蔵が報告されており38),NH4SCNを添加しない3%NaCl水溶液中の陰極チャージでこの水素濃度が再現できる.高Ni合金の炭素鋼との異種金属接触による水素脆化試験では表面水素濃度に換算し80 ppmの水素吸蔵が推定されており40),Fig. 9のNH4SCNを添加しない3%NaCl水溶液中の陰極チャージではこれより多い量の表面水素濃度となる.上記は保持電位を−1.2 V(vs. 飽和Ag/AgCl電極)に固定した場合の最適NH4SCN量であるが,2-3章で述べたように電位や電流密度を変化させれば,実環境の再現条件は他にも存在すると考えられる.
Fig. 9の表面水素濃度C0と水素拡散係数Dの積から,水素透過係数C0Dを見積もることができる.この値は,水素透過試験を行った際の水素の透過速度に相当する.Fig. 10にC0Dを合金元素含有量で整理した.Cr-Mo鋼,Cr-Mo-V鋼,13Cr鋼は,同じ水素チャージ条件(NH4SCN量)ではC0Dは同程度である.すなわち,Cr-Mo-V鋼や13Cr鋼は水素トラップ効果のためCr-Mo鋼よりも水素濃度C0は1桁大きくなるが,同じ割合でDが小さくなる.水素トラップサイトの有無に関わらず,同じ水素チャージ条件では一般鋼と水素トラップ鋼の水素透過係数は等しくなる現象は過去に報告されている44,45).この理由は,水素トラップサイトの体積が充分小さい場合には,格子間固溶水素(水素透過の流量を担う水素)とトラップされた水素が局所平衡を保ち,見かけ上水素で埋まったトラップサイトは水素の流束に影響しなくなることと考えられる46,47).一方,二相ステンレス鋼およびNi基合金では,マルテンサイト系材料に比べC0Dは低下した.すなわち,オーステナイト相が含まれることで,C0Dは低下する.Fig. 10には前述の各材料の水素拡散係数を併記したが,高Ni合金はCr-Mo鋼と比べると,吸蔵水素濃度C0は3-4桁大きくなるのに対し,水素拡散係数Dは6桁小さくなることが,C0Dが極端に小さくなった理由である.この整理はオーステナイト系材料では水素の透過速度が極めて小さく,水素透過試験が難しいことを示している.304の常温における水素透過試験では厚さ30 µmの薄膜が用いられた例もある35).

Comparison in hydrogen permeability (C0D) between the investigated materials.
また,以下に高圧水素ガス環境における水素吸蔵挙動について述べる.2-3章では代表的な条件における水素濃度を用いたが,高圧水素ガス環境からの吸蔵水素濃度は水素ガス圧や温度に依存し変化する可能性がある.そこで本章では前述の陰極チャージ試験と同じ供試材を用いて,常温~300℃,圧力20-80 MPaの高圧水素ガス環境中に48 hの間曝露し,昇温脱離分析により吸蔵水素濃度を測定した.陰極チャージ試験と同様に,Cr-Mo鋼,Cr-Mo-V鋼,13Cr鋼では厚さ2 mm,二相ステンレス鋼,316L,高Ni合金では厚さ0.5 mmの試験片を用いた.Fig. 11に20 MPaの条件における各鋼種の水素吸蔵に及ぼす温度の影響を示す.いずれの鋼種も,温度上昇に伴い水素濃度は増加した.ただし,いずれの鋼種も常温では水素吸蔵はほとんど起こらず,それぞれの鋼種において水素吸蔵が起こり始める臨界温度が存在した.臨界温度はCr-Mo鋼,Cr-Mo-V鋼,13Cr鋼,二相ステンレス鋼(DSS),316Lでは80℃,高Ni合金(Ni alloy)では50℃であった.Fig. 12に80 MPaの条件の試験結果を示す.Fig. 11の20 MPa環境と比べるとより多くの水素が吸蔵された.また,水素吸蔵が起こり始める臨界温度は,Cr-Mo鋼,Cr-Mo-V鋼,13Cr鋼では50℃であり,Fig. 11の20 MPa環境よりも臨界温度は低くなった.二相ステンレス鋼(DSS),316L,高Ni合金(Ni alloy)の臨界温度は明確でないが,見かけ上は常温から連続的に水素が吸蔵された.低合金鋼(Cr-Mo-V鋼)において,常温では水素吸蔵が起こりにくく,水素吸蔵が起こり始める臨界温度が存在することは過去の検討でも確認されており10),試験片表面の酸化物皮膜が水素分子の解離反応の障壁になる機構が推察されている.ただし,水素ガス中で塑性変形を与えると,常温以下の温度(−40℃)でも水素吸蔵が起こることも確認されている10).
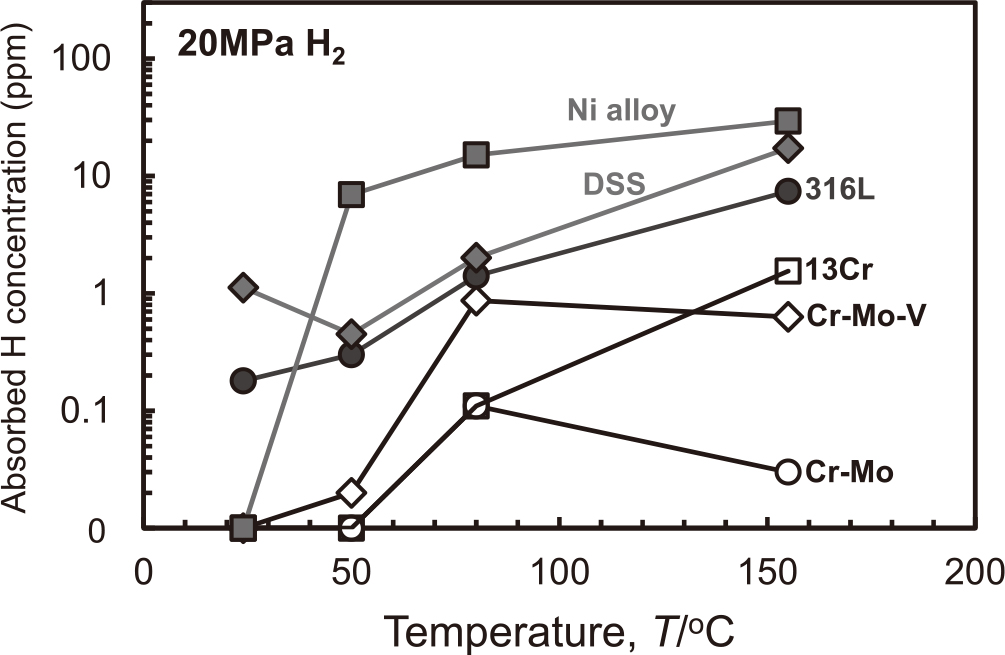
Effect of test temperatures on hydrogen absorption in high pressure gaseous hydrogen at 20 MPa.

Effect of test temperature on hydrogen absorption in high pressure gaseous hydrogen at 80 MPa.
3章および本章の前半でも述べたように,fcc系の材料はbcc系の材料に比べて水素の拡散が遅く,今回の曝露条件によっては試験片の中心部まで水素が充填されていない可能性がある.316Lおよび高Ni合金において,3章の方法で試験片の板厚方向の水素濃度分布を計算した.ここで,316Lの水素拡散係数Dは3章の通りに4.41 × 10−3exp(−53510/RT)(cm2/s),高Ni合金は1.87 × 10−3exp(−47070/RT)(cm2/s)41)とした.Rは気体定数(8.31 J/mol),Tは温度(K)である.曝露試験温度に応じ,表面水素濃度を計算するとFig. 13のようになる.水素の充填率は,316Lでは200℃以上,高Ni合金では150℃以上でほぼ100%との計算結果となった.316Lでは20 MPa環境では傾向が顕著でないが,80 MPa環境では150℃以上で表面水素濃度が急増し,200-300℃で飽和した.ただし,Fig. 13中の316Lの水素圧80 MPa-温度80℃条件における水素濃度は,3章で紹介した水素圧98 MPa-温度85℃条件における水素濃度に比べ少なかった.一方,高Ni合金(Ni alloy)では,表面水素濃度で整理すると20 MPa,80 MPa中曝露試験ともに,温度依存性があまり見られなかった.すなわち,高Ni合金では水素侵入は比較的低温(常温~50℃)から起こっているが,低温では試験片中に水素が充填されていないため,Fig. 11-Fig. 12のように温度上昇に伴い水素濃度が増加しているように見えると推定される.高Ni合金は316Lや二相ステンレス鋼と同程度のCrを含有するため,表面にはこれらのステンレス鋼と同程度の厚さの酸化物皮膜を形成していると考えられるが,Niが水素侵入の触媒として働き,Fig. 13の挙動を示した可能性が考えられる.

Effect of test temperature on surface hydrogen concentration in high pressure gaseous hydrogen.
Fig. 9中には,Fig. 11-Fig. 12で測定された最大水素濃度(水素圧80 MPa-温度300℃)を陰極チャージによる水素濃度と比較して示している.マルテンサイト系材料3種と二相ステンレス鋼については,適切な量のNH4SCNを添加した水溶液中の陰極チャージにより,この高圧水素ガス環境における水素侵入量を再現できる.すなわち,Cr-Mo鋼では3-10 g/L,Cr-Mo-V鋼では10 g/L,13Cr鋼ではNH4SCN添加無し,二相ステンレス鋼では0-3 g/Lが適切な添加量である.一方,高Ni合金ではNH4SCN無しの溶液を用いても陰極チャージの方が多くの水素を吸蔵し,水素濃度を下げるためには電位もしくは電流密度の調整がさらに必要である.また,水素ガス環境の水素圧や温度に対応してFig. 11-Fig. 12のように各材料の水素濃度が変化した場合には,それらを再現するにはNH4SCN量および電位,電流密度の最適化が必要と考えられる.
本報では,低合金鋼,ステンレス鋼,高合金を用いて種々の方法で水素添加を行い,昇温脱離分析により水素の吸蔵挙動を比較した研究例を紹介した.いずれの材料においても,適切な水溶液の選定や,陰極チャージの際のカソード電流密度や電位の設定により,実環境における水素吸蔵を再現できる.ただし,低合金鋼では材質と水素濃度に応じて,水素のトラップ状態が変わる場合があることに注意を要する.逆にオーステナイト系の材料では,見かけ上の昇温脱離曲線の違いは試験片中の初期水素濃度分布で決まっており,水素トラップ状態が異なるわけではない点に注意を要する.これらの知見が,今後適切な水素脆化評価法に活用されることが期待される.