2013 年 46 巻 9 号 p. 635-646
2013 年 46 巻 9 号 p. 635-646
目的:直腸癌に対する神経周囲浸潤(perineural invasion;以下,PNIと略記)の予後規定因子としての意義を解析した.方法:直腸切除を行った直腸癌412例を検討し,1996~2005年は後ろ向きに2006~2010年は前向きに検討した.結果:144例(35.4%)でPNIが陽性であり,上部直腸癌の陽性率は43.7%,下部直腸癌は24.7%であった.PNI陽性症例の病理組織学的因子の多変量解析ではPNIと上部直腸癌,リンパ管侵襲,脈管侵襲および低分化胞巣間に相関がみられた.PNI陽性の3年生存率と5年生存率はそれぞれ56.2%と37.3%であり,PNI陰性はそれぞれ79.6%と72.6%であった.PNIのみられた症例は予後が不良であった(P<0.001).Stage II症例において,PNI陰性の5年生存率が82.7%に対してPNI陽性は44.0%(P=0.008)であり,PNIはN0でも予後因子であることが示された.予後因子では,リンパ節転移,壁深達度,PNIに有意差を認め,リンパ管浸潤や脈管浸潤に有意差は認めなかった.局所再発規定因子として,壁深達度T3/T4とPNIに有意差を認めた.結語:直腸癌のPNIは予後および局所再発の危険因子であり,TNM分類のT因子,N因子を補填する因子としてリンパ管侵襲および脈管侵襲以上に臨床病理学的意義は大きい.
大腸癌の病期分類にはAJCC(American Joint Committee on Cancer)1),Dukes,Astler-Coller classificationおよびJCCC(Japanese Classification Colorectal Carcinoma)などがあり,遠隔転移,壁深達度(T因子)とリンパ節転移(N因子)で分類された病期に基づく治療法を提示している.一方,National Comprehensive Cancer Network(以下,NCCNと略記)ガイドラインは組織形態である節外非連続胞巣を組み入れ,リンパ節転移の亜分類N1cと分類している2).2011年改訂版(Rectum and Colon Version 3 2011)では神経周囲浸潤(perineural invasion;以下,PNIと略記)を病理組織学的因子として記載することを推奨している.NCCNガイドラインはこのような新しい病理組織学的因子を用いて細分化することで効率的な治療法を提言し,治療成績の向上を図っている.PNIに関して本邦では,1990年代に直腸癌に対する自律神経温存側方郭清の妥当性に関する報告が盛んに行われていた.その後,進行直腸癌の予後因子として検討されているが,臨床的意義は確立されていない.今回,NCCNガイドラインに取り上げられたPNIの意義を自験直腸癌にて検証したので報告する.
1996年2月から2010年3月の間に仙台医療センターにて切除され,病理組織学的診断の明確な直腸腺癌412例を検討対象とした.臨床病理学的特徴および先進部組織形態:PNI,Buddingと低分化癌胞巣の評価を行った.切除標本を10%ホルマリン液に固定後,腫瘍中心部を通る腸管縦軸方向の切片を作成し,HE染色し光学顕微鏡にて組織検討を行った.
PNIの定義はBatsakis3)およびLiebigら4)が提唱するようにendoneurium,perineuriumそしてepineuriumいずれかの層に癌浸潤がみられたものとし,Auerbach’s plexus,外輪筋のlongitudinal intramuscular plexusあるいは外縦筋と漿膜間subserous plexusのいずれかにみられる癌浸潤を神経浸潤と判定した.PNIの確定診断には腫瘍辺縁部の所見を重視し,神経周囲間隙,神経線維束内に癌細胞がみられる所見をPNIとし,4段階に評価した.PNIを認めないをpn0,極めて軽度(全標本中に1~2個)のPNIをpn1(Fig. 1),pn1とpn3の中間程度のPNIをpn2(Fig. 2),極めて高度(多くの切片に病変)のPNIをpn3(Fig. 3)とし,pn1~3をPNI陽性とし,pn0を陰性として判定した.また,S100染色で神経を染色し,腫瘍細胞に占居された神経を確認した(Fig. 4).Buddingおよび低分化癌胞巣は大腸癌研究会の定義にしたがって,Buddingは5個未満の癌細胞あるいは小腺管による浸潤病変を確認し,浸潤先進部において接眼レンズ10倍,対物レンズ20倍(実視野面積0.785 mm2)で最も多くBuddingが含まれる1視野内にBuddingが0~4個をgrade 1,Buddingが5~9個をgrade 2,Buddingが10個以上をgrade 3と分類した.grade 2ないしgrade 3をBudding陽性とし,grade 1をBudding陰性と判定した5).そのうちリンパ管侵襲ありのもの,癌と判定が不能なもの,膿瘍などの炎症所見に付随しての組織形態をとった病変は除外した.低分化癌胞巣の評価は間質浸潤を呈する癌胞巣の中で5個以上の細胞からなる腺腔形成の乏しい癌胞巣を検索し,接眼レンズ10倍,対物レンズ4倍にて0~9個の癌胞巣をgrade Aと判定し,10個以上の癌胞巣を認めるものをgrade B,接眼レンズ10倍,対物レンズ40倍にて低分化癌胞巣が視野全体を占めるものをgrade Cと分類した6).grade Bないしgrade Cを低分化癌胞巣陽性とし,grade Aを陰性と判定した.壊死変性や炎症細胞浸潤などにより断片化した癌組織および“粘液湖”に浮遊する癌細胞は除外した.

Perineural invasion can be seen in human rectal cancer specimens that were stained with HE counterstain. Section of human rectal cancers was stained with hematoxylin and eosin. Cancer cell located and invaded slightly at the perineurium (pn1).

Perineural invasion can be seen in human rectal cancer specimens that were stained with HE counterstain. Section of human rectal cancers was stained with hematoxylin and eosin. Cancer cell located and invaded moderately at the perineurium and within the epineurium (pn2).

Perineural invasion can be seen in human rectal cancer specimens that were stained with HE counterstain. Section of human rectal cancers was stained with hematoxylin and eosin. Cancer cell located and invaded extremely at the perineurium and within the epineurium (pn3).
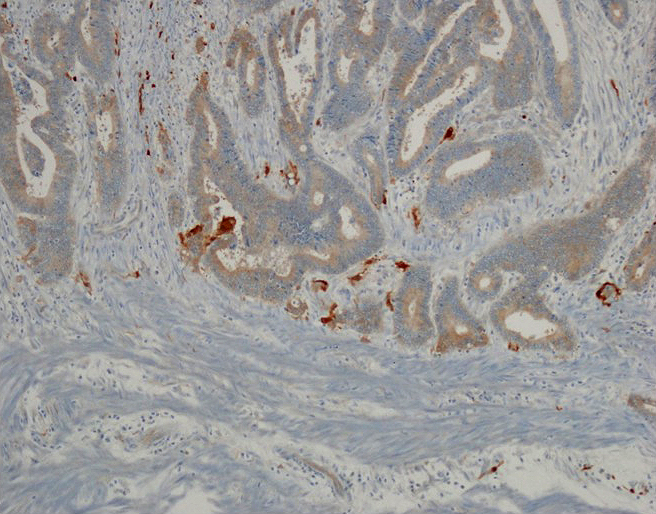
This photomicrograph depicts perineural invasion in rectal cancer specimens. Section of human rectal cancers was stained with S-100 proteins. Tumor is located within the perineurium and has invaded the endoneurium. Nerve cells are stained and cancer cells occupy Auerbach’s plexus.
病理組織学的評価は仙台医療センター病理診断科に依頼し,1996~2005年の191例はretrospectiveに再評価し,2006~2010年の221例は切除標本の臨床組織診断時に追記し解析した.症例の観察期間は30~3,900日で平均2,112日,中央期間は1,940日であった.また,3年経過した症例は282例(68.4%),5年経過した症例は196例(47.6%)であった.
側方郭清の適応は腫瘍下縁が下部直腸に達する進行癌とし,両側自律神経を温存し大腸癌治療ガイドライン7)に従いリンパ節263,273および283は郭清し,293は術前・術中に必要と判断した症例のみ郭清した.本検討では下部直腸癌,肛門管癌190例中119例(62.6%),下部直腸癌,肛門管癌stage IIおよびIIIa,IIIbの149例中99例(66.4%)に側方郭清を施行した.また,stage IV症例を除いた345例中,R0手術を319例(92.5%)に,R1手術を20例(5.8%)に行い,R2手術は6例(1.7%)であった.
統計学検定は,因子間の解析にはχ2乗検定を用い,累積生存率に関してはKaplan-Meier法にて解析しlog lank検定を行った.また,多変量解析はロジスティック回帰分析を行った.統計ソフトはSPSS II for Windowsを使用した.
男女比は250:162で男性が60.7%と多く,80歳以上の高齢患者は41例(10%)であった.占居部位は上部直腸癌 222例,下部直腸癌186例,肛門管癌4例であった.腫瘍径が5 cm以上の症例が210例(51%)を占め,397例(96.4%)が腺癌でそのうち低分化腺癌は18例(4.5%)であった.リンパ節転移は184例(44.7%)がN0であり,218例(52.9%)がN1,N2およびN3であった(Table 1).
| Sex | Male | 250 | 60.7% |
| Female | 162 | 39.3% | |
| Age | Less than 80 | 371 | 90.0% |
| 80 or more | 41 | 10.0% | |
| Diameter | Less than 5 cm | 202 | 49.0% |
| 5 cm or more | 210 | 51.0% | |
| Tumor type | Adenocarcinoma | 397 | 96.4% |
| Mucinous and signet | 15 | 3.6% | |
| Tumor differentiation | Poor differentiated | 18 | 4.5% |
| Others | 379 | 95.5% | |
| N | 0 | 184 | 44.7% |
| 1–3 | 218 | 52.9% | |
| 4 or more | 10 | 2.4% |
N: lymph nodes metastasis, Diameter: maximum diameter of tumor
PNI陽性は144例(35.4%)で,その内pn1は114例(27.7%),pn2は21例(5.1%),pn3は9例(2.2%)であった(Table 2).PNIの有無に性差はなかったが,占居部位では上部直腸癌の陽性率は43.7%で,下部直腸癌陽性率の24.7%に比べPNIは高率にみられた(P<0.001).進行度別にみると,壁深達度においてはT3,T4で有意に多く(P<0.001),リンパ節転移でもN3,N4に高率で(P<0.001),病期別では進行例ほど陽性率が高かった(P<0.001).リンパ管侵襲および静脈侵襲が高度な症例ほど神経浸潤の頻度が高く(P<0.001,P<0.001),主組織型では低分化腺癌が他の組織型に比べPNIの頻度が高かった(P<0.005)(Table 3).
| PNI | pn 0 | 266 (64.6%) |
| pn 1 | 114 (27.7%) | |
| pn 2 | 21 (5.1%) | |
| pn 3 | 9 (2.2%) | |
| Budding | grade 1 | 262 (63.6%) |
| grade 2 | 92 (22.3%) | |
| grade 3 | 58 (14.1%) | |
| Poorly component | grade A | 282 (68.4%) |
| grade B | 79 (19.2%) | |
| grade C | 51 (12.4%) |
Poorly component: Poorly differentiated component at tumor front
| PNI (–) | PNI (+) | P | χ2 | ||
|---|---|---|---|---|---|
| Sex | Male | 167 | 83 | 0.354 | 0.858 |
| Female | 101 | 61 | |||
| Location | Ra | 125 | 97 | <0.001 | 16.18 |
| Rb | 140 | 46 | |||
| P | 3 | 1 | |||
| T | T1 | 19 | 1 | <0.001 | 24.3 |
| T2 | 44 | 8 | |||
| T3 | 185 | 116 | |||
| T4 | 19 | 19 | |||
| Stage (JACC) | I/II | 145 | 28 | <0.001 | 62.7 |
| IIIa | 68 | 41 | |||
| IIIb | 29 | 34 | |||
| IV | 26 | 41 | |||
| N | 0 | 151 | 33 | <0.001 | 50.34 |
| 1, 2 | 106 | 87 | |||
| 3 | 9 | 16 | |||
| 4 or more | 2 | 8 | |||
| Lymphatic invasion | None, mild | 193 | 37 | <0.001 | 81.50 |
| Moderate, marked | 75 | 107 | |||
| Venous invasion | None, mild | 71 | 43 | <0.001 | 43.24 |
| Moderate, marked | 97 | 101 | |||
| Histological type | Well | 20 | 2 | 0.005 | 14.93 |
| Moderately | 230 | 127 | |||
| Poorly | 7 | 11 | |||
| Mutinous | 11 | 3 | |||
| Others | 0 | 1 |
JACC: Japanese classification of colorectal carcinoma, T: depth of tumor invasion, N: Lymph node metastasis
PNIと同様に評価したBuddingは,grade 1が262例(63.6%),grade 2が92例(22.3%),grade 3が58例(14.1%)であり,Budding陽性率は36.4%であった.また,低分化癌胞巣はgrade Aが282例(68.4%),grade Bが79例(19.2%),grade Cが51例(12.4%)と判定され,低分化癌胞巣陽性率は31.6%であった(Table 2).
ロジスティクス回帰検定による単変量解析で,Budding,低分化癌胞巣とPNIに相関を認めた(P<0.001,P<0.001).同様にPNI陽性と他因子の相関を単変量解析すると,リンパ節転移N2,N3およびN4,壁深達度s2/a2,si/ai,腫瘍占居部位Ra,リンパ管侵襲ly2/ly3,脈管侵襲v2/v3で有意差を認めた.PNIの出現と各因子の関連をステップワイズ法で多変量解析すると,占居部位,リンパ管侵襲,脈管侵襲および低分化癌胞巣が有意水準5%以下で有意差を認めた.また,odd’s ratioはリンパ管侵襲3.79,占居部位2.60,脈管侵襲2.26,先進部低分化胞巣2.04でPNIの出現との関連が示された(Table 4).
| Factor | Univariate analysis | Multivariate analysis | ||||
|---|---|---|---|---|---|---|
| Odd’s ratio | P | 95%CI | Odd’s ratio | P | 95%CI | |
| N | 4.069 | <0.001 | 2.546–6.503 | 2.066 | 0.013 | 1.166–3.661 |
| T | 2.009 | <0.001 | 1.322–3.053 | 1.10 | 0.739 | 0.530–1.570 |
| Location (Ra) | 2.437 | <0.001 | 1.594–3.727 | 2.60 | <0.001 | 0.232–0.634 |
| Ly | 7.440 | <0.001 | 4.701–11.776 | 3.79 | <0.001 | 2.142–6.560 |
| V | 0.242 | <0.001 | 0.156–0.373 | 2.26 | 0.003 | 1.331–3.854 |
| Budding | 2.930 | <0.001 | 1.920–4.472 | 1.513 | 0.228 | 0.771–2.966 |
| Poorly component | 2.911 | <0.001 | 1.890–4.485 | 2.036 | 0.046 | 1.013–4.092 |
N: lymph node metastasis, T: depth of tumor invasion, Ra: upper rectum, Ly: lymphatic invasion, V: venous invasion, Poorly component: poorly differentiated component at tumor front
PNIを予後因子としてKaplan-Meier法にて解析した結果,PNI陰性では3年および5年生存率は79.6%,72.6%に対し,PNI陽性はそれぞれ56.2%,37.3%と予後不良であった(P<0.001)(Fig. 5).また,Stage II症例においてPNI陰性は5年生存率82.7%であり,PNI陽性は44.0%(P=0.008)であった(Fig. 6).同様に,Stage III症例ではPNI陰性の5年生存率は69.1%であり,PNI陽性は47.6%(P=0.048)で有意差がみられた.PNIはリンパ節転移にかかわらず予後規定因子であることが示唆された.

Survival rates of patients who underwent rectal resection according to perineural invasion status: Prognosis of the PNI-positive group is significantly poorer than that of the PNI-negative group (P<0.001).

Survival rates of patients who underwent curative surgery for rectal cancer penetrating muscularis propria and without lymph node metastasis according to perineural invasion status: Prognosis of the PNI-positive group is significantly worse than that of the PNI-negative group (P<0.001).
N,T因子を補填する因子としてリンパ管侵襲,脈管侵襲とPNIを比較するために,ステップワイズ法で変数を選択してCox比例ハザードモデルを用いて多変量解析した.予後に関わる因子ではリンパ節転移(P<0.001),壁深達度(P<0.001),PNI(P=0.001)に有意差を認めた(Table 5).観察期間中の再発は31.1%にみられ,初回の再発部位は局所再発8.0%,肝転移8.3%および肺転移6.1%であった.再発形式に関わる因子を多変量解析し,局所再発に関わる因子として壁深達度(P<0.001,odd’s ratio 3.028)とPNI(P=0.003,odd’s ratio 2.602)に,肝転移に関わる因子ではリンパ節転移(P=0.001,odd’s ratio 3.920)に有意差を認め,同様に肺転移では壁深達度(P=0.041,odd’s ratio 2.522)に有意差を認めた(Table 6).
| P | Exp | 95% (CI) | ||
|---|---|---|---|---|
| N | <0.001 | 0.482 | 0.322 | 0.723 |
| T | <0.001 | 0.370 | 0.252 | 0.542 |
| Ly | 0.826 | 0.949 | 0.594 | 1.516 |
| V | 0.790 | 0.944 | 0.616 | 1.445 |
| PNI | 0.001 | 0.506 | 0.335 | 0.766 |
N: lymph nodes metastasis, T: depth of tumor invasion, Ly: lymphatic invasion, V: venous invasion, PNI: perineural invasion
| P | Odd’s ratio | 95% (CI) | ||
|---|---|---|---|---|
| Local recurrence | N | 0.415 | 1.309 | 0.688–2.490 |
| T | <0.001 | 3.028 | 1.664–5.508 | |
| Ly | 0.796 | 1.101 | 0.532–2.278 | |
| V | 0.755 | 1.11 | 0.575–2.144 | |
| PNI | 0.003 | 2.602 | 1.377–4.916 | |
| Liver metastasis | N | 0.001 | 3.92 | 1.700–9.036 |
| T | 0.519 | 1.293 | 0.592–2.824 | |
| Ly | 0.39 | 1.56 | 0.563–4.319 | |
| V | 0.323 | 1.563 | 0.638–3.826 | |
| PNI | 0.722 | 1.164 | 0.503–2.694 | |
| Lung metastasis | N | 0.695 | 1.225 | 0.447–3.353 |
| T | 0.041 | 2.522 | 1.037–6.137 | |
| Ly | 0.13 | 0.436 | 0.147–1.298 | |
| V | 0.25 | 1.746 | 0.674–4.523 | |
| PNI | 0.431 | 1.429 | 0.566–3.813 |
N: lymph nodes metastasis, T: depth of tumor invasion, Ly: lymphatic invasion, V: venous invasion, PNI: perineural invasion
癌統計では大腸癌罹患者数は近年横ばいもしくは減少傾向となっているが,2010年度の部位別にみた癌死亡率において女性では1位,男性では3位であり,外科治療を行う疾患のなかで最も多い悪性疾患である.しかし,本邦では2005年以降furuolouracilの持続投与とoxaliplatin(L-OHP)やirinotecanを組み合わせたFOLFOX,FOLFIRIの普及,また抗VEGF(vascular endotherial growth factor)や抗EGFR(epidermal growth factor receptor)の恩恵により,切除不能,再発症例の生存期間が改善している8)9).
大腸癌は早期癌に対する手術適応とStage IIIに対する補助化学療法の適応およびStage IVに対する化学療法の選択は現在ガイドラインで示されている.しかし,Stage II大腸癌に対する補助化学療法の効果は実証されておらず10),適応症例を絞り込むことが課題となっている.また,Stage IIIに対する補助化学療法の適応を明確にする必要がある11).さらに,直腸癌治療では側方郭清12)13),術前化学放射線療法14)や術後補助化学療法の意義が欧米と本邦では一致せず,再発ハイリスク症例を判定し側方郭清,術前放射線化学療法や術後補助化学療法の適応を明確にすることが必要である15).悪性度の高いStage II,III大腸癌の症例を判定するには,主軸となる深達度とリンパ節転移での病期分類に新しい指標を加え細分化することが必要である.しかし,病理組織学的形態を予後指標として加えることは,組織評価の負担が増え,予後評価が煩雑となることも考慮すべきである.
新しい予後の指標として,従来の病期分類を補填する癌先進部や特異な組織形態の役割が注目されてきている16).病理組織学的形態例えばBudding,低分化胞巣,PNI,節外非連続胞巣などは予後を評価する独立した因子として報告されている17).評価因子を加える際は予後判定に独立した役割をもち,病理組織学的評価と診断が簡便で評価者間の差が小さく,加えてその因子が一定の頻度で出現することが重要である.
1835年にCruveilhier18)が神経への癌浸潤を報告し,1943年にはSeefeldら19)が直腸癌のPNIを検討し局所再発との関連を報告した.また,1963年にSheildsやWarrenは前立腺癌症例でPNIの検討を行った20).PNIはいくつかの癌種で浸潤形式の一つとして認識されている.神経鞘は三層からなり外膜,周囲膜および内膜で構成されている.最も高頻度にみられるPNIは周囲膜内に進展し神経鞘に浸潤したものである21).Liebigら4)は内膜,周囲膜で腫瘍が神経に接し,33%以上周囲膜を取り囲むか神経鞘に浸潤したものをPNIと定義した.しかし,周囲膜に包まれた末梢神経枝に癌細胞が浸潤するもの,あるいは周囲膜と神経線維束の間の神経周囲間隙に癌細胞が浸潤するもの3)など定義は統一されていない.神経外膜は癌細胞の浸潤を防御する機能を有するが,神経周囲膜は組織抵抗が脆弱な間隙であり,組織間を網羅するリンパ管様のネットワークを有している22).腸管壁内外の神経線維は脈管に並走し,神経線維の分布する腸管壁層を進展する.神経線維は粘膜にperiglandular plexus,粘膜下層にsubmucosal plexus(Meissner’s plexus)を形成し,内輪筋にはcircular intermuscular plexusを形成する.内輪筋と外輪筋の間にはAuerbach’s plexus,外輪筋にはlongitudinal intramuscular plexusが,さらに外縦筋と漿膜間にはsubserous plexusが形成されている.神経叢は脈管に沿って互いに交通し,貫通枝に沿って腸管壁外へ向かい腸間膜に到達する23)24).
本邦では,直腸癌の自律神経温存手術に対して,白水ら25)は原発巣からPNIを介して温存する自律神経に癌が遺残する可能性を指摘し,自律神経の周囲組織に浸潤する微小な癌病巣が注目された.予後因子として,上野ら26)は364例の直腸癌症例を解析し,筋層以深のextramural perineural invasionを検討し,筋層からの距離10 mm以上もしくは5個以上/20倍視野のものが不良な予後を規定すると報告している.また,同様に大腸癌で筋層より5 mm以上離れる壁外脂肪層内にPNIを呈する病変があり,辺縁が不正なPNI病巣は予後と関連が深いと報告した.それらの解析からBuddingや低分化癌胞巣のようにT因子,N因子に加えて悪性度を判定する副所見として注目されている.しかし,extramural perineural invasionと定義される予後不良なPNIの頻度は8.2%,壁外脂肪層内の癌進展病巣にみられるPNIの頻度は2%以下と低率で,定義に従った神経浸潤の検出は煩雑である.今回の検討でもPNIをpn0~3に分類して解析を行ったが,pn0:266例(64.6%),pn1:116例(28.2%),pn2:21例(5.1%),pn3:9例(2.2%)とpn2,pn3症例は特に不良な予後を示したが頻度は7.3%と低率であり,臨床的に予後に関わる因子としてpn1,2,3をPNI陽性と定義しその頻度は35.4%となった.膵癌におけるPNIについて,剣持27)の神経特異抗原および神経接着分子(neural cell adhesion molecule;NCAM)を用いた検討では,特異抗原によるPNIを検出している.本検討ではS100染色を10例検証し,腫瘍細胞に占居された神経の検索を行った.PNIの判定はHE染色で行い,通常の病理組織学的診断法で確認することが望ましい.
PNIの頻度は大腸癌では4.8%~25.9%,直腸癌では9.9%~34.5%と報告され,本検討でもPNIは直腸癌の35.4%であった.また,上部直腸癌の43.7%,下部直腸癌の24.7%にみられ,自律神経分布との関連が示唆された(P<0.001 odd’s ratio 2.60).局所再発では,PNIを伴うものは1.5~2倍と報告され,本検討でも局所再発は高率であった(odd’s ratio 2.25,P=0.008).T因子ではT1で5.0%,T2で15.4%,T3で38.5%,T4で50%にPNIを認め,T因子との関連が示された28),PNIは深部に癌が達しやすく転移,局所再発の因子であることが推測される.本邦では下部直腸での側方リンパ節周囲の制御を推奨しているが,PNIを考慮すると妥当な考え方である.神経鞘に癌が浸潤すると抵抗が小さい神経鞘の膠原繊維と基底膜の間隙を進展し29),傍神経間隙を通じて周辺臓器に転移する機序が報告されている30).
PNIは頭頸部腫瘍や膵癌,前立腺癌の予後に関連する癌進展経路として知られ,頭頸部腫瘍では生存期間が短く局所再発が高くなると報告されている31)32).大腸癌では1943年にSeefeldら19)によって初めて報告され,本邦では1990年半ばに直腸癌に関する神経温存手術のfeasibilityを検討し,前述の剣持27)は壁外神経叢やAuerbach’s plexusへの癌侵襲を報告している.一方,欧米では2005年に直腸・結腸がそれぞれ検討され,PNIは予後因子として臨床的に意義があると報告し,特にKimら33)はcircumferential radical margin(以下,CRMと略記)とPNIの関連を指摘している.今回の検討では直腸癌局所の独立した再発因子として示されたが,Stage IVや術後10年経過例を含めた検討であり,背景因子が異なることを前提に解釈する必要がある.
術前放射線化学療法を行った直腸癌でもGuillemら34)やKimら33)はPNIを局所再発および予後不良因子として報告している.本研究中では11例の術前放射線療法(30 Gy~50 Gy)と7例の術後放射線療法(50 Gy)の照射が含まれていた.前者ではPNIが4例(36.4%)陽性で生存率は36.4%であり,後者ではPNI陽性例が4例(57.1%)みられ生存率は14.3%と低率であった.直腸癌の局所制御には病変の周囲組織を含めて切除することが重要で,直腸固有筋膜を損傷せず剥離層を揃えたtotal mesorectal excision(TME)が不可欠となる35)36).本検討でR1手術30例のうち17例が生存し,13例が再発死亡していた.生存例ではPNI陽性が3例(17.6%)であったのに対し,死亡例では8例(61.5%)がPNI陽性であった.PNI陽性では直腸周囲の層を考慮し,神経周囲ネットワーク内の癌細胞散布を最小限にとどめる手技が要求される.CRMを1 mm確保するのが微妙なT3,T4症例へのNCCNや,AJCCで示される進行直腸癌への術前放射線化学療法は,術中散布を回避させ局所再発を制御する有効な方法と解釈できる37).
一方,N因子に対するPNI陽性率はN0で17.9%,N1,2で45.1%,N3で64.0%,N4で80.0%とリンパ節転移が高度なほど陽性となり,リンパ節転移例の77.1%がPNI陽性であった.本検討では下部直腸癌のN3の18例は全例が側方リンパ節転移陽性で,癌細胞は骨盤内の神経網やリンパ流を介して浸潤することが推測された38).以上のことから,下部直腸癌のPNI陽性例に対する根治的手術では側方郭清が必要となる.欧米では下部直腸癌への側方郭清は予後に寄与しないと捉えられ,放射線化学療法による側方リンパ節治療を推奨している39)が,癌局所治療を評価するためにTMEや郭清リンパ節個数と同様に,下部直腸癌では側方リンパ節に対しての診断および治療内容(術前化学放射線療法や側方リンパ節郭清)を明記すべきである.
今回,腫瘍先進部の病理組織学的検査所見としてPNIとBudding(P<0.001 odd’s ratio 1.51),PNIと低分化癌胞巣(P<0.001 odd’s ratio 2.04)での相関が示された.また,PNIは病理組織学的因子ではリンパ管侵襲と相関を示し(P<0.001,odd’s ratio 3.75),PNIをリンパ管侵襲が修飾された形態と解釈することもできる.前述の頭頸部癌や膵癌および前立腺癌ではPNIは予後因子として既に扱われており,自律神経が豊富に分布する直腸癌でも因子として加えることは妥当である.直腸は膀胱に隣接した自律神経の豊富な臓器であり,神経周囲のリンパ管や固有のネットワークを有し,PNIを来すとネットワークに沿って転移している可能性が示唆されている.また,PNIのみられる腫瘍はneurophilic factorを介して増殖,進展を加速させることが証明され,神経周囲に進展している腫瘍は,TMEを行ってもCRMが陽性となる要因を有し,局所再発のリスクが高い.この2点は癌局所コントロールに極めて重要なファクターで,手術精度に直腸癌治療成績が左右される所以と考えられる.本研究では中等度ないし高度リンパ管侵襲と脈管侵襲の頻度は44.2%および48.1%で,それぞれ単変量解析では予後に関連したが,TおよびN因子を含む予後因子の多変量解析では有意差を認めなかった.他方,PNIは35.4%とリンパ管侵襲や脈管侵襲に比較すると低率であったが,多変量解析でも予後不良の強い因子として有意差がみられた.それらの結果から直腸癌ではPNIは程度にかかわらずTNM分類のT因子,N因子を補填する因子として有用であり,NCCNガイドラインの如くリンパ管侵襲および脈管侵襲と同様に直腸癌の病理組織学的診断に明記すべきであると結論づけることができる.
最後に,NCCN ガイドラインはTMEや摘出したリンパ節数を手術の精度を判定する治療因子としてガイドラインに組み入れている.また,PNIに関しては深達度,リンパ節転移を補填する因子の一つとして明記され,CRMや非連続性節外転移など新たな病理組織学的因子が加えられ予後を反映する分類が行われている.本邦でも直腸癌のガイドラインには側方リンパ節に対する術前評価や治療法を明記し,加えてPNIを表記することで,治療指針ことに補助化学療法選択がより明確となることが期待される.
本研究に関しては,貴重な時間を割いてご協力頂いた仙台医療センター病理診断科鈴木博義先生に心より謝意を表します.
利益相反:なし