2014 年 47 巻 12 号 p. 814-820
2014 年 47 巻 12 号 p. 814-820
症例は50歳の男性で,発熱,左下腹部痛,血便を主訴に入院した.腹部CTにて回腸に径35 mm大の高吸収域腫瘤を認め,手術を施行した.腸管内に露出した小腸腫瘍と近傍の腹膜に結節性病変を認め,小腸および腹膜部分切除を行った.病理組織学的検査では好酸球や好中球の著明な浸潤を伴う線維芽細胞様紡錘形細胞の増殖を認め,免疫組織化学でvimentin・anaplastic lymphoma kinase・alpha-smooth musle actin陽性から多発inflammatory myofibroblastic tumor(以下,IMTと略記)と診断した.術後,自覚症状は速やかに改善したが,1か月後に症状が再燃した.腹部CTにて吻合部近傍に小腸腫瘍を認め,小腸部分切除を施行した.病理組織学的検査では初回摘出病変と類似の所見を認め,IMTの遺残病変と考えられた.本邦において小腸多発IMTは極めてまれな疾患であり,文献的考察を加えて報告する.
炎症性筋線維芽細胞性腫瘍(inflammatory myofibroblastic tumor;以下,IMTと略記)は,リンパ球や形質細胞など炎症細胞の著明な浸潤を伴い,筋線維芽細胞の増殖を主体とした腫瘍性病変である1).今回,我々は極めてまれな疾患である小腸多発IMTの1例を経験したので,若干の文献的考察を加えて報告する.
患者:50歳,男性
主訴:発熱,左下腹部痛,血便
家族歴:特記すべきものなし.
既往歴:2011年11月上行結腸憩室炎,周囲膿瘍にて右半結腸切除術を施行した.術後にS状結腸憩室炎を合併したが保存的治療により軽快し,術後第20病日に退院した.
現病歴:2012年1月下旬頃より38°C台の発熱が持続した.同年2月上旬頃より左下腹部痛を自覚し,血便も見られたため,精査加療目的に当科入院となった.
入院時現症:身長185 cm,体重78.5 kg,血圧113/70 mmHg,脈拍93回/分,体温37.6°C,腹部は膨満し軟.左下腹部に圧痛を認めたが,筋性防御は認めず.腫瘤は触知しなかった.
血液検査所見:WBC 24,180/μl,CRP 18.65 mg/dlと炎症反応の上昇を認めた.Hb 11.3 g/dl,Ht 33.5%と軽度の貧血を認めた.他,特記すべき異常所見は認めなかった.
腹部造影CT所見(初回):回腸壁に沿うように径35 mm大の高吸収域腫瘤を認めた(Fig. 1).また,骨盤部に少量の腹水貯留を認めた.
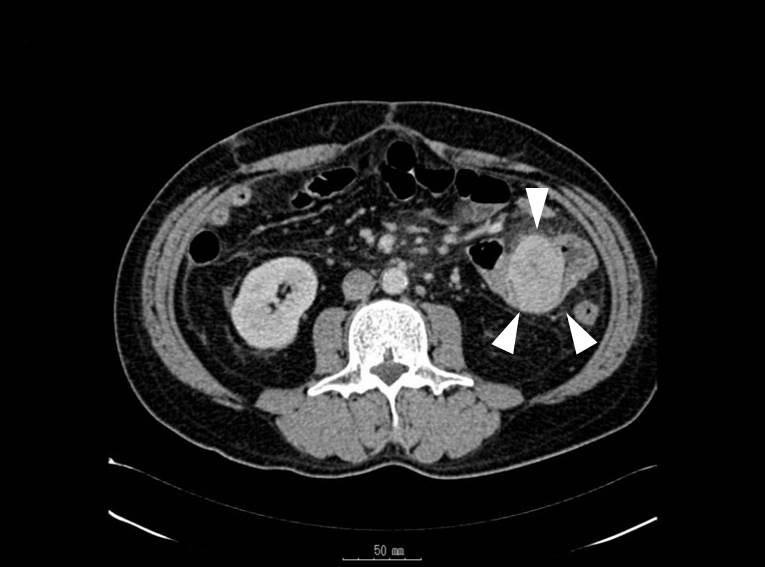
Abdominal and pelvic CT reveals a tumor 35 mm in diameter, showing a high density area in contact with the wall of the ileum (arrowheads).
他臓器に腫瘤性病変の合併はなく,小腸原発腫瘍と考えられた.悪性腫瘍を否定できず,入院7日目に手術を施行した.
手術所見(初回):中下腹部正中切開にて開腹した.トライツ靱帯から約200 cm肛門側の回腸に腫瘍を認め,さらにこの腫瘍より約5 cm口側の小腸間膜表面にも小結節を認めた.回腸の腫瘍は明らかな漿膜面への露出は認めず.病変を含むようにして,約10 cmの回腸部分切除と腹膜部分切除を施行した.小腸を全長にわたり観察したが明らかな腫瘍性病変は認めず.また,他臓器にも明らかな病変を認めなかった.手術時間は58分で,出血量は20 mlであった.
切除標本所見(初回):回腸に38×38×49 mmの充実性腫瘍を認め,一部は腸管内に露出していた(Fig. 2).
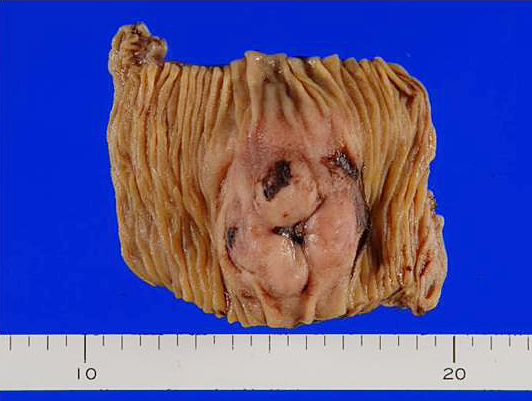
Macroscopic findings of the resected specimens: Tumor size was 38×38×49 mm. The surface of the tumor was partially exposed to the small bowel lumen and a nodular lesion was present in the surrounding peritoneum.
病理組織学的検査所見(初回):回腸の腫瘍は,好酸球や好中球の著明な浸潤を伴う線維芽細胞様紡錘形細胞の増殖を認めた(Fig. 3a).腹膜の結節性病変には,粘液と出血性間質とリンパ球浸潤を有する紡錘形細胞の増殖が見られ,回腸の腫瘍と類似していた(Fig. 3b).核異型と核分裂像は少数であった.免疫組織化学では,vimentinおよびanaplastic lymphoma kinase(以下,ALKと略記)はびまん性に陽性,alpha-smooth muscle actin(以下,α-SMAと略記)は一部陽性,desmin,CD34,c-kit,CD30,CD68,CD35は陰性であった(Fig. 3c~e).
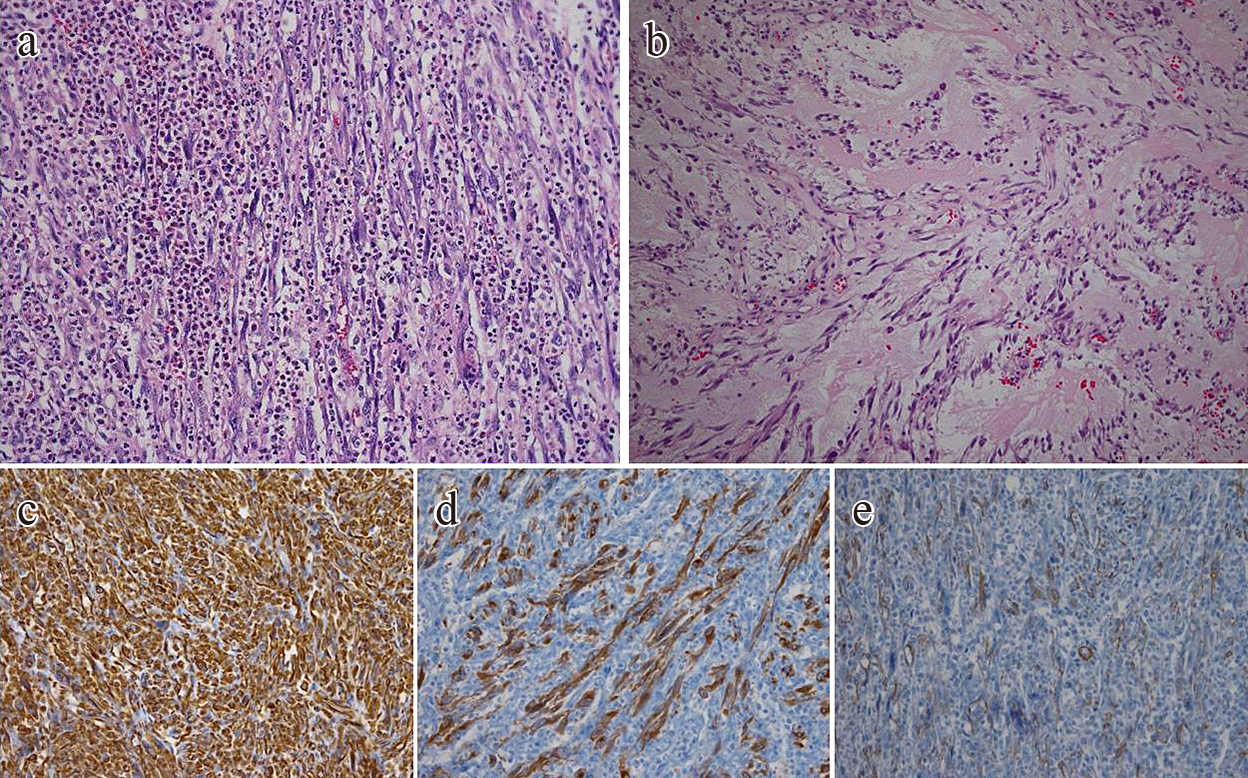
Histopathological findings. a: HE staining (HE, ×200) of the small bowel tumor. The tumor cells were fibroblast-like spindle-shaped cells and proliferated with remarkable infiltration of neutrophils and eosinophils. b: HE staining (HE, ×200) of the peritoneum lesion. The tumor cells were similar to the small bowel tumor. Spindle-shaped cells with mucus, interstitial bleeding and infiltrating lymphocyte proliferated. c: vimentin immunostaining (vimentin, ×200). The tumor cells diffusely showed a positive reaction to vimentin. d: anaplastic lymphoma kinase immunostaining (ALK, ×200). The tumor cells diffusely showed a positive reaction to ALK. e: alpha-smooth muscle actin immunostaining (α-SMA, ×200). The tumor cells partially showed a positive reaction to α-SMA.
以上より,多発IMTと診断した.術後,自覚症状および炎症所見は速やかに改善し,術後10日目に退院となった.しかし,退院1か月後に再び発熱および左下腹部痛を自覚し,血便も見られたため再入院した.
腹部造影CT所見(再入院時):吻合部の近傍で回腸に接するように径40 mm大の腫瘍を認めた.腫瘍辺縁に淡い造影効果を認めた(Fig. 4).
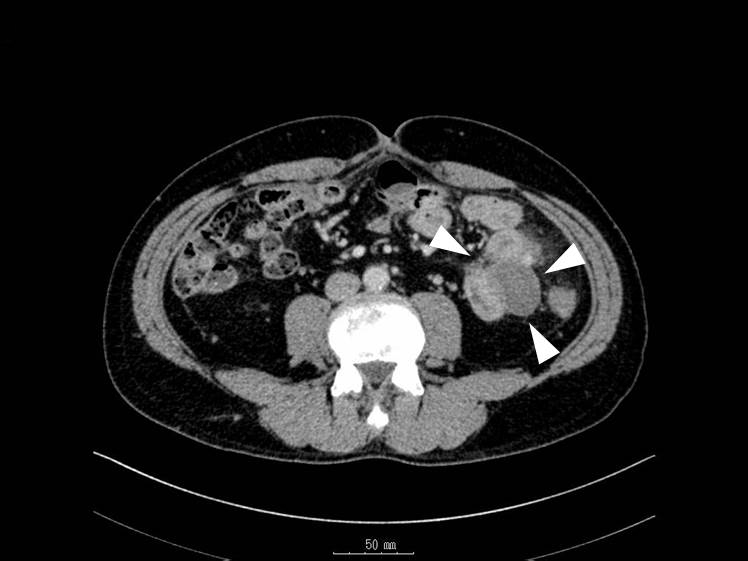
Abdominal and pelvic CT at readmission reveals a new tumor in the small bowel near the site of anastomosis (arrowheads).
IMTの遺残または再発を疑い,入院3日目に再手術を行った.
手術所見(2回目):吻合部から約10 cm程度肛門側の位置に,小腸間膜を巻き込み一塊となった小腸腫瘍を認めた.前回手術の腹膜切除部には明らかな再発所見は認めず.病変を含むようにして,約20 cmの回腸部分切除を施行した.手術時間は97分で,出血量は90 mlであった.
病理組織学的検査所見(2回目):腫瘍は好酸球や好中球の著明な浸潤を伴う線維芽細胞様紡錘形細胞の増殖を認めた(Fig. 5a).また,免疫組織化学ではALKはびまん性に陽性であった(Fig. 5b).
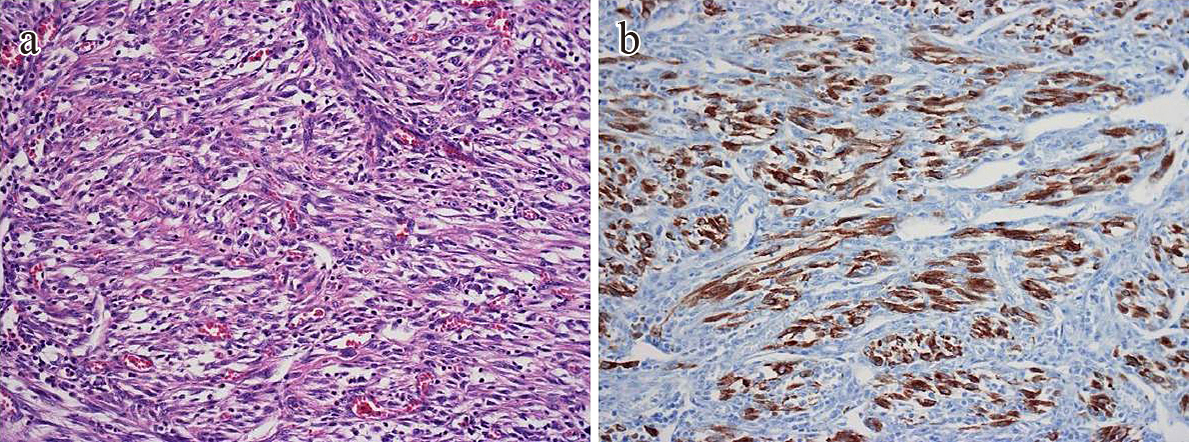
Histopathological findings. a: HE staining (HE, ×200). Compared to the specimens of the first operation, the specimens of the second operation showed similar findings in which fibroblast-like spindle-shaped cells proliferated with remarkable infiltration of neutrophils and eosinophils. b: anaplastic lymphoma kinase immunostaining (ALK, ×200). The tumor cells showed a diffuse positive reaction to ALK.
術後経過:再び自覚症状は速やかに改善し,術後6日目に退院となった.術後24か月の現在まで再発所見なく経過観察中である.
IMTはPettinatoら1)が肺の炎症による反応性腫瘤と考えられていた病変(炎症性偽腫瘍 inflammatory pseudotumor;以下,IPTと略記)が筋線維芽細胞主体の腫瘍であることを報告し,命名したものである.IMTの生物学的悪性度について,WHOの軟部組織腫瘍の分類では,まれに遠隔転移を来すことのある良悪性の中間群に分類されている2).
IMTは小児や若年成人を好発として,幅広い年齢層に発生するとされる.発生部位としては肺以外にも,腹腔内,後腹膜,骨盤内臓器,頭頸部,四肢体幹といった全身の軟部組織での発生が報告されている3).これまでにIMTの成因として,Epstein-Barr virusなどの感染や,外傷,手術,放射線治療歴などの炎症反応が原因と考えられてきた3)~5).一方で,Griffinら6)は腫瘍細胞にクローナルな染色体異常が見られた症例を報告しており,IMTは単なる炎症反応はなく真の腫瘍性病変であるとする見解もあり,その成因はいまだ明らかではない.自験例においては,過去に憩室炎に対する手術の既往があり,腹腔内の高度炎症反応の持続が発病の成因となった可能性が示唆される.
臨床的特徴として,一般的に無症候性での発見はまれであり7),腹腔内原発例では腹部腫瘤,腹痛,発熱,貧血様症状など何らかの症状で発見されることが多い.時に発生臓器に関連した症状が出現することがあり,本邦では腹腔内出血での発症例も報告されている8).血液検査では非特異的炎症反応を示すことが多く,確定診断に至る有意な検査所見はないとされる.また,画像所見においても,IMTと他の軟部組織腫瘍や炎症性腫瘤との鑑別は極めて困難である.本邦ではFDG-PETがIMTの補助診断として有効であったとの報告例は見られるが9),いまだ確定診断に至るものではない.上述のように,術前にIMTと確定診断することは極めて困難であることから,外科的切除または生検により初めて診断が確定することが多いとされている10).
病理組織学的には,筋線維芽細胞の特徴を示す紡錘形細胞の増殖と,リンパ球や形質細胞を主とする炎症細胞の浸潤を特徴としている11).これらの細胞成分と背景の細胞外基質との混合の程度や基質の状態,紡錘形細胞の配列構造などによって,肺外原発のIMTでは①慢性炎症細胞浸潤に伴い,粘液腫状や浮腫状の基質に紡錘形・星芒形細胞が疎に配列しているパターン(myxoid/vascular pattern),②紡錘形細胞が密に束状・花莚状に配列し,炎症細胞がびまん性にあるいは集簇巣を形成し浸潤しているパターン(compact spindle cell pattern),③密で豊富な膠原線維基質の中に紡錘形細胞が炎症細胞とともにまばらに存在しているパターン(hyper vascular pattern)の三つに分類される11).自験例において,小腸病変では②のパターン,腹膜病変では①のパターンと異なるパターンを呈していた.加えて,二つの病変は病理組織学的に核異型および核分裂像が乏しかったため,転移性病変ではなく同時性多発病変と考えられた.
免疫組織化学では,IMTは筋線維細胞の特徴を有するためvimentin,α-SMA,desminでの陽性率が高く,上皮マーカーでの陽性率は低いとされる1)12).また,筋線維芽細胞におけるチロシンキナーゼ受容体蛋白であるALK蛋白の発現がIMTで特異的とされているため,免疫組織化学的検査が鑑別に有用であると考えられている13).Cookら14)はIMTにおけるALK蛋白の陽性率は60%と報告している.また,ALK蛋白の発現例は若年者に多く,遠隔転移を来しにくいとされる一方で,局所再発率が高いと報告されている13)15).近年では,ALK蛋白の発現はIMTの増殖活性の指標であり,予後予測因子になりうると考えられている.
治療法に関しては,浸潤のある周辺臓器を含めた外科的切除が第一選択とされる.Coffinら11)は肺外原発IMTの90%に根治切除が可能であったと報告している.しかしながら,切除不完全例では局所再発率が高く,腫瘍摘出後比較的早期で再発を来すことが多いとされている3)11)16)17).また,局所再発を繰り返すことで腫瘍死例の報告や3),局所再発の過程で悪性転化例の報告があるため18),局所再発の制御が予後の鍵を握ると考えられている.そのため,腫瘍の完全切除を目指した十分なsurgical marginの確保を行うとともに,術後も定期的な画像検索を行い,長期の経過観察が必要である.一方,手術以外の治療法としては,化学療法,放射線治療,ステロイド剤の有効例が報告されている19)~22).また,近年ではALK融合遺伝子陽性例に対してALK inhibitorであるcrizotinibという分子標的薬が転移および再発例に期待できる治療法として注目されている23).これらの治療法を外科的治療に組み合わせることで,予後の改善が期待される.
自験例は初回の外科的切除後に速やかな自覚症状および検査所見の改善を認めた.しかし,術後1か月後に症状が再燃した.その原因の一つとして,初回手術で小腸腫瘍は完全切除しえたものの,術後早期に局所再発した可能性が挙げられる.しかしながら,病理学的に小腸腫瘍および腹膜病変は核異型と核分裂像が乏しく悪性度は低いため,術後1か月間という短期間での再発を来す病変とは考えにくい.したがって,初回手術時には多発病変を形成していたが不完全切除となり,術後早期に遺残腫瘍の活動性上昇を反映して,症状が再燃したものと考えることが妥当と思われる.医学中央雑誌で「IMT」+「小腸」をキーワードに1983年1月から2013年8月までの期間で検索したところ,本邦において会議録を除き11例の小腸IMTの報告例を認めた.しかしながら,小腸に多発したIMTの報告例はなく,自験例は極めてまれな症例と考えられた.自験例の予後については,病理組織学的に核異型度と分裂像に乏しいものの,IMTの増殖活性の指標であるALK蛋白の発現が陽性であり,将来的に局所再発の可能性を念頭に置く必要がある.そのため今後も慎重な経過観察を行い,再発時には再び完全切除を目指した外科的手術を考慮すべきと思われる.
稿を終えるにあたり,病理組織的および免疫組織化学的検討に関して多大なる御指導をいただいた小田義直先生(九州大学病理)にこの場をお借りして深謝いたします.
利益相反:なし