2015 年 48 巻 1 号 p. 60-67
2015 年 48 巻 1 号 p. 60-67
先天性第V因子欠乏症は100万人に1人,先天性第VII因子欠乏症は50万人に1人発症するといわれているが,その複合型に関しては報告例がない.今回,複合型先天性第V,VII,VIII因子欠乏症に発症した結腸憩室出血に対し結腸右半切除術を行った1例を経験したので報告する.症例は68歳男性で,多量の血便による出血性ショックのため当院救急搬送となり,下部消化管内視鏡検査にて横行結腸憩室からの出血を認めた.内科的治療が無効であったため右半結腸切除を施行した.経過中の血液検査にてインヒビターのない血液凝固第V,VII,VIII因子の活性低下を認めた.術後,各凝固因子活性と止血維持状態に乖離が見られ一時的に出血傾向となったものの,プロトロンビン時間,活性化部分トロンボプラスチン時間,トロンボテストを指標に血液製剤の投与法を調整することで,重篤な出血合併症や血栓症に陥ることなく管理することができた.
先天性第V因子欠乏症は100万人に1人1),先天性第VII因子欠乏症は50万人に1人2)に発症するといわれているが,これらの複合型の報告例は存在しない.今回,先天性第V,VII,VIII因子欠乏症の複合型患者に発症した結腸憩室出血に対し手術を行い,適時血液製剤の投与を調整することで重篤な出血性合併症なく経過した症例を経験したので報告する.
症例:68歳,男性
主訴:出血性ショック
既往歴:1975年 抜歯(出血のため輸血施行),2001年 鼡径ヘルニア手術(術後に軽症血友病Aの診断)
家族歴:両親はいとこ婚で,母親は脳梗塞で死亡している.患者は4人兄弟の次男であり,三男は先天性第VII因子欠乏症と診断されており,脳幹出血のため死亡している.患者の長女は血友病A保因者である(Fig. 1).
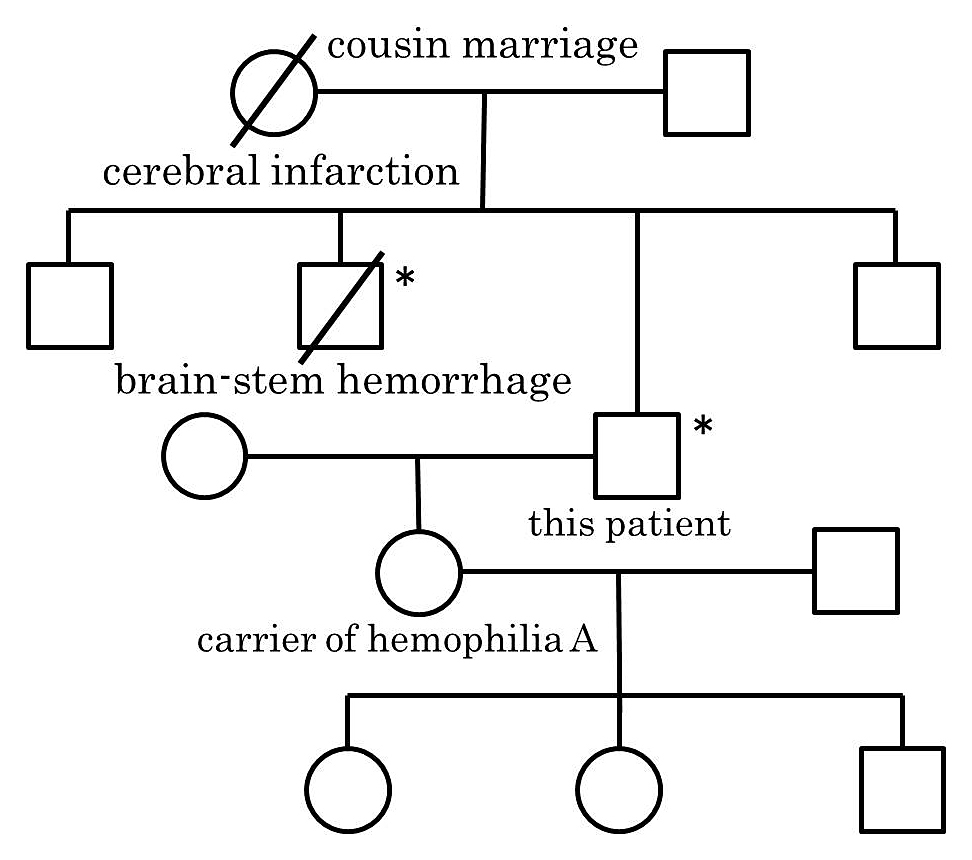
Family history. Asterisk represents the patient with congenital factor VII deficiency.
現病歴:1997年頃より時々血便を認めていた.2001年に鼡径ヘルニア手術を行った際の血液検査で,第VIII因子活性が15%であったため軽症血友病Aの診断となった.以後,補充療法なしで出血傾向もなく経過していたが,2013年4月に多量の血便を認め,体動困難となり当院救急搬送となった.
来院時現症:身長169 cm,体重58.1 kg,血圧120/70 mmHg,脈拍118回/分,体温37.0°C,眼瞼結膜に貧血を認め,腹部は平坦,軟で圧痛は認めなかった.
来院時血液検査所見:貧血とプロトロンビン時間(以下,PTと略記),活性化部分トロンボプラスチン時間(以下,APTTと略記),トロンボテスト(以下,TTと略記)の延長を認めた.
上部消化管内視鏡検査所見:特記すべき所見は認められなかった.
下部消化管内視鏡検査所見(colonoscopy;以下,CSと略記):S状結腸憩室に凝血槐が付着しており,憩室出血が疑われたが活動性の出血は認められなかった(Fig. 2a).
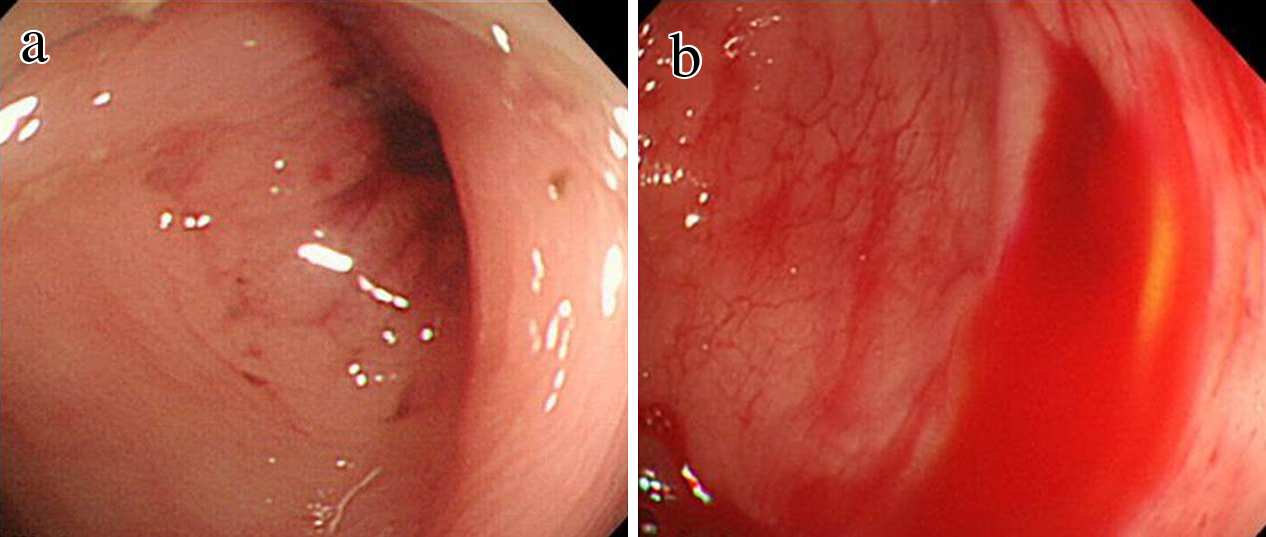
Colonoscopic examination findings. (a) Clotted blood on the transverse colonic diverticulum. (b) Active bleeding from the same diverticulum.
入院後経過:赤血球濃厚液(RCC),新鮮凍結血漿(以下,FFPと略記)の投与を行った上で,入院3日目にCSを再検したところ,上行~横行結腸とS状結腸に多数の憩室が存在したものの出血所見は認められなかった.入院4日目に再び多量の血便によるショック状態となったためCSを行ったところ,横行結腸憩室からの出血を認め(Fig. 2b),クリッピングにて止血を得たものの,入院6日目と9日目に同じ憩室からの出血によるショック状態となった.FFP投与状態での凝固因子活性を測定したところ,第V因子59.5%,第VII因子44.1%,第VIII因子60.9%,第IX因子118.3%,第X因子102.9%,第XIII因子188%,von Willebrand因子174%,protein C 103%で,PT・APTTに対する混合補正試験の結果,即時,2時間保温後ともに下に凸の凝固因子欠乏のパターンを示した.第V,VII,VIII因子活性は他の凝固因子と比較して著しく低下しており,既往歴,家族歴から先天性第VII,VIII因子欠乏症が強く疑われた.FFP単独での止血は困難で緊急の状態であったため,先天性第V,VII,VIII因子欠乏症と診断したうえで凝固因子製剤を使用することとした.再度クリッピングを行ったうえで第VII因子の補充には遺伝子組換え活性型第VII因子製剤(以下,rFVIIaと略記),第V,第VIII因子の補充にはFFPの投与を行ったが,入院10日目未明に再びショック状態となったため,内科的治療の限界と考え,同日,手術を施行した.
手術所見:手術直前にrFVIIa 30 μg/kg(2 mg)をボーラス投与し手術を開始した.開腹時に腹腔内出血は認められなかった.結紮やリガシュア®によるシーリングを頻回に行いつつ右側結腸を摘出した(クリップが触知しづらく,追加切除を行った)(Fig. 3).リニアカッター®75 mmを用いた機能的端端吻合にて回腸・横行結腸吻合を施行し,断端を4-0吸収糸にて埋没した.閉鎖式ドレーンを右側腹部に留置し,ボルヒール®を剥離面,吻合部に噴霧し閉創した.術中,出血傾向は認められず,手術時間は3時間37分,出血量は160 mlであった.
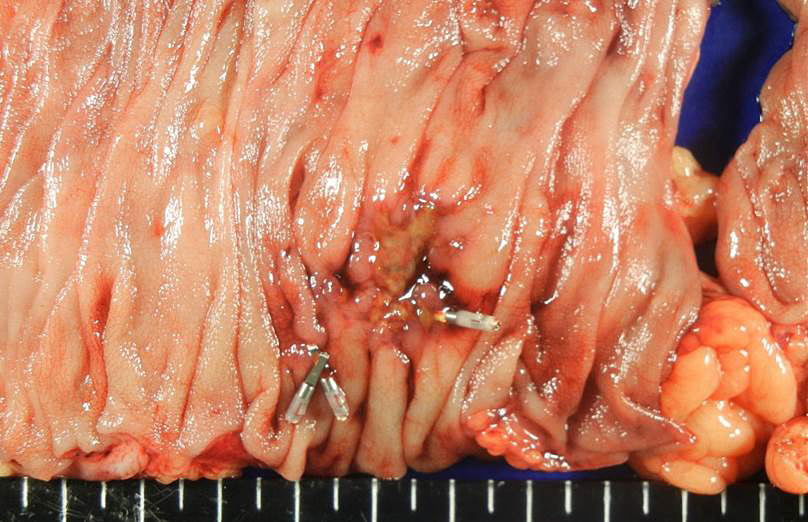
Resected specimen. Clips were placed next to the bottom of the diverticulum.
術後経過:第VII因子に関してはPT,TTを指標としてrFVIIaで調整し,第V因子に関してはTTとPTの乖離(TT正常,PT延長の場合,第V因子の欠乏を示唆)を指標としてFFP投与単位数を調整した.rFVIIaは2 mg(以下,全て2 mg)を術当日に4時間毎,術翌日(以下,全て術後日数)に6時間毎,2日目に8時間毎,3日目に12時間毎,4日目,5日目に24時間毎にボーラス投与した.5日目の凝固因子活性は,第V因子46.2%,第VII因子48.2%,第VIII因子38.6%で,ベセスダ法による第VIII因子に対するインヒビター測定の結果,0.5 B.U./mlと陰性であった(0.5 B.U./ml以下が陰性)3).6日目にドレーンが血性となり,Hb低下,PT,APTT,TTの延長を認めたためrFVIIaを6時間毎投与に短縮し止血を得た.8日目から8時間毎投与に延長したところ,10日目にドレーンからの排液の性状が再度血性となった.rFVIIaを6時間毎投与に短縮し,第VIII因子製剤(以下,VIII製剤と略記)1,500単位/日のボーラス投与を追加することで止血を得た.14日目にドレーンを抜去し,rFVIIaを8時間毎投与に延長するとともにVIII製剤の投与を終了した.16日目にFFPによるアナフィラキシーショックを発症したためFFP投与を中止した.FFPを併用せずに第VII因子を投与することで,第V因子(共通系)が枯渇して再出血することを考慮しrFVIIaも中止した.以後,出血傾向は認めず,18日目に食事を開始し29日目に退院となった.入退院時の血液検査所見をTable 1に示す.出血傾向や炎症刺激のない状態で測定した41日目の凝固因子活性は,第V因子48.4%,第VII因子47.8%,第VIII因子36.4%で,他の凝固因子は100%前後であったため,先天性第V,VII,VIII因子欠乏症の確定診断となった.術後11か月目現在,トラネキサム酸500 mg/日を内服しつつ,問題なく外来フォロー中である.経過中の血液検査所見,血液製剤投与の推移をFig. 4に示す.
| Values on admission | Values at the discharge | Reference values | Unit | |
|---|---|---|---|---|
| WBC | 7,560 | 4,310 | 3,500–9,700 | /μl |
| RBC | 229×104 | 357×104 | 438–577 | /μl |
| Hb | 6.0 | 10.5 | 13.6–18.3 | g/dl |
| Hct | 18.7 | 33.5 | 40.4–51.9 | % |
| Plt | 14.7×104 | 25.5×104 | 14.0–37.9 | /μl |
| PT | 19.6 | 21.7 | 10.0–13.0 | s |
| PT | 31.1 | 26.1 | 80.0–120.0 | % |
| PT-INR | 1.74 | 2.07 | 0.90–1.13 | |
| APTT | 47.4 | 65.8 | 26.0–38.0 | s |
| Fib | 245 | 284 | 170–410 | mg/dl |
| TT | 67.7 | 65.0 | >70.0 | % |
Anemia and prolonged prothrombin time, activated partial thromboplastin time, and thrombin time were observed.

Time course of the administration of blood preparation and values of blood examination parameters. rVIIa, recombinant activated factor VII preparation
先天性凝固因子障害症は,抗原量と活性がともに欠如した凝固因子欠乏症,活性のみ欠如した凝固因子異常症に分類される4).一方,一瀬5)は先天性第V因子欠乏症(以下,V欠乏症と略記),先天性第VII因子欠乏症(以下,VII欠乏症と略記)を,抗原・活性とも低下したtype I欠乏症,活性のみ低下したtype II欠乏症に分類している.実臨床において各抗原量の測定は保険適応外であり研究室レベルでしか測定することができず6),プロテインS欠乏症,プロテインC欠乏症,先天性第XIII因子欠乏症,先天性フィブリノゲン欠乏症/異常症を除いて,活性測定のみで広義の凝固因子欠乏症と診断されることが一般的である.2013年の我が国の血友病類縁疾患患者登録数をみると,血友病Aが4,196人,V欠乏症が32人,VII欠乏症が80人,先天性第V因子・第VIII因子欠乏症が9人である7).本症例に関しては,V欠乏症,VII欠乏症,VIII欠乏症(血友病A)各々の合併,あるいは先天性第V・VIII因子欠乏症とVII欠乏症の合併などが考えられる.先天性第V・VIII因子欠乏症は本邦において数家系が確認されており,協働して凝固因子を輸送するmultiple coagulation factor deficiency protein 2(MCFD2),ER Golgi intermediate compartment protein-53(ERGIC-53)のいずれかの欠乏によって生じることが知られている8).
各疾患の遺伝形式は血友病AがX連鎖劣性遺伝,V欠乏症,VII欠乏症が常染色体劣性遺伝といわれている9).本症例は長女が血友病Aの保因者であることが確認されており,孫(女児)も保因者である可能性がある.V欠乏症,VII欠乏症ともホモ接合体症例では凝固因子活性が数%程度といわれており10)11),本症例は50%前後の活性があることからヘテロ接合体症例と考えられる.V欠乏症に関しては,機序は明確にはされていないが血栓症を発症することが知られており12)13),母親が脳梗塞で死亡していることを考慮すると,V欠乏症は母親由来の可能性がある.
診断に関しては,APTTが正常でPTが延長している場合は第VII因子の異常が,PTが正常でAPTTが延長している場合は,第VIII,第IX,第XI,第XII因子の異常が示唆される9).本症例のようにPT,APTTとも延長している場合は,上記以外の異常,共通系の凝固因子(第I,II,V,X因子)の異常,あるいは多因子異常の複合型が考えられる.混合補正試験は,患者血漿と正常血漿を各比で混合し,2時間保温することで凝固時間延長の原因を評価する検査であり,下向き凸の曲線では凝固因子欠乏を,上向き凸の曲線ではインヒビターの存在が示唆される.術前の混合補正試験で異常が認められた場合は,出血既往の有無にかかわらず全例で凝固因子活性を評価する必要があると考えられる.
症状は,VII欠乏症の場合,明確な出血傾向を来す症例は多くないが14),他の凝固因子異常に比べ消化管出血が多いとの報告がある9).また,出血の重症度は必ずしも第VII因子活性とは一致しない15).V欠乏症に関しては,活性値5%以下の重症例で出血症状を呈するといわれているが10),前述のように血栓症の発症リスクがある.
周術期の凝固因子管理は,血友病に関してはガイドラインが作成されている一方で16),V欠乏症,VII欠乏症に関しては存在しない.第VII因子投与法に関して,欧米では先天性のVII欠乏症に対して遺伝子組換え活性型第VII因子製剤(rFVIIa)を1回15~30 μg/kgで4~6時間毎に投与することが推奨されており17),重症出血に対する有効な第VII因子活性は20%以上といわれている11).第V因子は不安定であるため濃縮製剤は開発されておらず,欠乏症の場合はFFPで補充を行う.周術期に必要と考えられる活性は10~29%以上といわれている1).
1983年から2013年12月までの医学中央雑誌で「先天性第VII(7)因子欠乏」と「手術」をキーワードとして検索(会議録を除く)した結果,9件(消化管手術は2件)の報告があり,「先天性第V(5)因子欠乏」と「手術」のキーワードでは10件(消化管手術は2件)であった.V欠乏症,VII欠乏症に対する消化管手術の報告例をTable 2に示す1)10)18)19).VII欠乏症に関しては,rFVIIaを使用している症例1,2は推奨量通りの使用法で特に問題なく経過している.症例3は,乾燥人血液凝固第IX因子複合体(以下,PPSBと略記)を使用することで止血に関しては良好に経過したものの,血栓症を発症している.PPSBは第II,第VII,第IX,第X因子を含んでいるため,第VII因子以外の因子が蓄積し血栓が発症したと推測されている18).V欠乏症に関しては,症例4と5では到達した第V因子活性が同等であるにもかかわらず,症例4のみ出血傾向が認められていることから,症例毎に血液製剤の投与法を調整する必要があることが示唆される.凝固因子活性に関しては,本症例以外の全ての症例で10%以下であることから,本症例を除き全ての症例がホモ接合体症例であることが推測される.
| Case | Author (Year) |
Age/ Sex |
Deficient factor | Operation | Pre-operative activity of deficient factor | Activity after administration of blood preparation | Administration method of blood preparation | Monitoring | Clinical course |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Nakagawa18) (1990) |
76/ M |
VII | Distal gastrectomy | 8% | 20% | 200 ml of PPSB immediately before operation, 100 ml every 4 hours on POD 1, 75 ml every 6 hours on POD 2, and 50 ml every 6 hours on POD 3–7 | HPT | Left femoral venous thrombosis on POD 7 |
| 2 | Ichikawa10) (2000) |
71/ F |
V | Total gastrectomy |
8% | 28% | One unit per day of FFP for 3 preoperative days, 7 units during the operation, and 5 units per day on POD 1–4 | PT, APTT | Not particular |
| 3 | Sakata1) (2003) |
71/ F |
V | Right hemicolectomy | 9% | 29% | Six units of FFP immediately before operation, 5 units during operation, and 5 units per day on POD 1–5 | PT, APTT | Bleeding tendency during operation |
| 4 | Hanabusa19) (2006) |
55/ M |
VII | Distal gastrectomy | <3% | Unknown | Thirteen doses of rFVIa at 15 μg/kg every 6–12 hours | PT | Not particular |
| 5 | Hanabusa19) (2006) |
59/ M |
VII | Sigmoidectomy | 10% | Unknown | rFVIIa 23 μg/kg immediately and 5 hours after the operation | PT | Not particular |
| 6 | Our case | 68/ M |
V, VII, VIII |
Right hemicolectomy | V, 59.5%; VII, 44.1%; VIII, 60.9% |
V, 46.2%; VII, 48.2%; VIII, 38.6% |
Described in Fig. 4 | PT, APTT, TT |
Bleeding tendency after operation |
rVIIa: recombinant activated factor VII preparation, PPSB: heat-treated prothrombin complex concentrates, 5: factor V, 7: factor VII, 8: factor VIII, HPT: hepaplastin test, TT: thrombo test, POD: postoperative day
本症例は,FFP投与にもかかわらずPT,TTが延長していたことや家族歴から第VII因子を責任因子と考え,周術期にrFVIIaを併用することとした.しかし,手術に関しては術直前にrFVIIaをボーラス投与することで問題なく終了したものの後出血をおこし,FFP併用下にrFVIIaを推奨量17)の範囲で投与しても出血コントロールに難渋した.rFVIIaの半減期は約3時間であるが19),出血量が多い場合は血液凝固因子の分布容積が一過性に上昇し,トラフレベルが低下するといわれており16),本症例ではもう少し投与間隔を短くするか,1回投与量を増やすことで後出血を予防できた可能性はある.第V因子に関しては,FFP非投与時にも止血が得られていたことから出血への関与は低いと思われる.本症例において周術期に必要な凝固因子活性は,第V因子,第VII因子に関しては諸家の報告上は十分であったと考えられる.一方,第VIII因子に関しては80~100%が推奨されており16),本症例では40%程度であったことと,他製剤併用とはいえ第VIII因子製剤を投与することで止血が得られた経過があったことから出血への関与は否定できない.
本症例のように止血に苦慮した背景には,血液凝固因子欠乏症では凝固因子活性と出血の程度に明確な相関関係が認められていないという報告や1)11),複合型の凝固因子欠乏症であることなどが背景にあると推測される.どのような患者に手術を行う場合であっても,術前の血液検査所見で凝固系に異常が認められた場合や,病歴聴取にて出血傾向が疑われた場合は,血液凝固因子欠乏症の存在を念頭に置き,躊躇せずに各凝固因子活性を測定するべきである.術前に欠乏症の診断に至った場合は,特に止血ガイドラインが存在しない血友病類縁疾患において,一般的に十分とされる活性であっても出血する可能性があることを考慮し,①頻回にモニタリングを行う,②補充療法の漸減が終了するまでドレーンを留置する,③補充療法はドレーン抜去後に終了する,などの配慮が必要と考えられる.このように管理することで,凝固因子欠乏症の複合型であっても重大な合併症に陥ることなく周術期管理を行うことが可能と考えられた.
利益相反:なし