2015 年 48 巻 1 号 p. 38-45
2015 年 48 巻 1 号 p. 38-45
症例は68歳の男性で,高血圧症,狭心症,慢性心不全,高脂血症,閉塞性動脈硬化症に対する左腋窩-両側大腿動脈バイパス術,左腎動脈狭窄に対する左腎摘出術,慢性腎不全の既往を有し,抗血小板剤を含む内服治療が行われていた.右下腹部痛を主訴に当院を受診し,CTで門脈ガスと横行結腸の造影不良を認め,下部消化管内視鏡検査で右側結腸の3か所に壊死を認めた.拡大結腸右半切除術を施行し,7日間のICU管理を経て24病日に退院した.その12か月後に左上腹部痛を主訴に来院し,CTで門脈ガスと前回の回腸結腸吻合部周囲に腸管壁の限局性肥厚を認め,下部消化管内視鏡検査で吻合部に壊死を認めたため,壊死腸管を含めた回腸横行結腸吻合部切除を施行した.17日間のICU管理を経て39病日に退院した.門脈ガス血症を合併する重篤な壊死型虚血性腸炎を2回とも救命しえたが,壊死型虚血性腸炎は再発することがあり,全身状態の安定,適切かつ緩徐な循環動態のコントロール,脱水の誘因を取り除くこと,腸管内圧上昇因子を取り除くことなどの再発防止対策をとることが必要である.
門脈ガス血症(portal venous gas;以下,PVGと略記)はしばしば腸管壊死に合併し,重篤な病態の存在を示唆する臨床徴候である1)~3).壊死型虚血性腸炎は虚血性腸炎の中でも不可逆的な虚血を有する最重症型に分類される4).非閉塞性腸管膜虚血症(nonocclusive mesenteric ischemia;以下,NOMIと略記)は心不全や全身の低灌流状態に伴う腸間膜動脈の攣縮によって引き起こされる病態である 5).壊死型虚血性腸炎とNOMIはともに高い致死率が報告されている6)~9).今回,我々はPVGを伴うNOMIによると考えられる壊死型虚血性腸炎を1年間に2度繰り返し,手術により救命しえた1例を経験したので報告する.
患者:68歳,男性
主訴:腹痛,嘔気,嘔吐
既往歴:高血圧症,狭心症,慢性心不全,高脂血症,閉塞性動脈硬化症(左腋窩-両側大腿動脈バイパス術),左腎動脈狭窄症(左腎摘出術),慢性腎不全の既往があり,アスピリン(100 mg/日),チクロピジン(200 mg/日),インダパミド(1 mg/日),エナラプリル(10 mg/日),アムロジピン(10 mg/日),アロプリノール(100 mg/日),プラバスタチン(10 mg/日),ファモチジン(20 mg/日)を内服していた.
現病歴:2010年2月,夕食後より右下腹部痛と嘔気・嘔吐が出現し,腹痛が次第に増悪したため当院を受診した.
来院時身体所見:意識清明,血圧174/79 mmHg,脈拍79回/分,体温37.2°C,腹部は膨満し,下腹部に圧痛を認めたが腹膜刺激症状は認めなかった.
血液検査所見:WBC 9,500/μl,Hb 15.0 g/dl,Plt 18.8×104/μl,T-Bil 0.8 mg/dl,AST 15 IU/l,ALT 13 IU/l,LDH 207 IU/l,BUN 31 mg/dl,Cre 1.78 mg/dl,eGFR 30.8 ml/min/1.73 m2,CRP 0.1 mg/dl,Procalcitonin陰性,動脈血ガス分析:pH 7.461,PaO2 69.7 mmHg,PaCO2 31.4 mmHg,HCO3– 22.1 mmol/l,BE –0.6 mmol/l,と炎症反応の軽度上昇と腎機能低下を認めた.
腹部CT所見:来院時の単純CTにて肝内と肝外にPVGを認めた.その2時間後の造影CTではPVGは消失していたが横行結腸の造影不良と壁肥厚を認めた(Fig. 1a, b).3D-CT-angiographyを構築すると,下行大動脈は右腎動分岐下で閉塞しており,上腸間膜動脈(superior mesenteric artery;以下,SMAと略記)と下腸間膜動脈(inferior mesenteric artery;以下,IMAと略記)も根部で閉塞し,内腸骨動脈も造影されなかった.小腸と右半結腸の血流は,骨盤内動脈から逆行性にIMAや結腸辺縁動脈を介して,また下横隔動脈から側副血行路を介して保たれていた(Fig. 2).
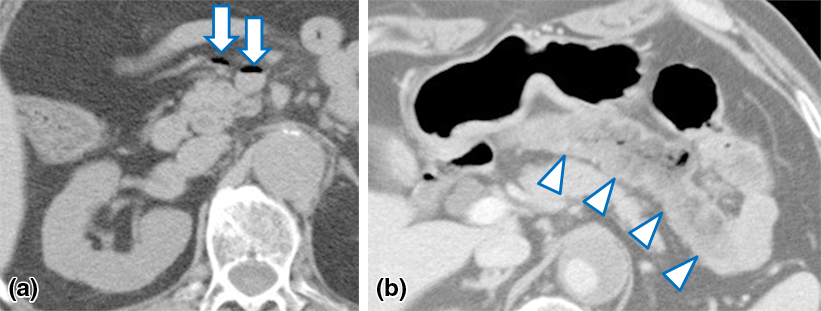
CT showing gas in the superior mesenteric vein (a: arrows) and poor contrast enhancement of the transverse colon (b: arrowheads).
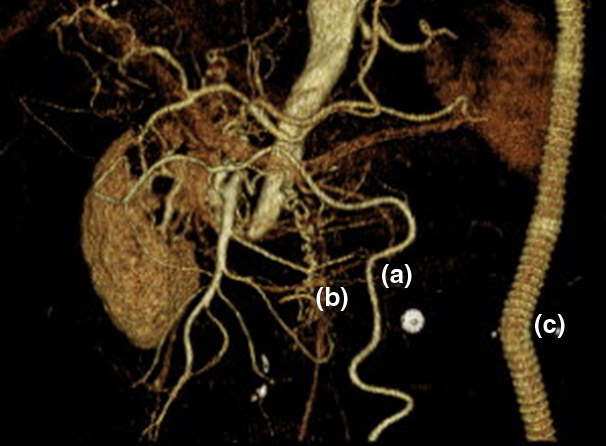
3D-CT angiography disclosing complete obstruction of the superior mesenteric artery and abdominal aorta, and the thickened colonic marginal artery (a) and irregular collateral artery (b) from the retroperitoneum maintaining the blood supply to the intestine. c: axilofemoral bypass graft.
来院後腹部所見は軽快し,来院3時間後の血液検査でも増悪を認めなかったため保存的治療を継続した.来院9時間後,38.5°Cの発熱,赤褐色の水様便を認めたため,下部消化管内視鏡検査を行ったところ上行結腸に2か所,横行結腸に1か所の分節状の壊死所見を認めた(Fig. 3).血液検査でもWBC 20,300/μl,CRP 19.6 mg/dl,Procalcitonin 1+,と炎症反応が上昇していた.静脈血培養は陰性であった.

Colonoscopic view of necrosis in the ascending colon.
以上の所見からNOMIによる右側結腸の壊死型虚血性腸炎と診断し,緊急手術を行った.
手術所見:腹腔内の強い癒着の剥離に難渋した.盲腸漿膜は帯赤色を呈し,右半結腸の壁は分節状に肥厚していたが,結腸の壊死部位は漿膜面から同定できなかった.術前の内視鏡検査所見を参考に拡大結腸右半切除術・回腸横行結腸機能的端々吻合を行った.手術時間は298分,出血量は1,310 mlであった.
切除標本肉眼所見:右側結腸の3か所に非連続性で境界明瞭の茶褐色を呈する帯状の壊死領域を認めた(Fig. 4).
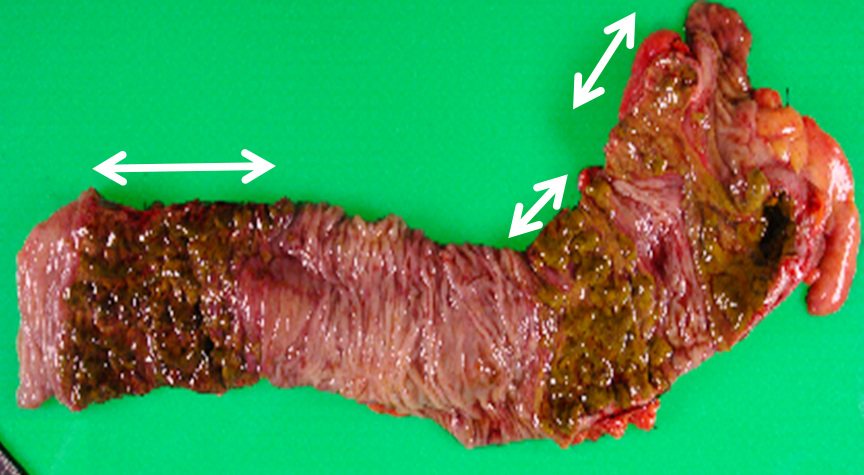
The resected specimen of the extended right hemicolectomy showing 3 segmental necrotic areas (arrows).
病理組織学的検査所見:境界明瞭な粘膜腺管の脱落を伴う粘膜壊死,粘膜下層のうっ血,炎症性細胞浸潤を認め,腸管壊死,壊死型虚血性腸炎と診断された.
術後経過:呼吸不全・循環不全のため術後7日間のICU管理を要したが,全身状態は徐々に改善し術後24日目に自宅に退院した.
拡大結腸右半切除術から約12か月後の2011年2月,午後21時に左上腹部痛が出現し,翌朝も改善しないため当院を受診した.
来院時現症:意識清明,血圧147/51 mmHg,脈拍96回/分,体温36.8°C,腹部は膨満し,左上腹部に限局性の圧痛と反跳痛を認めた.
血液検査所見:WBC 11,800/μl,Hb 12.9 g/dl,Plt 13.6×104/μl,T-Bil 0.4 mg/dl,AST 15 IU/l,ALT 13 IU/l,LDH 228 IU/l,BUN 26 mg/dl,Cre 1.95 mg/dl,eGFR 30.8 ml/min/1.73 m2,CRP 0.9 mg/dl,Procalcitonin 0.08 ng/ml,動脈血ガス分析:pH 7.466,PaO2 93.5 mmHg,PaCO2 25.7 mmHg,HCO3– 18.5 mmol/l,Lactate 1.8 mmol/l,BE –2.6 mmol/lと炎症反応の軽度上昇を認めた.拡大結腸右半切除術の11か月後よりワルファリンを内服しており,PT-INRは1.72と有効域であった.
腹部CT所見: 肝内にPVGを認め,回腸結腸吻合部周囲に腸管壁の限局性肥厚と少量の腹水を認めた(Fig. 5a, b).
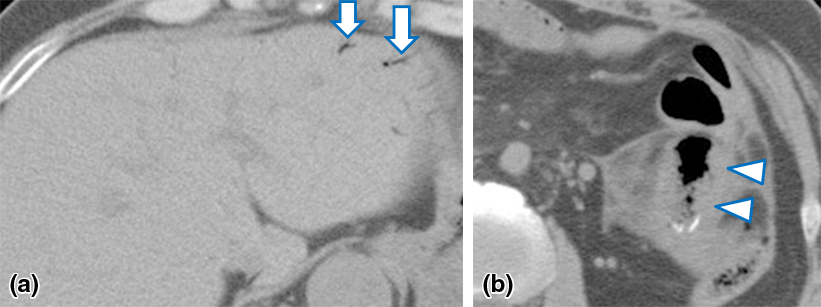
CT showing hepatic portal venous gas (arrows) and localized mural thickening around the ileocolostomy (arrowheads).
下部消化管内視鏡検査所見:回腸結腸吻合部の口側回腸に壊死所見を認めた(Fig. 6).
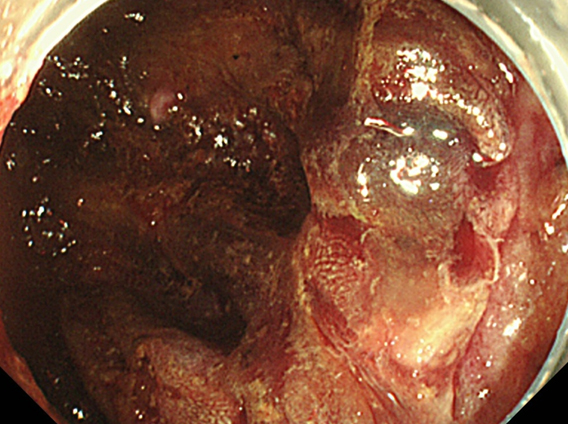
Colonoscopic examination showing necrosis at the oral side of the ileocolostomy.
以上より,回腸結腸吻合部口側回腸の壊死型虚血性腸炎と診断し,緊急手術を行った.
手術所見:腹腔内に強固な癒着を認め剥離に難渋したが,回腸横行結腸吻合に用いた縫合器のステープルを指標に回腸結腸吻合部を同定した.吻合部口側の回腸の漿膜は黒色調を呈していたため,回腸結腸吻合部切除・回腸結腸機能的端々吻合を行った.手術時間は410分,出血量は890 mlであった.
切除標本肉眼所見:回腸結腸吻合部を境として口側の回腸に境界明瞭な帯状の壊死領域を認めた(Fig. 7).
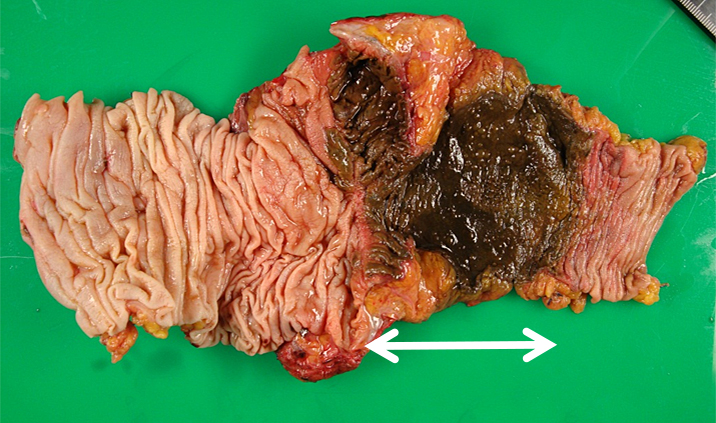
The resected specimen showing a brown discolored ileum (arrow) proximal to the ileocolostomy.
病理組織学的検査所見:粘膜から筋層の構造が不明瞭で,腸管壁全層にわたる好中球浸潤を認め,腸管壊死,壊死型虚血性腸炎と診断された.
術後経過:経過中に静脈血・痰・尿・ドレーン排液の培養を繰り返し行ったが,全て陰性であった.呼吸不全・循環不全のため17日間のICU管理を要したが全身状態は徐々に改善し,理学療法を行って術後39日に自宅に退院した.その後36か月の現在,虚血性腸炎再発の兆候はない.
PVGは腸管壊死やイレウスなどさまざまな消化器疾患に伴ってみられ,①腸管の循環障害による壊死・炎症・潰瘍に起因する腸管粘膜の損傷,②腸閉塞・注腸造影・内視鏡検査などによる腸管内圧上昇,③ガス産生菌の門脈内移行,が原因とされる1).近年CTの発達に伴い報告例が増加し,保存的治療が有効であった症例報告も散見されるが,腸管壊死を伴うものでは50%以上の致死率が報告されており,PVGをもたらす病態の検索は必須である3)10).Walterら11),阪本ら12)はPVGの部位や範囲,継時的な消失などの所見は背景にある病態の重症度と関連がないと報告している.
虚血性腸炎は血管因子(動脈硬化,攣縮,塞栓,血管炎など)と腸管因子(便秘,いきみ,狭窄など)による腸管壁の血流低下とそれに続く再灌流障害によって発症する13).一過性型,狭窄型,壊死型に分類されるが,特に最重症型である壊死型は動脈硬化性疾患を有する高齢患者に多い4)14).壊死型虚血性腸炎も30~40%という高い致死率が報告され,早期診断・治療の必要性が強調されている8)9).
NOMIは心不全や全身の低灌流状態に伴う腸間膜動脈の攣縮によって引き起こされる腸管虚血である5).低心拍出量,重症心不全,透析患者,出血性ショックなどに反応して発生し,各種心疾患,ジギタリス製剤,利尿剤,不整脈,熱傷,膵炎,消化管出血が誘引となる7)15).診断は,①腸管壊死領域に相当する腸間膜動静脈に閉塞を認めないこと,②腸管の虚血および壊死が分節状で非連続であること,③病理組織学的に腸管に出血および壊死の変化が主体で,血栓を欠くことに基づいてなされる16).全身状態不良の患者に多く,初期の腹部症状が軽微かつ非特異的であるため,早期の診断はしばしば困難である.本疾患を疑ったら,血管造影や3D-CT angiographyを行って末梢動脈の攣縮と腸管壁の造影不良を診断し,prostagrandinやパパベリン持続動注などによる血管拡張療法を行うことが推奨されている17).NOMIと壊死型虚血性腸炎は背景因子と病態に類似点を有し,臨床的に区別が困難な場合も多いが,壊死型虚血性腸炎の原因として血管攣縮が含まれることから,その要因としてNOMIを認識するべきであろう7)14)17)18).
自験例においては1回目の壊死型虚血性腸炎は切除標本で壊死所見が非連続性かつ分節状であったことから,慢性心不全や利尿剤使用を背景としたNOMIが原因であったと考えられる.腹部所見が比較的軽微で一旦は改善傾向を示したことから保存的治療を継続したが,結果的に腸管壊死に至った.早期に血管拡張薬投与などを行っていれば手術を回避できた可能性がある.2回目の壊死型虚血性腸炎は画像所見・切除標本でNOMIとする確定的な所見はないが,1回目と同様の病態を背景として腸間膜内の血管攣縮を起こし,回腸遠位部の血流が低下したことが原因と考えられる.
壊死型虚血性腸炎によって繰り返し手術を要した症例の本邦報告は,我々の検索しえたかぎりでは自験例を含めて3例であった(医中誌Web,1983~2013年,検索キーワード「腸壊死」,「再発」,「虚血性腸炎」,「NOMI」)(Table 1)19)20).全例が重症心血管系合併症を有する高齢者であった.1回目の腸管壊死は回腸あるいは右側結腸で,2回目の腸管壊死は全例で残存回腸の遠位側に発生している.遠位側回腸は一般にSMA末梢の回腸動脈,あるいは回結腸動脈との吻合枝から栄養されるが,腸切除によって辺縁動脈の連続性が絶たれるために,血管攣縮が起きた際に血流障害が起きやすいと考えられる.蛭川ら19)の症例は切除標本で散在性に分節状の壊死を認めることからNOMIを反復したと思われる.竹原ら20)の症例は重症動脈硬化を背景として,脱水・心房細動などが誘因となって壊死型虚血性腸炎を反復したと考えられる.
| No. | Author/ Year |
Age/ Sex |
Comorbidity | First intestinal necrosis | Duration between the first operation and relapse (months) | Second intestinal necrosis | Outcome | ||
|---|---|---|---|---|---|---|---|---|---|
| Location | Operation | Location | Operation | ||||||
| 1 | Hirukawa19)/2005 | 75/M | Chronic renal failure, Cerebral infarction, Hypertension, Asthma | Ileum | Partial resection of the ileum | 2 | Distal ileum of the anastomosis | Partial resection of the ileum | alive |
| 2 | Takehara20)/2008 | over 80/F | Angina pectoris, Atrial fibrillation, Radiation therapy for uterus cancer, Asthma | Ileum | Partial resection of the ileum | 19 | Distall ileum from the anastomosis | Partial resection of the ileum | 12 months, alive |
| 3 | Our case | 68/M | Angina pectoris, Arteriosclerosis obliterans, Chronic renal failure, Hypertension | Right side colon | Right hemicolectomy | 12 | Distal ileum of the ileocolostomy | Resection of the anastomosis | 36 months, alive |
虚血性腸炎の再発は7.1~17.2%と報告されており,まれではない21).我が国では高齢人口の増加に伴って特に循環器疾患を持つ人口が増加し,虚血性腸炎,特に壊死型の増加が予想される.早期診断・急性期全身管理の向上によって救命率を改善するとともに,再発予防が課題である.自験例では2回目の手術前にはワルファリン内服が追加されたが再発を来した.壊死型虚血性腸炎は再発しうる疾患であると認識することが大切で,再発予防のために全身状態の安定,適切かつ緩徐な循環動態のコントロール,発熱・下痢・嘔吐・高温環境などの脱水の誘因を取り除くこと,便秘のコントロールや浣腸を避けるなど腸管内圧上昇因子を取り除くことなどが考えられる.
利益相反:なし