2016 年 49 巻 6 号 p. 569-577
2016 年 49 巻 6 号 p. 569-577
腎移植後に悪性腫瘍の罹患率が上昇することがわかってきたが,手術や周術期管理に関する報告は少なく,周術期の最適な免疫抑制療法,腎機能への影響,術後合併症などはわかっていない.我々は腎移植患者における直腸癌3例,膵腫瘍1例(1例は同時性重複腫瘍)の手術を経験した.周術期に経口摂取が不可能となる消化器癌手術であっても,免疫抑制剤を周術期は静注とし,術後早期に経口へと切り替えることで,特に腎機能を悪化させずに管理可能であった.ステロイド長期内服に伴う創傷治癒遅延,縫合不全などは大きな問題とならなかったが,1例に回盲部炎,クロストリジウム腸炎を認め,免疫抑制剤が関与している可能性があった.感染に対しては,より慎重かつ迅速に対応する必要がある.また,通常とは異なる術後合併症が起こる可能性があるため,移植医療に従事していない科が手術を担当している場合は,密に連携をとって周術期管理を行うべきである.
近年,腎移植の成績は飛躍的に向上し,長期生着,長期生存症例が増加している反面,移植後に悪性腫瘍の罹患率が高くなることがわかってきた1)2).当院では腎移植術,周術期管理,外来での経過観察を外科・泌尿器科合同で行っており,腎移植後に発症した消化器癌は外科で手術を担当している.我々はこれまでに腎移植患者における直腸癌3例,膵腫瘍1例(1例は同時性重複腫瘍)の手術を経験したので,若干の文献的考察を加えて報告する.
症例1:68歳,男性
主訴:便潜血陽性
既往歴:4年前,他院で生体腎移植術.原疾患は不明.
現病歴:腎移植後,当院で外来経過観察中.タクロリムス(tacrolimus;以下,Tacと略記)2 mg,ミコフェノール酸モフェチル(mycophenolate mofetil;以下,MMFと略記)1,000 mg,プレドニゾロン(prednisolone;以下,PSLと略記)5 mgの3剤にて,クレアチニン値(creatinine;以下,Crと略記)は0.9 mg/dl前後であった.腎移植から4年後,便潜血陽性のため精査となった.
注腸造影X線検査所見:直腸Rsに全周性狭窄を伴う腫瘍性病変を認めた(Fig. 1).
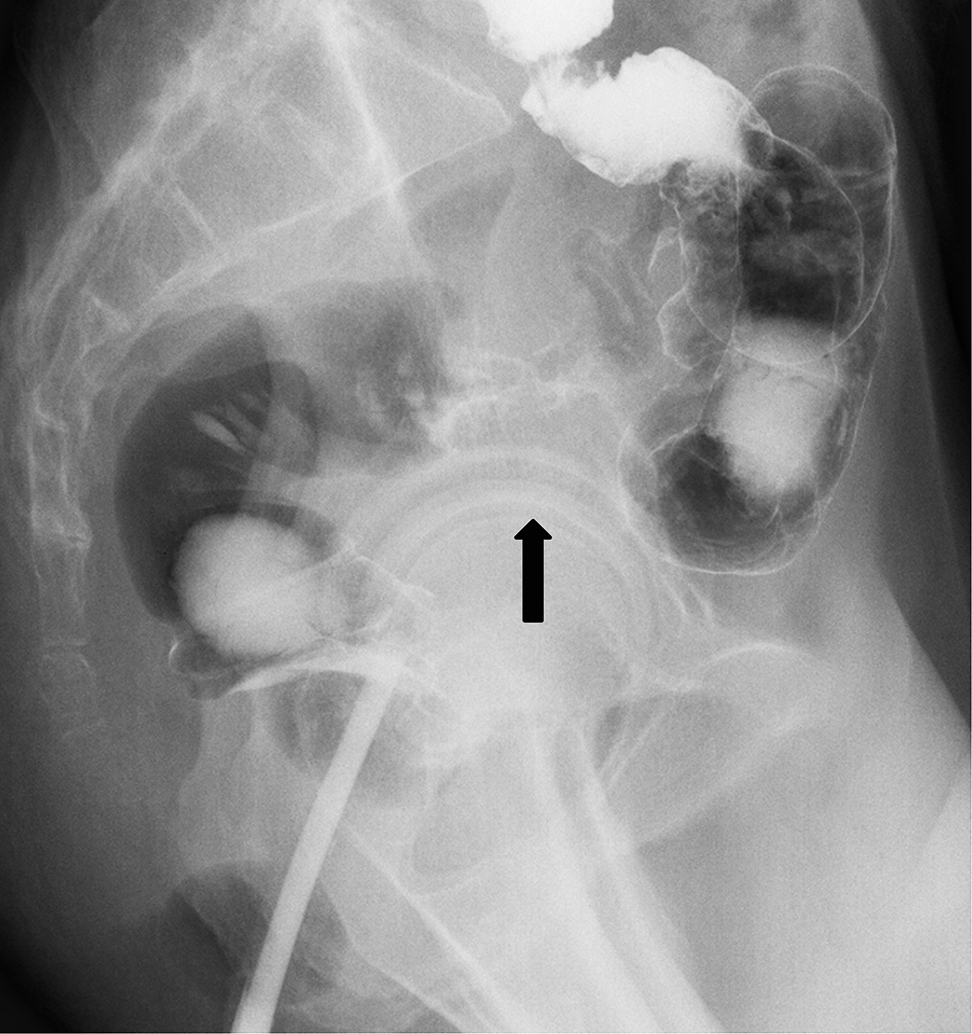
Barium enema examination shows an apple-core lesion in the RS domain.
腹部CT所見:直腸Rsに壁肥厚を認め,右腸骨窩に移植腎を認めた(Fig. 2).胆囊内には胆石を認めた.
Abdominal CT demonstrates wall thickness in the rectum and kidney allograft in the right iliac fossa.
直腸S状部結腸癌,胆石症と診断し,腹腔鏡下胆囊摘出術と直腸高位前方切除術(開腹)を一期的に行った.
術後経過:術後はTacとPSLを経静脈投与とし,第4病日より経口摂取再開とともに,TacとPSLを経口投与に変更,MMFを再開した.術後の腎機能も安定しており,特に合併症もなく,第15病日退院となった(Fig. 3).病理組織学的診断ではmoderately differentiated adenocaricinoma,se,n2,Stage IIIBであったため,半年間の術後補助化学療法を行った.現在,術後8年経過しているが,明らかな再発所見は認めず,Cr 1.1 mg/dlで移植腎も生着している.
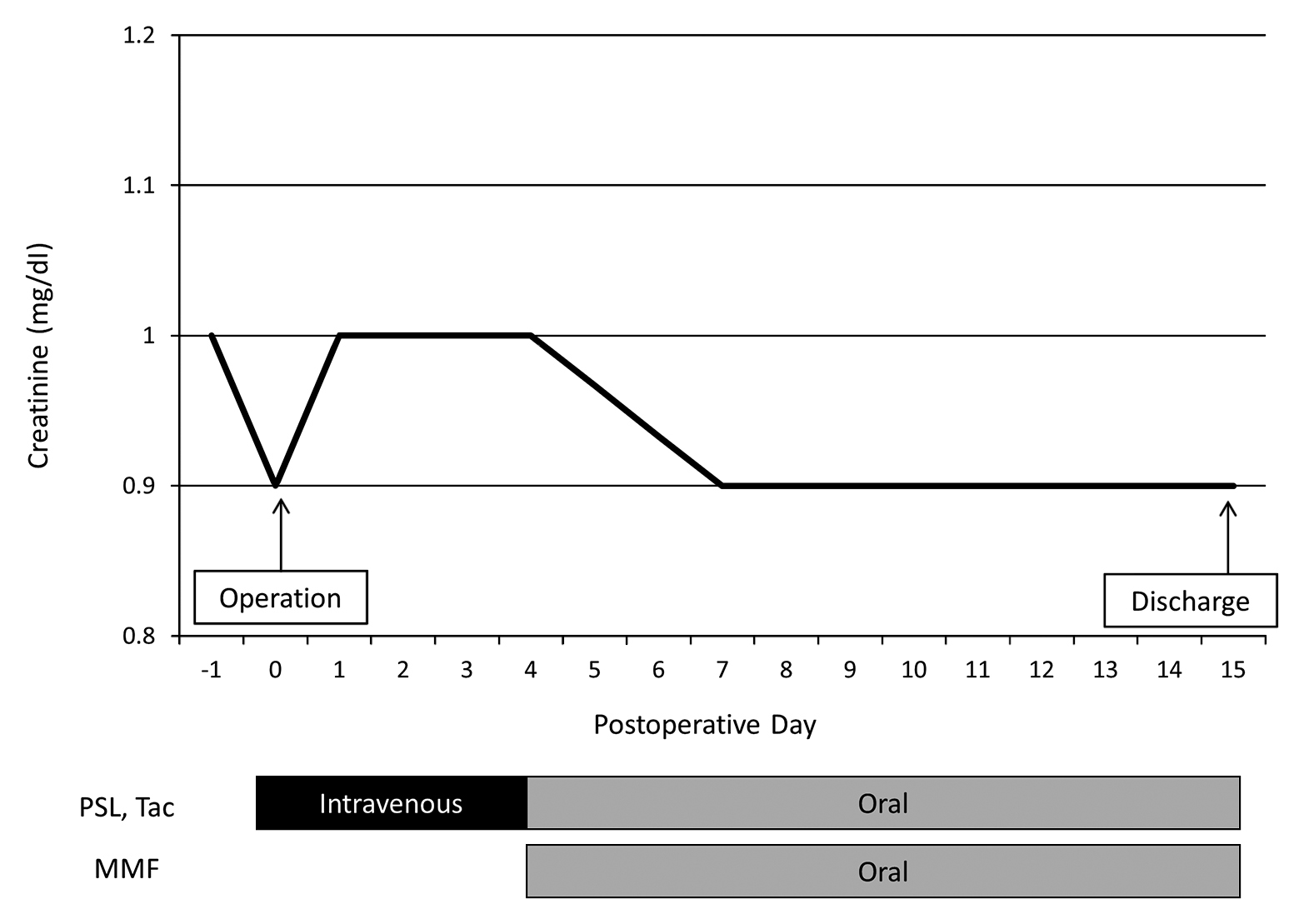
(Case 1) Changes in creatinine levels after the operation. PSL, prednisolone. Tac, tacrolimus. MMF, mycophenolate mofetil.
症例2:74歳,男性
主訴:便潜血陽性
既往歴:11年前,当院で生体腎移植術.原疾患は不明.
現病歴:腎移植後,当院で外来経過観察中.シクロスポリン(cyclosporin A;以下,CyAと略記)100 mg,MMF 1,000 mg,PSL 10 mgの3剤にて,Crは0.9 mg/dl前後であった.腎移植から11年後,便潜血陽性のため精査となった.
下部消化管内視鏡検査所見:直腸内に隆起性病変を認め,内視鏡的切除を行ったが,粘膜下層への浸潤があり,外科的追加切除の方針となった.
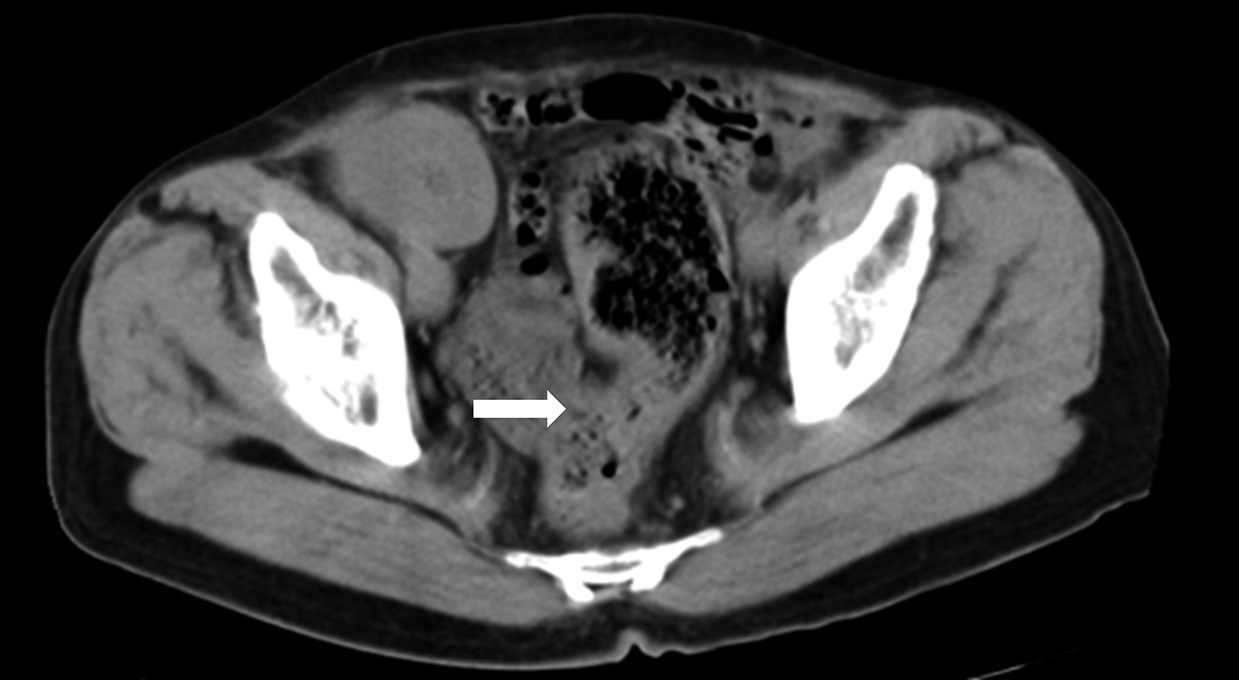
腹部CT所見:直腸Rsに内視鏡的切除時のクリップを認め,移植腎は右腸骨窩に認めた(Fig. 4).また,膵頭部の主膵管に囊胞変性を認めた(Fig. 5).
Abdominal CT demonstrates a clip used at the time of endoscopic resection in the RS domain. Kidney allograft is located in the right iliac fossa.

Abdominal CT demonstrates cystic degeneration of the pancreatic duct in the head of pancreas.
直腸S状部結腸癌,膵頭部膵管内乳頭粘液性腫瘍(intraductal papillary mucinous neoplasm;以下,IPMNと略記)と診断し,開腹下に膵頭十二指腸切除術と直腸高位前方切除術を一期的に行った.
術後経過:術後はCyAとPSLを経静脈投与とし,第5病日より経口摂取再開とともに,CyAとPSLを経口投与に変更,MMFを再開した.第12病日膵液漏を発症したため,感染悪化の可能性を考慮してMMFを中止とした.免疫抑制剤を全て中止することは拒絶反応のリスクが高いことから,CyAとPSLは継続とした.膵液漏はドレナージにて保存的に軽快し,第36病日退院となった.Crの一時的な上昇を認めたが,退院時のCrは術前と同じ0.9 mg/dlであった(Fig. 6).病理組織学的診断では直腸癌は摘出標本に遺残はなく,well differentiated adenocarcinoma,sm,n0,Stage I,膵頭部IPMNは腺腫のみであり,悪性像は認めなかった.現在,術後3年経過しているが,明らかな再発所見は認めず,Cr 0.9 mg/dlで移植腎も生着している.
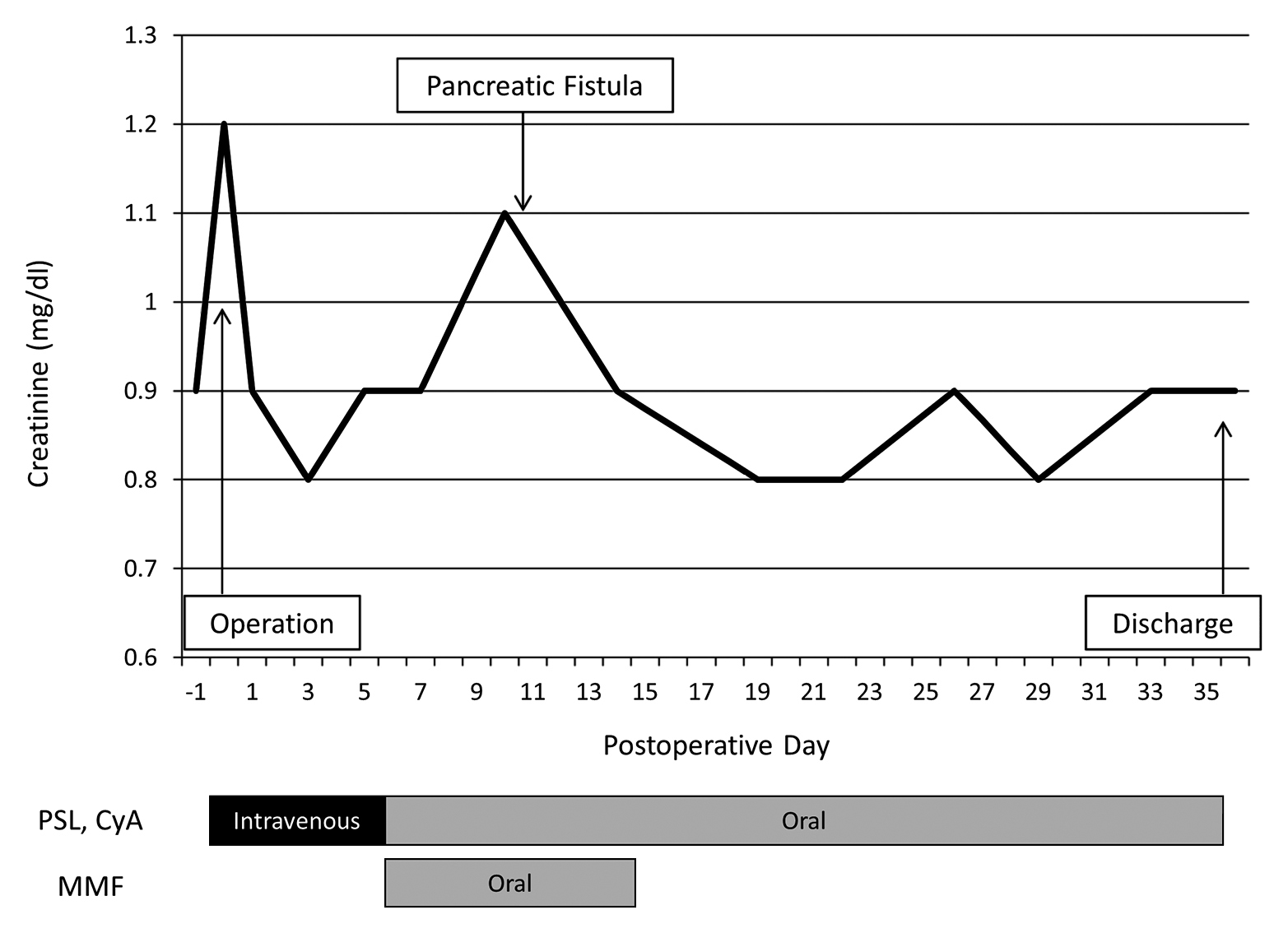
(Case 2) Changes in creatinine levels after the operation. PSL, prednisolone. CyA, cyclosporin A. MMF, mycophenolate mofetil.
症例3:70 歳,男性
主訴:便潜血陽性
既往歴:16年前,当院で献腎移植術.原疾患は慢性腎炎.その他,心臓弁置換術後,慢性心不全,感染性心内膜炎の既往あり.
現病歴:腎移植後,当院で外来経過観察中.CyA 100 mg,PSL 10 mgの2剤にて,Crは1.5 mg/dl前後であった.腎移植から16年後,便潜血陽性のため精査となった.
下部消化管内視鏡検査所見:直腸内に1型腫瘍を認めた(Fig. 7).腫瘍は巨大であり,内視鏡的切除が困難であるうえ,粘膜下層浸潤も強く疑われたため,外科的切除の方針となった.
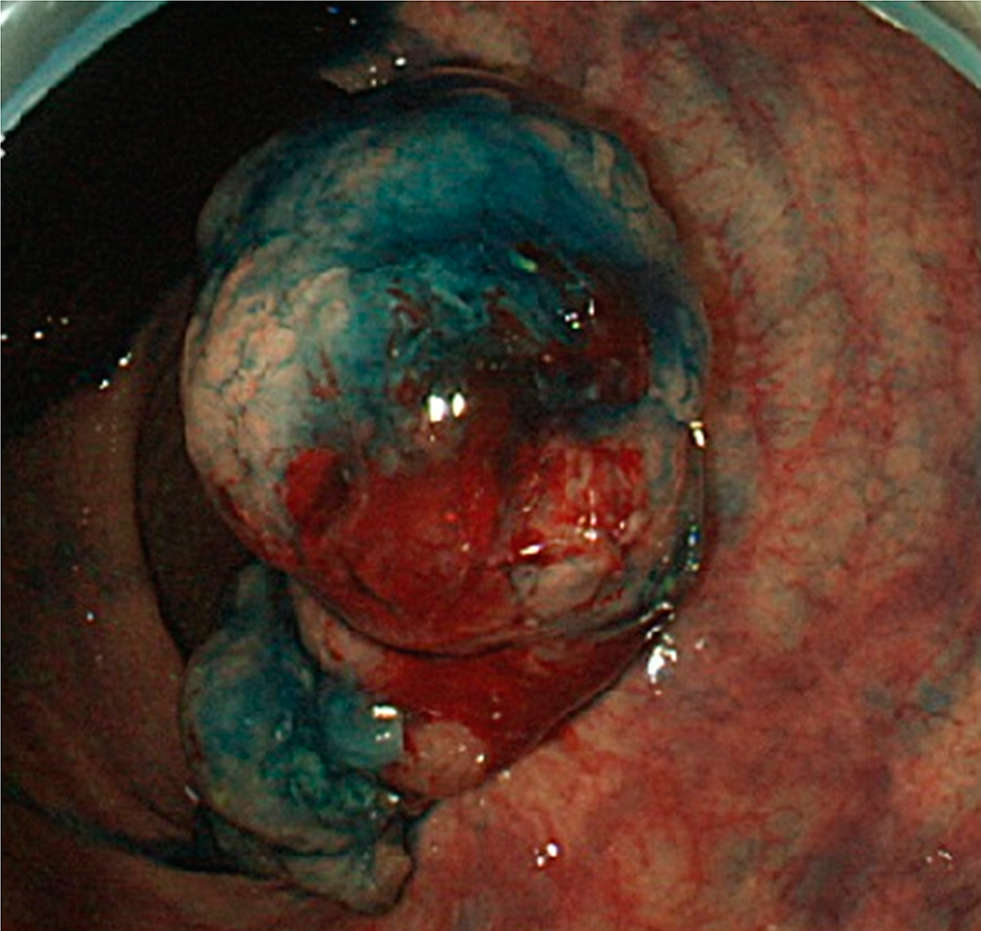
Colonoscopic findings. A type I tumor in the rectum.
注腸造影X線検査所見:腫瘍は直腸Rbに認めた(Fig. 8).
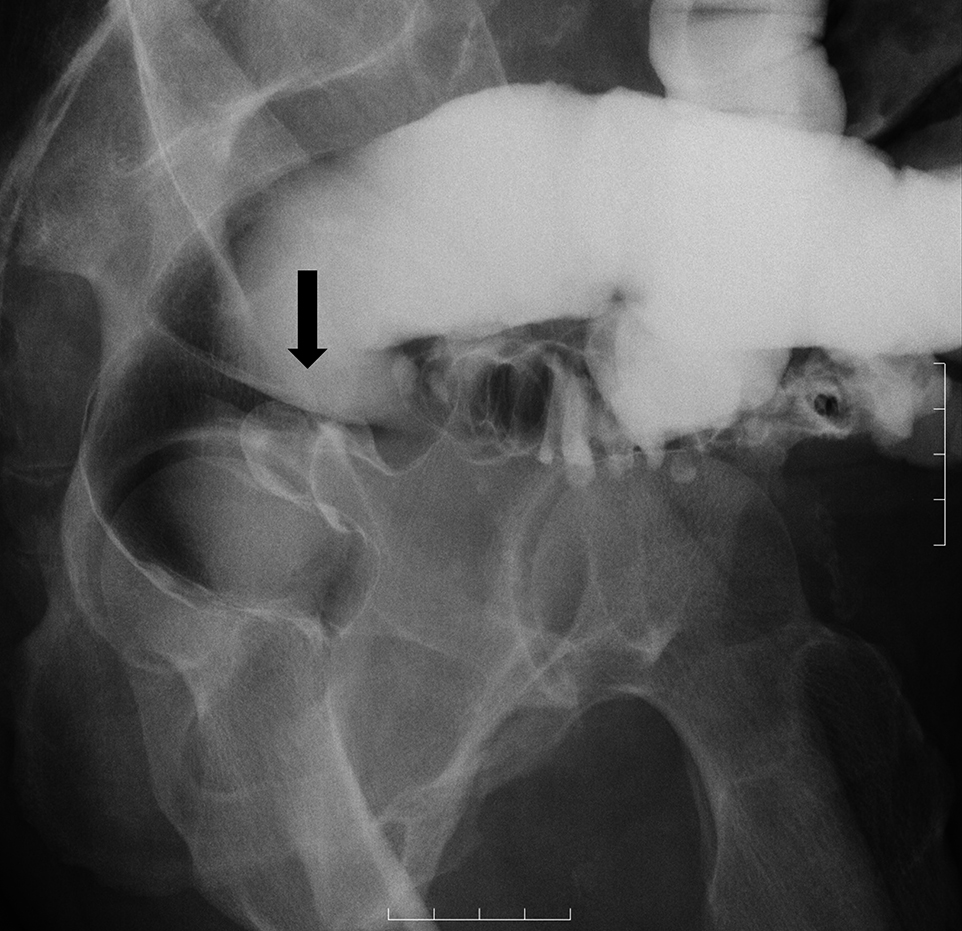
Barium enema examination shows an elevated lesion in the Rb domain.
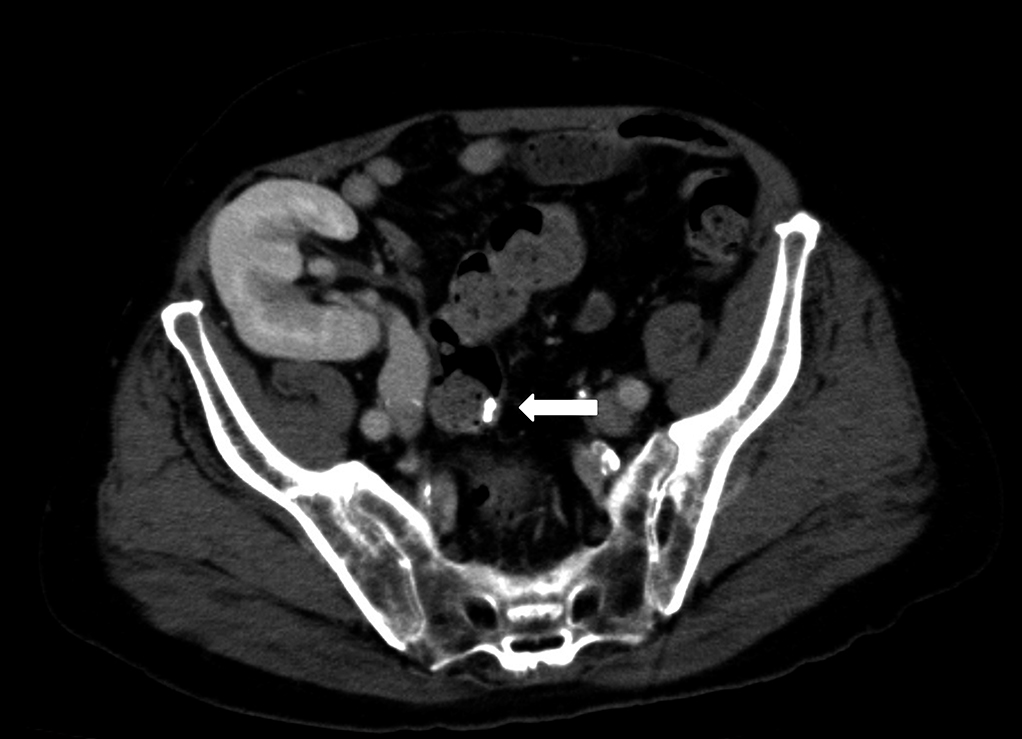
腹部CT所見:移植腎が左腸骨窩に移植されており,S状結腸と近接していた(Fig. 9).
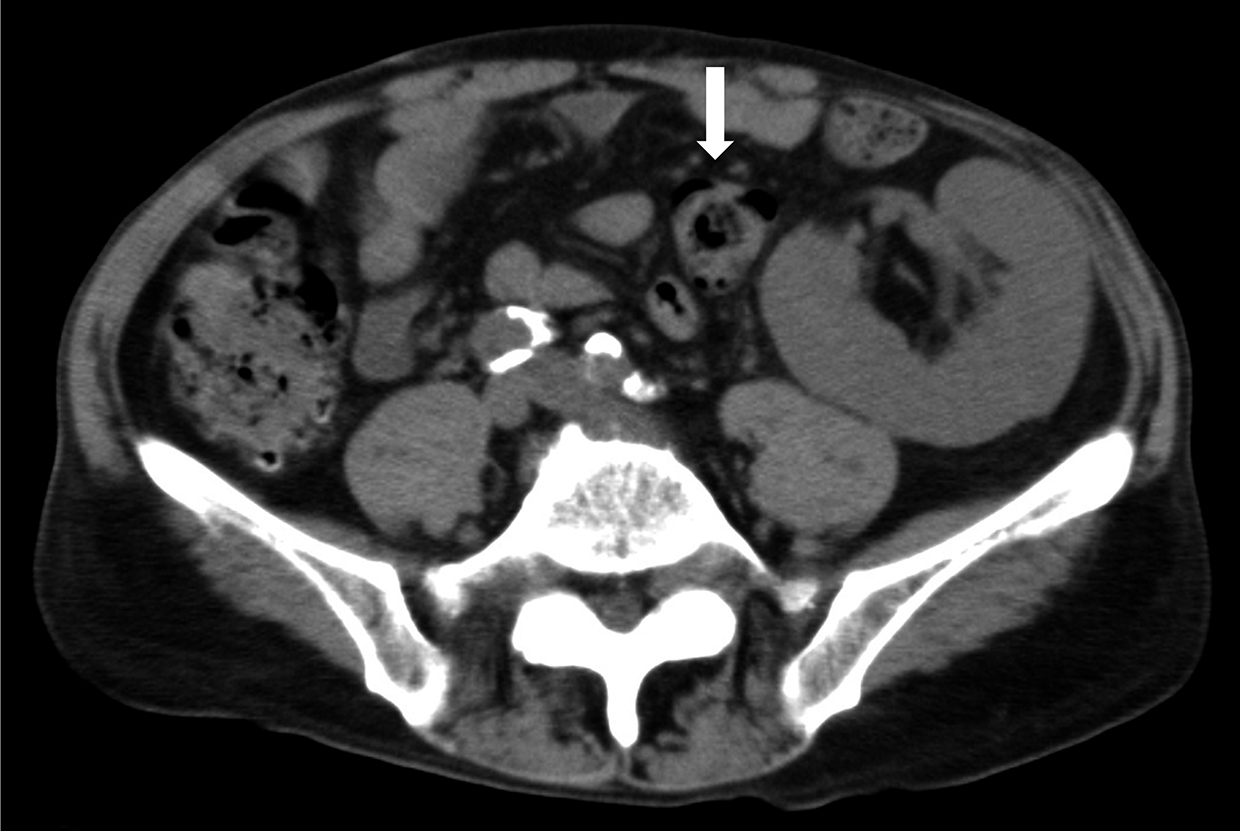
Abdominal CT reveals a kidney allograft in the left iliac fossa close to the sigmoid colon.
直腸癌と診断,直腸低位前方切除術も可能であったが,縫合不全を合併すれば腎機能や心機能が悪化し,致命的になる可能性が高いと判断し,直腸ハルトマン手術の方針とした.術中所見としては,S状結腸と移植腎は特に癒着もなく,ほぼ定型通りに手術可能であった.
術後経過:術後はCyAとPSLを経静脈投与とした.第2病日,心不全を発症したため,カテコラミンと利尿薬の投与を開始した.第5病日より経口摂取再開とともに,CyAとPSLを経口投与に変更した.その後,第14病日に発熱,炎症反応上昇を認め,熱源検索のためCTを施行したところ回盲部炎の診断となった.同日よりフロモキセフ静注を開始し,翌日には解熱傾向となったが,第17病日より下痢が出現した.便中のClostridium difficileトキシンが陽性であったため,フロモキセフは中止,メトロニダゾール内服を開始した.特に絶食や高カロリー輸液は必要とせずに下痢は軽快し,第21病日退院となった.Crは退院時には術前とほぼ同等の1.6 mg/dlまで改善した(Fig. 10).病理組織学的診断ではmoderately differentiated adenocarcinoma,mp,n0,stage Iであった.現在,術後2年経過しているが,明らかな再発所見は認めず,Cr 1.6 mg/dlで移植腎も生着している.

(Case 3) Changes in creatinine levels after the operation. PSL, prednisolone. CyA, cyclosporin A.
免疫抑制剤の進歩により,腎移植の成績は生着率,生存率ともに飛躍的に向上した.そのため,拒絶反応により移植腎を喪失することよりも,移植腎が機能したまま心血管疾患や悪性腫瘍などが原因で死亡するdeath with functioning graft(DWFG)が問題となっている3).腎移植後の発癌に関しては,欧米を中心に数多く報告されている.ウィルス感染が原因の一つとされる血液・造血器腫瘍や皮膚癌は特にリスクが高く,リンパ腫では10倍程度2)4),皮膚癌では30~40倍と報告されている5).この傾向は固形癌でも報告されており,大腸癌は2~5倍のリスクとされている6)7).腎移植患者における悪性腫瘍の早期発見,スクリーニングが腎移植のさらなる成績向上につながる可能性がある.
移植患者における悪性腫瘍発症の原因としては,免疫抑制療法による腫瘍性ウィルスの再活性化8)やカルシニューリン阻害薬によるDNA傷害があげられている9).近年では,免疫抑制剤減量による免疫抑制療法の適正化,抗腫瘍効果をもつとされるエベロリムスの導入などが試みられている10).エベロリムスは,細胞増殖や血管新生に関与するmammalian target of rapamycin(以下,mTORと略記)を阻害するため,心血管疾患の抑制や抗ウィルス効果,抗腫瘍効果が期待されている11).同じmTOR阻害薬であるシロリムスを導入したCONVERT試験では,有意に悪性腫瘍の発生が低かった12).本邦ではエベロリムスは腎移植における免疫抑制剤として承認されて間もないため,長期でのエベロリムスの抗腫瘍効果は明らかになっていないが,今後の長期的な観察による抗腫瘍効果の確認が期待される.
本邦でも移植患者の悪性腫瘍罹患率が高いことが報告されてきているが13)14),消化器癌の手術や周術期管理に関する本邦の報告は少なく15),周術期の最適な免疫抑制療法,腎機能への影響,縫合不全や感染などの免疫抑制療法に伴う合併症はわかっていない.さらに,移植患者は普段移植医療に従事していない医療者から敬遠されやすい現状がある.その原因の一つとしてTacやCyAは薬物代謝に個人差があり,血中濃度測定による投与量調整が必要であることがあげられる.周術期に内服が不可能となる消化器癌の周術期では免疫抑制療法の管理も煩雑となり,なおさら敬遠されやすくなると考えられる.
今回検討した3例は全て長期生着例であり,PSLの1日投与量は5もしくは10 mg,MMFは1,000 mg,Tacはトラフ値5 ng/ml前後,CyAは100 ng/ml以下で管理されていた.移植早期に比べ免疫抑制剤が減量されているが,長期生着例であっても拒絶反応のリスクから免疫抑制剤を全て中止することは不可能である.消化器癌手術の場合,周術期の数日間は絶食で管理されるため,免疫抑制剤を経静脈投与せざるを得ない.MMFは経口薬しかないため周術期は中止したが,PSLは5もしくは10 mgを静注で投与,Tac/CyAは1日経口投与量の1/4~1/3量を24時間持続静注とした.術後の経口摂取再開とともにMMFを再開し,PSLとTac/CyAを術前と同量の投与量で経口に切り替えた.いずれの症例も経口摂取再開まで術後4~5日程度であった.経静脈投与から経口投与に変更する際に,血中濃度が不安定となる可能性があったが,術前と同量の投与量で経口投与を再開した後も免疫抑制剤の血中濃度は安定していた.Tac/CyAの血中濃度が上昇した場合には腎機能障害が起こりうるため,経口投与への切り替え時は頻回の血中濃度測定による用量調整が必要である.
今回の3症例では,周術期の経口投与が不可能な消化器癌手術であっても,PSLとTac/CyAを静注から早期に経口へと切り替えることで,術後も特に腎機能を悪化させずに管理可能であった.MMFは周術期に中止したが,特に拒絶反応を疑う所見も認めず,移植腎は3例とも生着している.ただし,外来通院患者において,MMF減量や中止に伴う拒絶反応を臨床上経験することから,できるだけ術後早期にMMFも再開することが望ましい.
免疫抑制剤に伴う主な合併症をTable 1に示す.Mercheaら16)は多臓器移植を含む臓器移植患者のうち,大腸癌を発症した20例の結果を報告している.30日以内の術後合併症は11例(55%)に認め,創感染,術後腸閉塞が3例ずつで最多であった.Clavien分類グレード3以上の合併症は2例のみであり,1例は術後に腎機能が悪化しグラフトロス,1例は腫瘍が穿孔していたため緊急手術を行った症例で,術後に脳梗塞となり治療中止となっている.吻合を行った17例では縫合不全を認めなかったとしている.
| Immunosuppressive drugs | Adverse events |
|---|---|
| Prednisolone | Infection |
| Delayed wound healing | |
| Anastomotic leakage | |
| Gastrointestinal bleeding/ulcer | |
| Hyperglycemia | |
| Tacrolimus/Cyclosporin A | Infection |
| Renal dysfunction | |
| Hyperglycemia | |
| Mycophenolate mofetil | Infection |
| Pancytopenia | |
| Diarrhea |
ステロイドの長期内服に伴う消化管の縫合不全は6.77%(95%信頼区間:5.48~9.06)という報告もあるが17),原疾患やステロイド内服量,内服期間が一定でない患者群での報告であり,ステロイドが減量されている長期生着の腎移植患者では,通常と比べてそれほど縫合不全のリスクは増大しないものと考えられる.Leeら18)の報告では,移植患者における大腸の待機手術の合併症(Clavien分類グレード2以上)の発生頻度は20.8%であり,非移植患者と同等であるとしている.
今回検討した3症例では,縫合不全や創傷治癒遅延,術後の腎機能障害はいずれも大きな問題とならなかった.ただし,3例目は術後に回盲部炎,クロストリジウム腸炎を発症しており,免疫抑制療法が関与している可能性がある.Alangadenら19)の報告によると,腎移植患者における感染症127例では尿路感染症が47%で最多であり,ウィルス感染症が17%,肺炎が8%であった.6例にサイトメガロウィルス感染,6例に真菌感染を認め,ムコール症とカンジダ症の2例は死亡しており,感染に対してはより慎重かつ迅速な対応が必要となる.
腎移植患者の消化器癌は安全に手術可能であると考えられるが,通常と異なる術後合併症が起こる可能性があるため,移植医療に従事していない科が手術を担当する場合は,密に連携をとって周術期管理を行うべきである.
利益相反:なし