2016 年 49 巻 8 号 p. 797-803
2016 年 49 巻 8 号 p. 797-803
症例は61歳の男性で,23年前に潰瘍性大腸炎(ulcerative colitis;以下,UCと略記)を発症した.内科的コントロール不良のため,発症より5年後に下行結腸切除術およびハルトマン手術を行い,さらにその1年後に残存大腸の全摘とH型パウチによる回腸囊肛門吻合術および一時的回腸人工肛門造設術が施行された.人工肛門は本人の希望によりその後閉鎖されることはなかった.術後16年間特に問題なく経過していたが,当院受診の1年前から肛門より出血,排膿を認めるようになった.回腸囊炎と診断され内科的治療を行ったものの改善はなく,当院へ精査加療目的に紹介となった.下部消化管内視鏡検査にて回腸囊に腫瘍を認め,生検の結果回腸囊癌と診断されたため,回腸囊摘出術を施行した.UC術後の回腸囊空置例においても,回腸囊癌発生の可能性に留意し,定期的な内視鏡検査によるフォローを行う必要があると考えられた.
潰瘍性大腸炎(ulcerative colitis;以下,UCと略記)は,主として粘膜を侵し,しばしばびらんや潰瘍を形成する大腸の原因不明のびまん性非特異性炎症である1).薬物療法や血液成分除去療法により内科的にコントロールが可能な症例もある一方,治療抵抗性のため外科手術が回避できない症例も,UC罹患者数の増加とともに増えている状況にある.
UCに対する手術療法は,現在大腸全摘および回腸囊肛門吻合術(ileoanal anastomosis;以下,IAAと略記)あるいは回腸囊肛門管吻合術(ileoanal canal anastomosis;以下,IACAと略記)が標準術式とされている2).回腸囊炎は頻度の高いUC術後合併症として,本邦では術後5年で13.6%,10年で21.7%と報告されている3)4).回腸囊炎の経過中に回腸囊癌が発症したとされる症例報告も認められるが,その発癌過程,機序については一定の見解が得られていない.
今回,我々は難治性のUCに対して大腸全摘,IAAおよび一時的回腸双孔式人工肛門造設術を施行し,術後16年目に回腸囊炎が発症し,その経過中に癌化した症例を経験したので報告する.
患者:61歳,男性
主訴:肛門痛
家族歴:特記すべきことなし.
既往歴:UC
現病歴:23年前発症のUCで発症から5年後に内科的コントロール不良な重症のUCと診断され,他院にて下行結腸切除術およびハルトマン手術が施行された.術後内科治療が継続されたが,1年後に病状のコントロールが困難となったため,残存大腸が切除され,H型パウチによるIAAと一時的回腸人工肛門造設術が施行された.人工肛門は本人の希望によりその後閉鎖されることはなかった.その後16年間同院にて定期的に外来通院していたものの,無症状のため内視鏡検査は行われていなかった.当院初診より1年前に発熱および肛門からの排膿と出血を認めたため,内視鏡検査ならびに生検を行った結果,回腸囊炎と診断された.セフェム系抗菌薬や5-ASA注腸製剤による治療を行ったものの改善が認められないため,回腸囊炎に対する精査加療目的にて当院を紹介受診となった.
初診時現症:身長164.0 cm,体重60.0 kg,血圧113/73 mmHg,脈拍数98回/min,体温36.9°Cであった.肛門痛および肛門からの出血,排膿を認めた.肛門狭窄もあるが,示指の挿入は可能であり,全周性に腫瘤を触知した.また,痔瘻は認められなかった.
初診時血液生化学検査所見:貧血はないものの,WBC 11,510/μl,CRP 2.47 mg/dlと炎症反応の上昇を認めた.また,CEAが6.1 ng/mlと軽度上昇していた(Table 1).
| Blood count | ALP | 267 IU/l | |
| WBC | 11,510/μl | γGTP | 42 IU/l |
| RBC | 500×104/μl | T-Bil | 0.8 mg/dl |
| Hb | 13.3 g/dl | BUN | 11.1 mg/dl |
| Plt | 27.7×104/μl | Cr | 0.86 mg/dl |
| Biochemical test | CK | 34 IU/l | |
| TP | 7.8 g/dl | AMY | 88 IU/l |
| Alb | 4.1 g/dl | Na | 135 mEq/l |
| CRP | 2.47 mg/dl | K | 4.2 mEq/l |
| AST | 16 IU/l | Cl | 96 mEq/l |
| ALT | 13 IU/l | CEA | 6.1 ng/ml |
| LDH | 112 IU/l | CA19-9 | 11.0 U/ml |
腹部造影CT所見:骨盤内の回腸囊に一致して内部に液体貯留のある腫瘤を認め,造影効果を伴う不整な壁肥厚像を呈していた(Fig. 1).
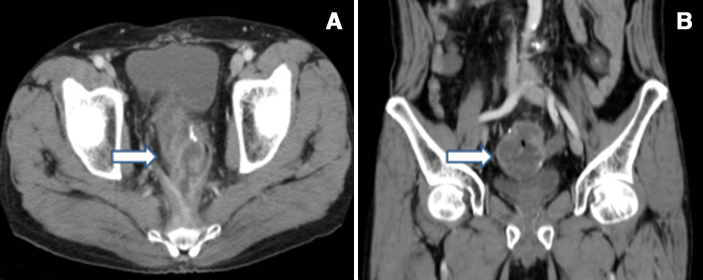
A, B: Enhanced CT shows a mass with wall thickening and fluid collection in the ileal pouch (arrows).
下部消化管内視鏡検査所見:肛門縁から約1 cmより,発赤,出血,びらん,潰瘍と腫瘤性病変が認められ,病変は約15 cmにわたり連続していたため,腫瘍の4か所より生検を行った.腫瘍より口側の腸管は狭窄が強く,内視鏡の挿入は困難であった(Fig. 2).

A, B: Endoscopy shows bleeding, erosion, and stenosis and an ulcer and tumor in the ileal pouch.
生検病理組織学的検査所見:High grade adenoma/high grade dysplasia相当の細胞・構造異型を示す部分が多いが,一部ではdesmoplastic reactionを伴っており,全体としてcarcinoma in/with adenomaの所見であった.
最終的に回腸囊癌と診断し,開腹回腸囊摘出術の方針となった.
手術所見:人工肛門の肛門側小腸を切離し,同部を起点として腸間膜を順次結紮切離していきながら骨盤腔へ到達し,腫瘍を確認した.腫瘍は骨盤内に手拳大の腫瘤として触知し,周囲と強固に癒着していた.腫瘍後壁側は膿瘍腔を形成していた.腹腔側から可及的にパウチを周囲組織より剥離し,また会陰操作にて自然肛門を含む皮膚切開を行い,外肛門括約筋の外側を通る筋切離を行い,腹腔内からの剥離層と交通させ,人工肛門よりも肛門側の回腸から肛門までを摘出した.しかしながら,腫瘍を含む回腸囊と周囲との癒着は高度であったため腫瘍は分割切除となった.
摘出標本肉眼的所見:回腸囊と思われる腸管吻合部に一致して65×60 mm大の腫瘍を認め,腫瘍内部には複数のステープルが認められた.腫瘍には5 mm程度の穿孔部位が1か所認められ,また粘液産生の目立つ部位も認められた(Fig. 3).

Macroscopic examination of the resected specimen reveals a tumor in the ileal pouch (arrow in Fig 3B), and the anus (Fig 3A).
病理組織学的検査所見:肉眼的に正常な小腸と腫瘍との境界を観察すると,筋層は折り返されるような走行を示しており,H型回腸囊の部分であると思われた.折り返された部位には炎症性変化や萎縮性変化を示す小腸粘膜が一部認められており(Fig. 4白矢印),同部位から連続して高~中分化腺癌が認められた(Fig. 4黒矢印).直腸粘膜の残存は認められなかった.深達度はT4aに相当したが,リンパ節への転移は認められなかった.脈管侵襲はly0,v2で,水平断端は陰性であったものの,分割切除になっているため,外科剥離面の癌浸潤の有無は不明であった(Fig. 4).

A: Histopathological examination shows inflammatory and atrophic changes in the small intestinal mucosa (white arrow), and a moderately to well differentiated adenocarcinoma derived from the small intestinal mucosa (black arrow). B: A magnified image of the region indicated by the black arrow in Fig. 4A.
術後経過:術後第2病日目より食事を再開した.第11病日目に腹痛,嘔吐が出現し,腹部レントゲン検査にてニボー像が認められたためイレウスと診断した.保存的加療にて症状は軽快し,第17日目に退院となった.腫瘍が分割切除となり,また剥離面の腫瘍残存の可能性も否定できないため,外来通院にて合計50.4 Gyの骨盤内照射を行った.術後18か月が経過した現在,腫瘍マーカーは正常範囲内であり,CT上明らかな再発所見なく経過している.
UCにおいて,内科的治療の向上により長期寛解例が得られる症例が増えた一方で,治療抵抗性のためQOLの低下を来し,外科的治療の適応となる症例も増えている2).術式としては,大腸全摘後にはその再建法として,残存直腸からのUCの再燃,colitic cancerの発生を排除すべく回腸囊と肛門を吻合するIAAや肛門機能温存に配慮した,回腸囊と肛門管を吻合するIACAが行われることが多い2).
本邦では報告例は認めないものの,海外では手術施行後に回腸囊から癌が発生したとされる報告が散見される.医学中央雑誌(1977年~2014年)で「潰瘍性大腸炎」,「回腸囊癌」をキーワードとして検索したかぎりでは報告例は認められなかったが,PubMed(1950年~2014年)で「ulcerative colitis」,「proctocolectomy」,「adenocarcinoma」,「pouch」をキーワードとして検索したところ35例の報告例が認められており,その発生率は,20年で2.4%,25年で3.4%であった5).近年若い世代のUCの罹患者数が増えている状況を鑑み,長期の術後観察期間を要する状況になりうると考えれば決して看過することはできない.
回腸囊癌の発生については,意図せず残存した直腸粘膜もしくは回腸由来の癌の発生の両面から検討する必要がある.Heppellら6)は,UCに対して大腸全摘およびIAAが施行され,その後に消耗性の下痢や骨盤部の感染により回腸囊を切除する必要があった8例中2例の標本に直腸粘膜の遺残が認められたと報告している.IAAの場合,理論的には術後に直腸粘膜は存在しないと思われるが,手技的な要因により直腸粘膜が残存し,同部位より癌が発生する可能性は残る.しかし,本例においては,病理組織学的検査所見として明らかな直腸粘膜の遺残が認められていない点や,正常の小腸粘膜から連続して腫瘍細胞が認められる点,また摘出標本における腫瘍は回腸囊とほぼ一致している点や,初回の摘出標本から異形成や癌が認められていない点などをふまえ,回腸囊癌は回腸囊粘膜自体から発生したものであると考えられた.
回腸囊の発癌に関して,Knupperら7)は,回腸囊の慢性的な萎縮性変化が回腸囊癌を発生させる可能性を指摘している7).本症例では人工肛門よりも肛門側の腸管を長期間使用しておらず,また病理組織学的に回腸囊を含め摘出した回腸粘膜全体に萎縮性変化が認められており,本症例における癌化の原因の一つになった可能性がある.また,Knupperら7)の報告では,全例回腸囊は空置されておらず,食餌,残渣が粘膜面に接触する状況にあったものの,回腸囊の粘膜には病理学的な萎縮性変化を認めた.本症例は,人工肛門が閉鎖されず,人工肛門から回腸囊までの腸管は空置されていたため,より萎縮性変化を来す環境にあった可能性が高い.
回腸囊炎による持続的な炎症からの癌化の問題についても考慮されるべきである.UCにおける大腸全摘およびIAA,IACAに対する術後合併症として,最も頻度の高いものが回腸囊炎である.海外におけるUC術後の回腸囊炎の頻度は12~50%とされており8)9),本邦では5年で13.6%,10年で21.7%と報告されている3)4).回腸囊炎の原因は明らかではないが,回腸囊炎の治療には抗菌剤が有効なことが以前から知られており,腸内細菌叢の関与が指摘されている.しかし,嫌気性菌のovergrowthが原因とする報告がある一方で10),回腸囊炎では糞便中において嫌気性菌が減少し,好気性菌が増加したという報告もあり11),原因菌の特定には至っていない.近年では嫌気性菌と好気性菌のバランスが問題となるとも報告されている12).一方で,家族性大腸ポリポーシスに対する同手術での回腸囊炎の頻度は0~11%と低いことや13),抗菌剤が無効な症例に対してステロイドや5-ASA製剤などといったUCと同様の治療薬が有効であったとの報告があることから9),回腸囊炎はUCをじゃっ起させる病態自体が原因であるとも考えられている.従来UCの炎症の主座は大腸のみであったはずだが,最近になりUC患者の十二指腸や小腸にもUCと同様な機序による病変が生ずることも明らかとなってきており14),回腸囊にもUCに伴う炎症がじゃっ起されてもおかしくはない.
持続的な腸管の炎症からの異形成,発癌のシーケンスは一般的に知られているが,回腸においてこのシーケンスが適用されるかは定かではない.しかし,長期間のbackwash ileitisの既往は異形成発生の危険因子の一つとの報告もあることから5),回腸での持続的,慢性的な炎症も,異形成から発癌に関与する可能性がある.本症例においては,少なくとも約12か月にわたる難治性の回腸囊炎が認められていた.
本症例では,回腸囊炎発症7か月の時点で他院にて内視鏡検査を行い,潰瘍内に島状に存在する粘膜から1か所のみを生検している.しかし,粘膜は壊死を伴い,周囲に炎症細胞浸潤を伴った肉芽組織を認めたものの,悪性所見は認められなかった.その5か月後の内視鏡下生検にて腺癌と診断され,術後病理組織学的検査所見として漿膜まで達する癌が認められたことを考えれば,初回の内視鏡診断が不十分であった可能性が高い.回腸囊の観察に際しては,特に回腸囊炎が認められる場合には,白色光による通常観察だけではなく,色素内視鏡観察,拡大観察などの画像強調観察技術を利用した内視鏡検査を併施し,必要に応じて複数箇所から生検を施行することも必要だと思われる.
回腸囊癌の発生機序については今後も多くの症例を集積し解明されるべき課題ではあるが,大腸全摘後に回腸囊を作製し吻合を行った症例では,すべからく発癌のリスクがあると考えるべきである.Ventoら15)は,回腸囊における異形成,癌の発生リスクは非常に低いため,初回手術標本における異形成や癌の存在,あるいは原発性硬化性胆管炎を合併した患者を除き定期的な内視鏡検査は不要であると報告している.しかし,本症例のように発癌の危険因子がなくとも回腸囊に癌が発生する可能性があることから,定期的な回腸囊の内視鏡検査は必須であると考えている.回腸囊のみの内視鏡観察であれば浣腸程度の前処置でも十分であり,観察時間も数分で済むことから,低侵襲である.有症状の際にのみ回腸囊を観察するのではなく,定期的に回腸囊の観察を行うことにより,回腸囊炎の評価,回腸囊癌の有無を確認でき,ひいては早期に治療介入をすることができる.医療者側も,術後の内視鏡検査を伴う経過観察の重要性を理解し,術後の患者に対しては,外来フォローから離脱するリスクを十分に説明する必要がある.
利益相反:なし