Abstract
症例は69歳の女性で,膵頭部癌に対し亜全胃温存膵頭十二指腸切除術,門脈合併切除再建術を施行した.術後経過は良好であったが,術後2週の造影CTで門脈吻合部の狭窄を認めていた.術後3か月での経過観察目的の造影CTでは,門脈狭窄部のすぐ下流側(肝側)に,径24 mmの囊状門脈瘤を認めた.門脈圧亢進を疑う所見は認めなかった.急速に出現・増大した門脈瘤に対し,破裂や出血のリスクを懸念し経皮経肝門脈経路でメタリックステント(non-covered type,10 mm径×40 mm長)を留置した.術後1週の造影CTで門脈狭窄の改善,門脈瘤の縮小を認め,術後6か月で消失した.吻合部近傍に発生したこの門脈瘤は,吻合部狭窄による異常血流,門脈の捻れ・変形,門脈壁の脆弱性がその成因と考えられ,門脈ステントにより血流が是正され瘤の縮小が得られた.
はじめに
膵頭十二指腸切除術において,癌の根治性を得るため門脈合併切除が積極的に行われているが,再建後の門脈吻合部に狭窄を来すことが時として経験される.吻合部狭窄によって門脈圧亢進状態となり,門脈上流側(末梢側)のうっ血や,側副血行路の形成,腸管の静脈瘤による消化管出血などを起こしうる1)~7).一方,門脈下流側(肝側)では肝血流量が減少し肝不全の原因となるが,門脈の形態異常を来すことは知られていない.今回,我々は門脈吻合部狭窄の後,圧負荷のかからない吻合部下流側に門脈瘤を形成した非常にまれな1例を経験したので報告する.
症例
患者:69歳,女性
主訴:なし.
既往歴:特記事項なし.
家族歴:特記事項なし.
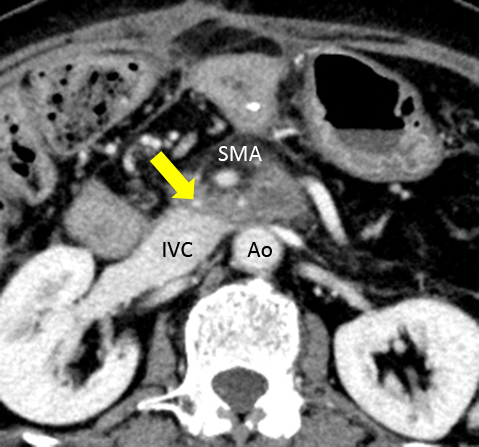
現病歴:閉塞性黄疸を契機に門脈浸潤を伴う膵頭部癌と診断され当科に紹介となった.T4N0M0,Stage IVaの術前診断で亜全胃温存膵頭十二指腸切除術(SSPPD-IIA-1,D2郭清)および門脈合併切除再建術を施行した.脾静脈合流部から下腸間膜静脈合流部にかけての門脈右側に腫瘍の浸潤を認め,右側の断端距離をより確保するべく脾静脈合流部を含めて門脈・上腸間膜静脈を約3 cm切離し,脾静脈は非再建とした(Fig. 1a).再建は端々吻合で2点支持法を用い,6-0 PROLENE®で後壁intraluminal,前壁over and overで連続吻合し,growth factorは置いていない.前壁縫合終了前にヘパリン生食で門脈内腔を洗浄し血栓がないことを確認した.吻合部に若干の変形が生じたが,吻合部の緊張はなく再建後の門脈血流は良好で手術を終了した(Fig. 1b).手術時間は8時間23分,出血は1,280 gであった.術後は合併症なく経過し,術後2週に経過観察目的で造影CTを施行した.門脈吻合部は内腔径が約3 mmに狭小化していたが,狭窄部下流側の血流は良好で,吻合部上流側に血管拡張は認めなかった.上流の門脈内腔径に対する吻合部の開存率は48%であった(Fig. 2).これらの所見を認めたが,側副血行路の発達を期待し経過観察とし,退院となった.最終病理診断は,Ph,TS2,Tub2>por,sci,INFβ/γ,ly2,v2,ne2,mpd(–),pTS2,pT4,pCH(–),pDU(+),pS(+),pRP(+),pPV(+),pA(–),pPL(+),pOO(–),pN2(No. 13a, 14d),pM0,Stage IVbであり,補助化学療法としてS-1(80 mg/body)を施行していた.術後3か月での経過観察目的の造影CTで,吻合部近傍の門脈に異常拡張を認め精査加療目的に入院となった.
入院時現症:身長138 cm,体重37.5 kg,血圧106/72 mmHg,脈拍81回/分,眼球結膜に貧血を認めた.腹部は平坦,軟で圧痛なし.上腹部正中に術創を認めた.
入院時血液検査所見:WBC 4,500/μl,Hb 9.8 g/dl,Plt 22.5×104/μl,AST 18 IU/l,ALT 13 IU/l,ALP 262 IU/l,γ-GTP 11 IU/l,T-Bil 0.4 mg/dl,Alb 3.0 g/dl.T-Chol 129 mg/dl,TG 57 mg/dl,CRP 1.1 mg/dl,PT% 72.6%,APTT 26.3 secと貧血,低栄養とCRPの軽度高値を認めた.腫瘍マーカーは,CEA 5.4 ng/ml,CA19-9 86 IU/lとCA19-9が軽度高値であった.なおこれらの所見は,退院時と同程度であった.
術後3か月 腹部造影CT所見:門脈狭窄部のすぐ下流側に腹側に突出する長径24 mmの囊状門脈瘤を認めた.門脈狭窄は残存していたが,肝内門脈血流は良好で,上流側門脈の拡張や側副血行路の形成,脾腫など,門脈圧亢進を疑う所見は認めなかった(Fig. 3).
門脈切除再建後の吻合部に出現した門脈瘤は,3か月の短期間で急速に増大しており,破裂や出血の危険があると考えた.十分なインフォームドコンセントを行い,門脈ステントを留置する方針とした.
経皮経肝的門脈ステント留置:局所麻酔下,超音波ガイド下に経皮的に門脈P8根部を穿刺し,肝内門脈を造影し門脈内腔を確認した.ガイドワイヤーを挿入,狭窄部を超えて上腸間膜静脈(superior mesenteric vein;以下,SMVと略記)本幹に進め,6 Frショートシースを挿入した.門脈狭窄部および瘤をまたぎ,かつステントの末梢端がSMV空腸枝を被覆しないよう注意して,non-covered stent(COOK社製,Zilver®ステント,10 mm径×40 mm長)を留置した.留置直後の門脈造影では,瘤の縮小はみられなかったものの,狭窄は著明に改善していた(Fig. 4).
術後経過:合併症なく経過し,術後第7病日の造影CTで門脈瘤は24 mmから15 mmに縮小し,門脈血栓は認めずステント開存は良好であった.ステント閉塞予防としてバイアスピリン®100 mg/日を開始して退院とした.その後も経過で徐々に門脈瘤は縮小し,術後6か月での造影CTで門脈瘤の消失が得られた(Fig. 5).現在までステント留置後13か月が経過し,門脈瘤の再燃はなくステント開存も良好である.再発徴候は認めず外来通院中である.
考察
門脈再建後の門脈狭窄は,吻合部のねじれ・変形,吻合部の緊張などの術中操作に加えて,門脈血栓,膵液瘻などの術後合併症,吻合部の瘢痕,肝硬変,腫瘍の再発などさまざまな要因によって引き起こされ,近年では肝移植後の報告も多くみられる1)~9).主たる原因である門脈吻合部の緊張については,たとえ術中の吻合部に緊張がなくても,術後の離床に伴い小腸間膜が下垂することによって門脈が牽引されることに留意する必要がある7).Fujiiら6)は,多数の門脈再建症例の中期予後を検討し,門脈切除長≥31 mmが術後門脈狭窄の独立不良因子であったとして,門脈切除がこれを超える場合は吻合部に緊張が生じやすいため,左腎静脈などのグラフトを用いた再建が有用であると報告している.本例では,門脈切離角度が上流側と下流側で異なったため,再建後の門脈に捻れ・屈曲が生じ,門脈狭窄を来したと考えられる.術中の血流は良好であったこと,追加切離による吻合部の緊張を危惧し再吻合は行わなかったが,吻合部の緊張や捻れが懸念される場合はグラフトを用いた再建を考慮すべきと思われた.門脈狭窄が生じると門脈圧亢進状態となり,求肝性・遠肝性に側副血行路が発達する.通常,門脈圧亢進状態ではcavernous transformationとよばれる肝十二指腸間膜を介した求肝性の側副血行路により門脈圧が調節されるが,膵頭十二指腸切除後では,肝十二指腸間膜の郭清のため求肝性側副血行路が発達できず,肝不全や消化管出血,腸管うっ血,腹水貯留などの原因となりうる3)4).また,膵頭十二指腸切除後には挙上空腸を経た求肝性側副血行路が発達するため,挙上空腸や胆管空腸吻合部に静脈瘤が出現し消化管出血の原因となりうる3)4)6).Kangら7)の報告では,50%以上の門脈狭窄率を有する症例の3.1%が消化管出血を来し,またFujiiら6)の報告では,70%以上の門脈狭窄率を有するほぼ全例で消化管出血や肝性脳症を起こしていた.
門脈瘤は肝内・肝外の門脈が限局性に囊状または紡錘状に拡張した比較的まれな病態である.Doustら10)の報告では,肝外門脈径が非硬変肝で最大15 mm,硬変肝では最大19 mmであった.このため,一般的に肝外門脈瘤は,肝外門脈の最大径2 cmを超える拡張と定義されている11).門脈瘤は先天性と後天性に分類され,先天性門脈瘤は血管壁の脆弱性,発生異常(卵黄囊静脈や臍静脈の吻合異常)が原因で,後天性門脈瘤は門脈圧亢進症,膵炎,外傷,手術操作などが原因といわれている12)13).治療は経過観察が基本とされるが,合併症を併発した場合や,急速に増大した例は治療の対象である14).門脈狭窄に伴う門脈圧亢進状態による遠肝性・求肝性の静脈瘤の報告は散見されるが,本例の門脈瘤は側副血行路の発達は認めず,門脈圧亢進状態は否定的であったうえに,圧負荷のかからない狭窄部の下流側の門脈本幹に出現していた.我々が1977年から2015年7月までの医学中央雑誌で「門脈瘤」と「門脈狭窄」を,ならびに1950年から2015年7月までのPubMedで「portal vein aneurysm」,「aneurysmal dilatation」,「pseudoaneurysm」,「anastomotic false aneurysm」をキーワードとしそれぞれ検索した結果,国内外を含めて同様の報告は,生体肝移植後の門脈狭窄について述べた江川9)の論文のみであった.症例報告としては本例が第1例目であり,極めて希少な症例と考えられる.江川9)の論文によれば,門脈拡張の本質はpost-stenotic dilatation(以下,PSDと略記)の発生と考えられている.
PSDは,例えば大動脈弁狭窄症に大動脈瘤を合併した場合など,心臓血管外科領域では比較的よく知られている.PSDの発生機序についてはさまざまな見解があるが,Roach15)は成犬14頭の大腿動脈を用いた実験から,狭窄後の乱流による不規則な圧変化が狭窄直後の血管壁のエラスチン結合の配列を変化させ,これがPSDの主要成因であるとした.また,半谷ら16)は,先天性肺動脈弁狭窄症例に対するカテーテル検査の結果から,狭窄部を通過したジェット血流(jet flow)が直接血管壁に衝突したり,渦流が誘起されたりすることによる異常な力が関係していると推測した.これらの見解に基づき門脈狭窄の場合で考えると,狭窄した門脈吻合部を通過したjet flowによって乱流が生じ,吻合部肝側の門脈が部分的に拡張する.本例では,吻合部狭窄によって顕著化した門脈のねじれ・屈曲により,jet flowの方向に角度が生じ,jet flowが門脈内腔ではなく門脈側壁に向く.門脈吻合部左縁の変形部や左胃静脈断端といった脆弱な門脈壁にjet flowが衝突し瘤を形成したと推測される.ひとたび瘤が形成されると,瘤内に生じた渦流が加わって瘤の増大が助長される.なお,動脈系におけるPSDの形成にはbruitやthrillが必要で,そのための狭窄は中等度でなくてはならず,高度狭窄例や極軽度の狭窄例ではPSDは起こらない17).本例の吻合部開存率は48%であったが,これは門脈系でのbruitやthrillの発生に適した狭窄程度だったのかもしれない.低圧系の門脈ではあるが,こうした異常血流による圧変化や局所的な圧負荷,壁の脆弱性による複合的な要因によって,吻合部門脈瘤という極めてまれな現象を来したと考えられた.
従来,良性疾患による門脈狭窄を解除する経皮的な治療には経皮経肝的血管形成術(percutaneous transluminal angioplasty;以下,PTAと略記)が施行されてきた.PTAは侵襲が低く比較的簡便であるが,狭窄の再発は28.6%と高率で,近年はメタリックステント留置を第一選択としている報告が多い2)5)18).その方法として,近年では経皮経肝門脈(percutaneous transhepatic portal vein;PTP)経路または経回結腸静脈門脈(transileocolic portal vein;TIP)経路に門脈ステントを留置する報告が増加している3)~5).メタリックステントにはcovered typeとnon-covered typeの2種類があり,開存率の点ではcovered typeが有利とされている2).しかし,本例では,SMV空腸枝の合流部が門脈狭窄部に近接し,ステント留置により腸管のうっ血を引き起こす可能性があったためnon-covered stentを選択した.ステント留置により血流異常の事端となった狭窄が解除され,門脈血流が是正された結果,瘤が縮小・消失したと考えられた.
利益相反:なし
文献
- 1) Yamashita Y, Ryo H, Takasaki K. Clinical study of transient portal vein stenosis induced after pancreatic head resection. Surg Today. 2004;34(11):925–931.
- 2) Hiyoshi M, Fujii Y, Kondo K, Imamura N, Nagano M, Ohuchida J. Stent placement for portal vein stenosis after pancreaticoduodenectomy. World J Surg. 2015;39(9):2315–2322.
- 3) 安田 祥浩, 加藤 文昭, 鈴木 芳明, 尾形 高士, 高木 眞人, 寿美 哲生,ほか.膵頭十二指腸切除術後の門脈狭窄に対し門脈内ステント留置術を行った1例.日本消化器外科学会雑誌.2006;39(12):1834–1838.
- 4) 小薗 真吾, 千々岩 一男, 大内田 次郎, 今村 直哉, 旭吉 雅秀, 大谷 和広,ほか.膵頭十二指腸切除後の門脈狭窄に伴う消化管出血に対して門脈内ステントが有効であった1例.日本消化器外科学会雑誌.2009;42(11):1711–1716.
- 5) 新村 兼康, 宇田川 郁夫, 西野 仁惠, 菊池 紀夫, 宮崎 勝.肝切除・胆管切除術後の肝外門脈閉塞による消化管出血に門脈ステント留置および側副血行路塞栓で長期生存した1例.胆道.2013;27(5):855–861.
- 6) Fujii T, Nakao A, Yamada S, Suenaga M, Hattori M, Takami H, et al. Vein resections >3 cm during pancreatectomy are associated with poor 1-year patency rates. Surgery. 2015 Apr;157(4):708–715.
- 7) Kang MJ,Jang JY,Chang YR, Jung W, Kim SW. Portal vein patency after pancreatoduodenectomy for periampullary cancer. Br J Surg. 2015 Jan;102(1):77–84.
- 8) Orlandini M, Feier FH, Jaeger B, Kieling C, Vieira SG, Zanotelli ML. Frequency of and factors associated with vascular complications after pediatric liver transplantation. J Pediatr. 2014 Mar–Apr;90(2):169–175.
- 9) 江川 裕人.生体肝移植における血行再建部の狭窄に対するIVR.日本外科学会雑誌.2004;105(6):364–368.
- 10) Doust BD, Pearce JD. Gray-scale ultrasonic properties of the normal and inflamed pancreas. Radiology. 1976 Sep;120(3):653–657.
- 11) Dognini L, Carreri AL, Moscatelli G. Aneurysm of the portal vein: ultrasound and computed tomography identification. J Clin Ultrasound. 1991 Mar–Apr;19(3):178–182.
- 12) Ohnami Y, Ishida H, Konno K, Naganuma H, Hamashima Y, Zeniya A, et al. Portal vein aneurysm: report of six cases and review of the literature. Abdom Imaging. 1997 May–Jun;22(3):281–286.
- 13) Fulcher A, Turner M. Aneurysms of the portal vein and superior mesenteric vein. Abdom Imaging. 1997 May–Jun;22(3);287–292.
- 14) Oleske A, Hines GL. Portal venous aneurysms—report of 4 cases. Ann Vasc Surg. 2010 Jul;24(5):695.e5–8.
- 15) Roach MR. Reversibility of poststenotic dilatation in the femoral arteries of dogs. Circ Res. 1970 Dec;27(6):985–993.
- 16) 半谷 静雄, 石原 昭, 菅原 基晃.Poststenotic dilatation(PSD)の成因に関する新知見.医学のあゆみ.1984;128(4):239–240.
- 17) Dobrin PB. Poststenotic dilatation. Surg Gynecol Obstet. 1991 Jun;172(6):503–508.
- 18) Shibata T, Itoh K, Kubo T, Maetani Y, Shibata T, Togashi K, et al. Percutaneous transhepatic balloon dilation of portal venous stenosis in patients with living donor liver transplantation. Radiology. 2005 Jun;235(3):1078–1083.