2016 年 49 巻 9 号 p. 842-849
2016 年 49 巻 9 号 p. 842-849
目的:膵切除術は術後合併症により重篤な状態に陥ることも少なくない.2007年に報告されたsurgical Apgar score(以下,SASと略記)は術中の出血量,最低平均血圧,最低心拍数を用いてスコアリングすることで,合併症予測に有用とされている.今回,膵切除症例の合併症予測におけるSASの妥当性を検討した.方法:2007年12月から2015年9月までの膵切除症例81例を対象とした.高,中,低リスク群に分類し,年齢,術後在院日数,膵液瘻,Clavien-Dindo分類,CRP,生存期間との相関について比較検討した.結果:Pancreaticoduodenectomy(PD)では有意差は認めず,distal pancreatectomy(DP)では中リスク群に比べて高リスク群で術後膵液瘻の頻度が高い傾向にあった(P=0.062).全81例の検討では,術後在院日数が低リスク群に比べ高リスク群で有意に長かった(P=0.042).Clavien-Dindo分類については,高リスク群でGrade II以上の合併症の頻度が高かった.術後膵液瘻において最低平均血圧が独立した危険因子であった(P=0.043,95% CI:0.90~0.99).結語:SASに応じた術後管理で在院日数を短縮できる可能性があり,術中のバイタルコントロールが重要と考えられた.
膵切除術は侵襲の大きな手術であり,術後膵液瘻や胆汁瘻,出血などの合併症により重篤な状態に陥ることも少なくない1).術後合併症の予測についてはAPACHE scoreやPOSSUMなどがあるが2)3),項目の多さや計算の複雑さから多忙な臨床現場で使用される機会は少ない.2007年にGawandeら4)は術後合併症予測の簡便な指標としてsurgical Apgar score(以下,SASと略記)を報告した.SASは術中出血量,最低平均血圧,最低心拍数の3項目のみを用いてスコアリングを行い(Table 1),そのスコアが低いほど術後合併症のリスクが高くなるといわれている.WHOもSASの使用を推奨しており,実際にさまざまな手術の術後合併症や手術関連死の予測にSASが有用であるとの報告が散見されるようになった5)~9).しかしながら,膵切除術におけるSASと合併症,特に膵液瘻との関係性を報告した論文は少ない10)11).膵切除術症例において,ある程度の精度で合併症予測が可能となれば合併症予防に繋がる可能性がある.
| 0 points | 1 points | 2 points | 3 points | 4 points | |
|---|---|---|---|---|---|
| Estimated blood loss (ml) | >1,000 | 601–1,000 | 101–600 | ≤100 | |
| Lowest mean arterial pressure (mmHg) | <40 | 40–54 | 55–69 | ≥70 | |
| Lowest heart rate (beats/min) | >85 | 76–85 | 66–75 | 56–65 | ≤55* |
* Occurrence of pathologic bradyarrhythmia, including sinus atrioventricular block or dissociation, junctional or ventricular escape rhythms, and asystole also receive 0 points for lowest heart rate.
今回,我々は自験例をもとに膵切除症例の術後合併症,特に膵液瘻の予測におけるSASの妥当性をretrospectiveに検討した.
2007年12月から2015年9月までに当院で施行した膵切除術82例のうち,麻酔管理記録を確認できた81例を対象とした.術中のバイタルや投与薬剤などはPHILIPS社のORSYS®により管理されており,バイタルについては測定値を自動的に記録として残すことが可能となっているため,その値を参照した.執刀開始から閉創までの時間における最低平均血圧および最低心拍数を拾い上げ,それぞれの症例においてGawandeら4)が報告した方法に従ってSASを算出した(Table 1).算出したSASにより高リスク群(0~4 points),中リスク群(5~6 points),低リスク群(7~10 points)に分類し,年齢,術後在院日数,膵液瘻,Clavien-Dindo分類,CRPの最大値,無再発および全生存期間との相関についてretrospectiveに比較検討した.膵液瘻はInternational Study Group of Postoperative Pancreatic Fistulaの定義に従って分類し12),膵液瘻なし/Grade AおよびGrade B/Cの2群に分けて比較した.Clavien-Dindo分類については,合併症なし/Grade Iおよび治療介入が必要なGrade II/III/IV/Vの2群に分けて比較した13).Pancreaticoduodenectomy(以下,PDと略記)症例,distal pancreatectomy(以下,DPと略記)症例を対象とし,PD症例群,DP症例群,二つを合わせたPD+DP症例群について検討した.生存期間についてはR0,R1切除を行った浸潤性膵管癌を対象とした.
統計ソフトはEZR(Saitama Medical Center, Jichi Medical University, Saitama, Japan)for MacOSを用いた14).3群間の比較にはone-way ANOVA,Kruskal-Wallis検定,Steel-Dwass多重比較試験,Fisherの正確検定,生存期間の解析にはKaplan-Meier法,Log rank法を,多変量解析にはロジスティック回帰分析を用いた.P<0.05を統計学的に有意差ありとした.
患者背景を示す(Table 2).男性38例,女性43例であり,平均年齢は67±13歳であった.疾患は浸潤性膵管癌が最も多く48例,American Society Anesthesiologists Physical Status(以下,ASA-PSと略記)はIが17例,IIが46例,IIIが18例であった.術式はPDが49例,DPが32例であり,PD症例が多かった.PDにおける膵消化管吻合は,膵管空腸粘膜吻合後に2014年までの症例では膵実質と空腸の漿膜筋層を結節縫合で吻合していたが,2015年の9症例はBlungart変法を行っていた.DPにおける膵切除および断端の処理については,9例のみ自動縫合器で処理しており,その他の症例はメスを用いて膵切離後に主膵管を二重結紮もしくはコの字縫合し,膵断端はfish mouth型に閉鎖していた.術中因子としては出血量が1,666.9±1,250.4 ml,最低平均血圧が51.4±11.8 mmHg,最低心拍数が53.5±8.9回/分であった.SASは高リスク群が19例,中リスク群が53例,低リスク群が9例であった.Clavien-Dindo分類はGrade Iが15例,IIが20例,IIIaが10例,IVaが1例であり,35例は合併症を認めなかった.術後在院日数の中央値は27日であり,術後在院死亡は認めなかった.以下より,統計学的検討の結果を示す.
| Gender | Male:Female | 38:43 |
| Age (year) | 67±13 | |
| Disease | Invasive pancreatic ductal adenocarcinoma | 48 |
| Intraductal papillary mucinous neoplasm | 9 | |
| Pancreatic neuroendocrine tumor | 5 | |
| Ampullary cancer | 4 | |
| Bile duct cancer | 1 | |
| Duodenal cancer | 2 | |
| Gallbladder cancer | 1 | |
| Mucinous cystic neoplasm | 3 | |
| Serous cystic neoplasm | 2 | |
| Others | 6 | |
| ASA-PS | I | 17 |
| II | 46 | |
| III | 18 | |
| IV | 0 | |
| V | 0 | |
| VI | 0 | |
| Operation | PD | 49 |
| DP | 32 | |
| Estimated blood loss (ml) | 1,666.9±1,250.4 | |
| Lowest mean arterial pressure (mmHg) | 51.4±11.8 | |
| Lowest heart rate (beats/min) | 53.5±8.9 | |
| SAS | 0–4 | 19 |
| 5–6 | 53 | |
| 7–10 | 9 | |
| Clavien-Dindo classification | Grade I | 15 |
| Grade II | 20 | |
| Grade IIIa | 10 | |
| Grade IIIb | 0 | |
| Grade IVa | 1 | |
| Grade IVb | 0 | |
| Grade V | 0 | |
| Hospital stay (days), median | 27 (11–164) | |
| Death | 0 |
Values are expressed as mean±SD.
PD症例の結果を示す(Table 3).年齢,術後在院日数,術後膵液瘻の発生頻度,CRPの最大値について比較したが,各項目において有意差は認めなかった.特に膵液瘻の発生頻度については各群でほとんど差を認めなかった(P=1).
| SAS | 0–4 | 5–6 | 7–10 | P value | |
| n | 14 | 32 | 3 | ||
| Age (year) | 70±10 | 67±11 | 71±4 | P=0.473 | |
| Hospital stay (days), median | 31.5 | 33.5 | 23.0 | P=0.14 | |
| Pancreatic fistula | —/A | 9 | 20 | 2 | P=1 |
| B/C | 5 | 12 | 1 | ||
| Clavien-Dindo classification | —/I | 5 | 15 | 2 | P=0.57 |
| II/III/IV/V | 9 | 17 | 1 | ||
| CRP max (mg/dl) | 19.1±7.6 | 17.9±6.4 | 14.6±7.0 | P=0.58 |
Values are expressed as mean±SD.
DP症例の結果を示す(Table 4).各項目において有意差は認めなかったが,SAS高リスク群は術後膵液瘻およびGrade II以上の合併症の発生頻度が高い傾向にあった(P=0.062).その他の項目においてもリスクが上がるにつれて術後在院日数が長く,術後CRP値も高くなる傾向があるように見受けられた.
| SAS | 0–4 | 5–6 | 7–10 | P value | |
| n | 5 | 21 | 6 | ||
| Age (year) | 60±15 | 65±18 | 67±14 | P=0.8 | |
| Hospital stay (days), median | 26.0 | 17.0 | 16.5 | P=0.171 | |
| Pancreatic fistula | —/A | 3 | 20 | 5 | P=0.062 |
| B/C | 2 | 1 | 1 | ||
| Clavien-Dindo classification | —/I | 3 | 20 | 5 | P=0.062 |
| II/III/IV/V | 2 | 1 | 1 | ||
| CRP max (mg/dl) | 20.1±6.2 | 16.3±7.8 | 15.2±6.6 | P=0.524 |
Values are expressed as mean±SD.
PDとDPを合わせた全ての症例の結果を示す(Table 5).高リスク群が低リスク群より有意に術後在院日数が長かった(P=0.042)(Fig. 1).その他の項目において有意差は認めなかったが,高リスク群でGrade II以上の合併症の発生頻度が57%であり,中リスク群(34%),低リスク群(22%)に比べて高かった(P=0.11).膵液瘻の発生についてSASの各項目(術中出血量,最低平均血圧,最低心拍数)を用いて多変量解析を行ったところ(Table 6),最低平均血圧が独立した危険因子であった(P=0.043,Odds ratio:0.95,95% CI:0.90~0.99).
| SAS | 0–4 | 5–6 | 7–10 | P value | |
| n | 19 | 53 | 9 | ||
| Age (year) | 68±12 | 66±14 | 69±11 | P=0.81 | |
| Hospital stay (days), median | 30 | 28 | 22 | P=0.042 | |
| Pancreatic fistula | —/A | 12 | 40 | 7 | P=0.519 |
| B/C | 7 | 13 | 2 | ||
| Clavien-Dindo classification | —/I | 8 | 35 | 7 | P=0.11 |
| II/III/IV/V | 11 | 18 | 2 | ||
| CRP max (mg/dl) | 19.4±7.1 | 17.3±6.9 | 15.0±6.3 | P=0.289 |
Values are expressed as mean±SD.
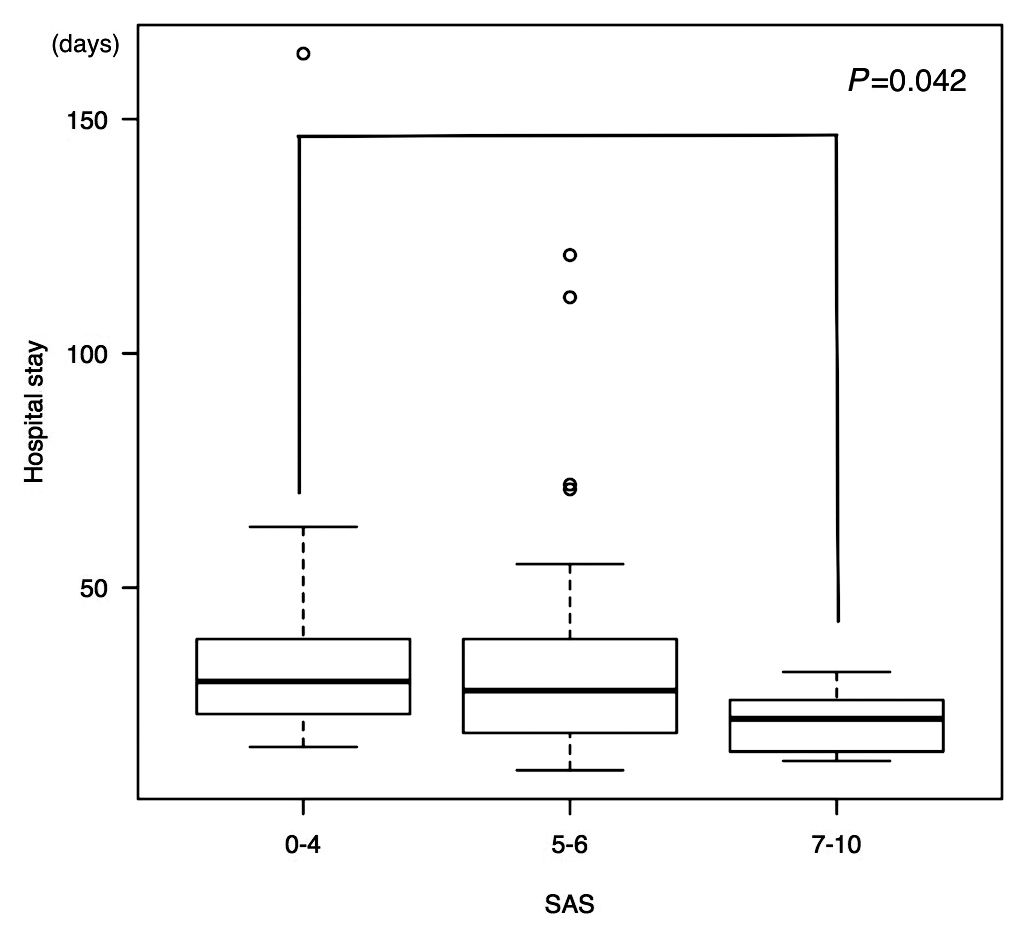
In 81 patients undergoing PD or DP, there was a significant difference between SAS 0–4 and 7–10 in hospital stay.
| Odds ratio | 95% CI* | P value | |
|---|---|---|---|
| Lower heart rate | 1.02 | 0.95–1.09 | P=0.497 |
| Lower mean arterial pressure | 0.95 | 0.90–0.99 | P=0.043 |
| Estimated blood loss | 1.00 | 1.00–1.00 | P=0.144 |
* Confidence Interval
無再発生存期間,全生存期間ともにSASのリスク分類による有意な差は認めなかった(P=0.308,P=0.572).
近年の手術手技,手術器具,術後管理の向上により手術関連死を含む術後合併症は低下傾向にある.しかしながら,消化器外科領域の手術において肝胆膵外科領域の手術は侵襲が大きく,術後に重篤な状態に陥ることもいまだ少なくない.
術後合併症予測の方法としてAPACHE scoreやPOSSUMなどが開発されたが,計算が煩雑であり手術の度にベッドサイドで使用することは難しい.このような背景の中で術中の三つの因子のみで簡便に術後合併症を予測することが可能なSASが報告された.その後,その有用性を報告する論文が増え,2009年にはWHOから発行されたWHO Guidelines for Safe Surgery 2009:Safe Surgery Saves Livesに組み込まれるに至った.
今回,当施設の症例81例を対象にして膵切除術後の合併症予測におけるSASの妥当性を検討した.過去の文献ではSASがPD術後の膵液瘻発生と関連するという報告もあり11),本検討でも膵液瘻の発生頻度に注目して検討を行った.しかしながら,SASによるリスク分類では明らかな有意差は認めず,PD症例では各群において膵液瘻の発生頻度はほぼ同じであった.この理由としては,膵液瘻の発生にはPDでの膵腸吻合やDPでの膵切離法などの手術手技,膵臓の硬度や主膵管径などの臓器要因が関わることが考えられる.ただ,今回の検討ではDP症例に限れば高リスク群で膵液瘻の頻度が高い傾向を認めた.この結果については,DPは再建の必要がなく,先に挙げた各因子(手術手技,膵硬度,主膵管径など)の影響が比較的少ないためと考えられる.実際にPD症例とDP症例で膵液瘻の発生頻度を比較した結果,PD症例で有意に膵液瘻の頻度が高かった(P=0.021)(Table 7).
| PD | DP | P value | ||
|---|---|---|---|---|
| Pancreatic fistula | —/A | 31 | 28 | P=0.021 |
| B/C | 18 | 4 |
今回の統計学的検討の結果,PD+DP症例群においてSASと術後在院日数との間に有意な関連を認めたが,SASと膵液瘻との有意な関連は示されなかった.しかしながら,合併症全体をClavien-Dindo分類を用いて比較したところ,有意差は認めなかったものの高リスク群でGrade II以上の合併症の頻度が高かった.このことよりSASが術後のさまざまな合併症も含めた全身状態の予測因子になりうることは十分に考えられ,SASに応じた術後管理を行うことで在院日数の短縮につながる可能性が示唆された.
SASによるリスク分類と浸潤性膵管癌症例の予後には有意な関連は認めなかった.これまでの報告でも予後との関連についての報告はなく,現時点ではSASはあくまでも術後急性期合併症の予測因子であり,予後を予測しうるものではないと考える.
もともとSASは多数の結腸切除症例において術前,術中因子と術後合併症の関連を統計学的に解析し,関連の強い3項目を使用してスコアリングを行っているだけである4).これまでの論文においてSASが術後合併症との有意な関連については報告されているが,その理由まではほとんど言及されていない.特に,たったone pointのバイタルの変化を拾い上げることで術後合併症の予測が可能となる点については大変興味深い.SASの項目を見てみると,出血量が多く,血圧が低下し,頻拍になるほどスコアが悪くなり(Table 1),一般的には出血性ショックの状態と考えられる.確かに術中出血量が多くなれば周術期に患者の容体が安定せず,合併症に繋がることは想像に難くない.実際にPD術後の膵液瘻のリスクファクターとして術中出血量を挙げている論文もある15).しかしながら,血圧や心拍については出血量に関係なく麻酔の影響を強く受ける場合がある.実際に本検討において最低平均血圧は,ほとんど出血していない手術開始直後に記録されている症例も多く見受けられた.これは硬膜外麻酔との関連が考えられたが,それでもSASの3項目を用いた多変量解析の結果,最低平均血圧が膵液瘻発生の独立した危険因子であった.これまでの報告を見ても術中低血圧が術後の合併症に寄与することが示唆されており,持続的な低血圧によって引き起こされる血液の低灌流状態がさまざまな臓器へ影響することが合併症発生の原因と考えられている16).術中,特に手術開始直後のone pointの血圧低下が,その後の持続的な低血圧およびそれに引き続く臓器の低灌流を引き起こすのか,その他の合併症リスクを反映しているのか,またはその両者なのかは不明である.いずれにせよ,今回の多変量解析の結果からはSASの項目の中でもone pointの血圧低下が術後膵液瘻の発生に対し比較的強い影響を及ぼしている可能性が高いと考えることができる.外科医が出血量を抑えることはいうまでもないが,出血の少ない症例においても,必要以上の昇圧剤の使用は控えるべきだが適切な麻酔管理によるバイタルコントロールも重要であると考える.近年,実際に麻酔科においてもSASの重要性が認識されつつある17).
今回,膵切除術におけるSASの妥当性について検討しSASと術後在院日数に有意な関連を認めた.これからは術後管理を行ううえで医師,看護師を含めたチーム全員でSASについて共通の認識を持つことが重要になると考える.しかしながら,本研究はretrospectiveな検討であり,サンプルサイズも小さい.そのため,診療に携わった医師の違いや患者要因による交絡因子や選択バイアス,情報バイアスを排除しきれない.SASに応じた術後管理が合併症の減少および在院日数の短縮などに寄与するのかについても含めてprospectiveな研究を行うことで,SASの有用性が解明されると考える.
利益相反:なし