2017 年 50 巻 5 号 p. 350-356
2017 年 50 巻 5 号 p. 350-356
症例は73歳の男性で,食欲不振を主訴に近医を受診し,精査で腹膜播種を伴う長径20 cmの胃粘膜下腫瘍を認めた.生検結果よりgastrointestinal stromal tumor(GIST)と診断され,imatinib mesylate(以下,imatinibと略記)の投与開始となった.腫瘍縮小効果(縮小率:45%)を認めたが,腫瘍壊死による胃内腔との瘻孔形成により治療継続困難となり,感染コントロール目的に手術となった.腫瘍は炎症により隣接臓器と強固に癒着しており,噴門側胃切除および横行結腸,膵体尾部,脾臓合併切除を施行した.また,可及的に腹膜播種切除も行った.切除検体の病理組織診断で腫瘍は消失し,病理学的完全奏効であった.術後45日目よりimatinibを再開,現在術後18か月を経過し,無再発生存中である.
Gastrointestinal stromal tumor(以下,GISTと略記)は,カハールの介在細胞由来の間葉系腫瘍1)で,食道から直腸まで消化管のいずれの部位においても発生する2).切除可能な原発GIST治療の第一選択は外科治療であるが,切除不能・転移性GISTに対しては,imatinib mesylate(以下,imatinibと略記)治療が第一に選択される3).しかし,imatinibの合併症により生命予後が危機に曝されたり,imatinibの内服ができず腫瘍の進行を招くと考えられる場合は,合併症に対する外科的治療を考慮する必要がある3).今回,imatinib投与中に腫瘍壊死部の膿瘍形成により化学療法継続困難となり,感染コントロール目的に原発巣切除した腹膜播種を伴う巨大胃GISTの1例を経験したので報告する.
患者:73歳,男性
主訴:食欲不振
既往歴:胆石症(胆囊切除後),右鼠径ヘルニア(根治術後),高血圧,糖尿病
現病歴:2013年12月より食欲不振を認め,翌2014年1月に近医を受診し,胃粘膜下腫瘍を指摘され,精査目的に当院を紹介された.
初診時現症:身長162 cm,体重80 kg,血圧132/79 mmHg,脈拍66回/分 整,体温36.3°C,眼瞼結膜は蒼白であり,左上腹部に弾性硬な腫瘤を触知した.
血液生化学検査所見:ヘモグロビン(Hb)8.8 g/dlの低下を認めた.
上部消化管内視鏡検査所見:胃体上部に胃粘膜下腫瘍を認め,粘膜の一部は自潰し,潰瘍形成を認めた(Fig. 1).
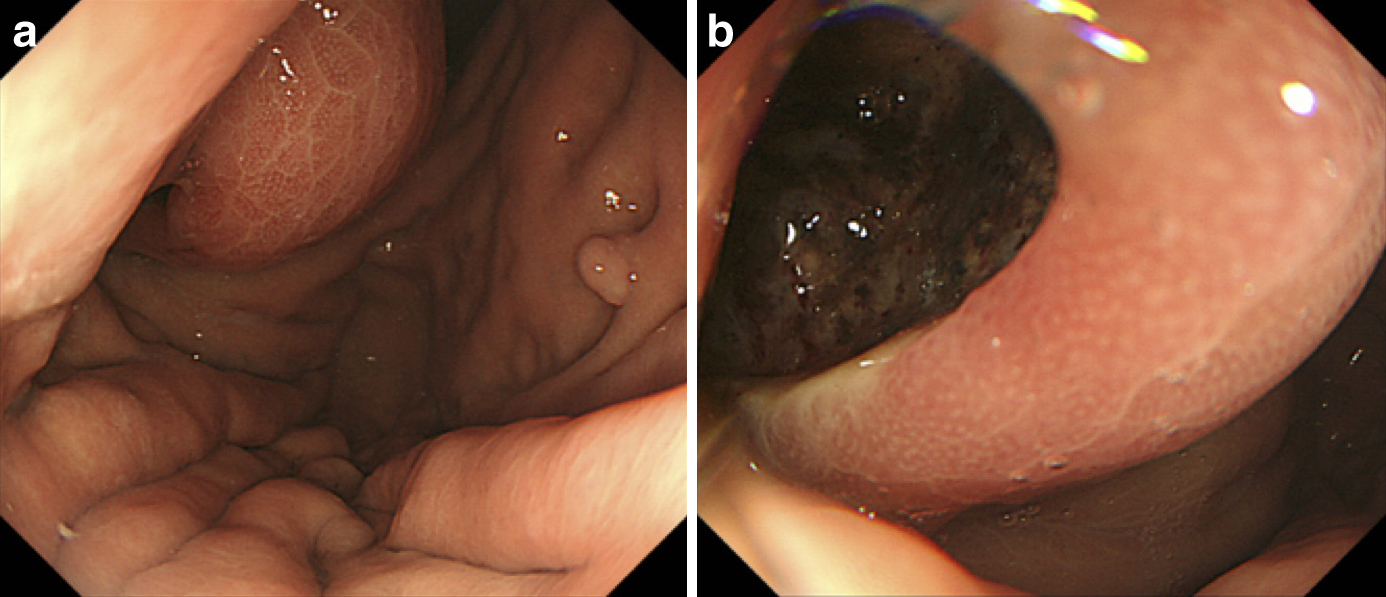
Esophagogastroduodenoscopy shows a huge submucosal tumor with ulceration in the upper posterior wall of the stomach.
内視鏡下生検病理組織学的検査所見:核の濃染と腫大を示す紡錘形細胞の増殖を認め,核分裂像は4個/50HPFであった.免染組織化学染色検査では,CD34,c-kit陽性を示し,胃原発GISTと診断された(Fig. 2).
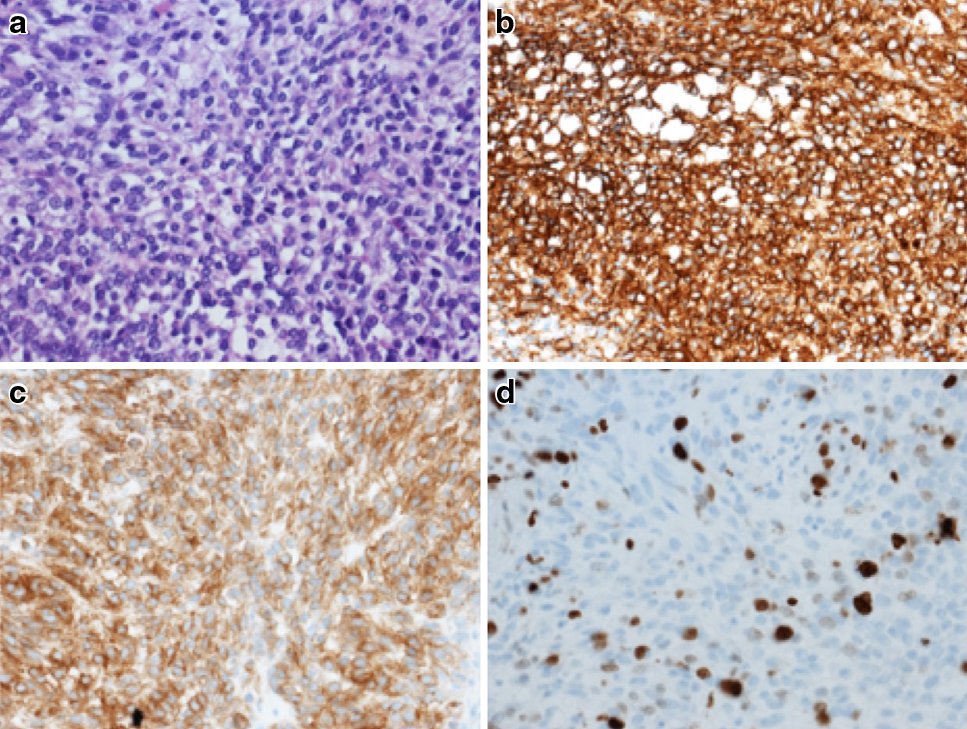
Histopathologic assessment of endoscopic biopsy reveals proliferated spindle cells in HE staining (a), which were positive for CD34 (b) and c-kit (c) in immunohistochemistry examination. The Ki-67 labeling index was 10% (d).
腹部造影CT所見:胃体上部大彎より連続した最長径20 cmの腫瘤を認めた(Fig. 3a).また,大網に腹膜播種を疑う腫瘤を認めた(Fig. 3b).その他,膀胱直腸窩にも腹膜播種を疑う腫瘤を認めた.
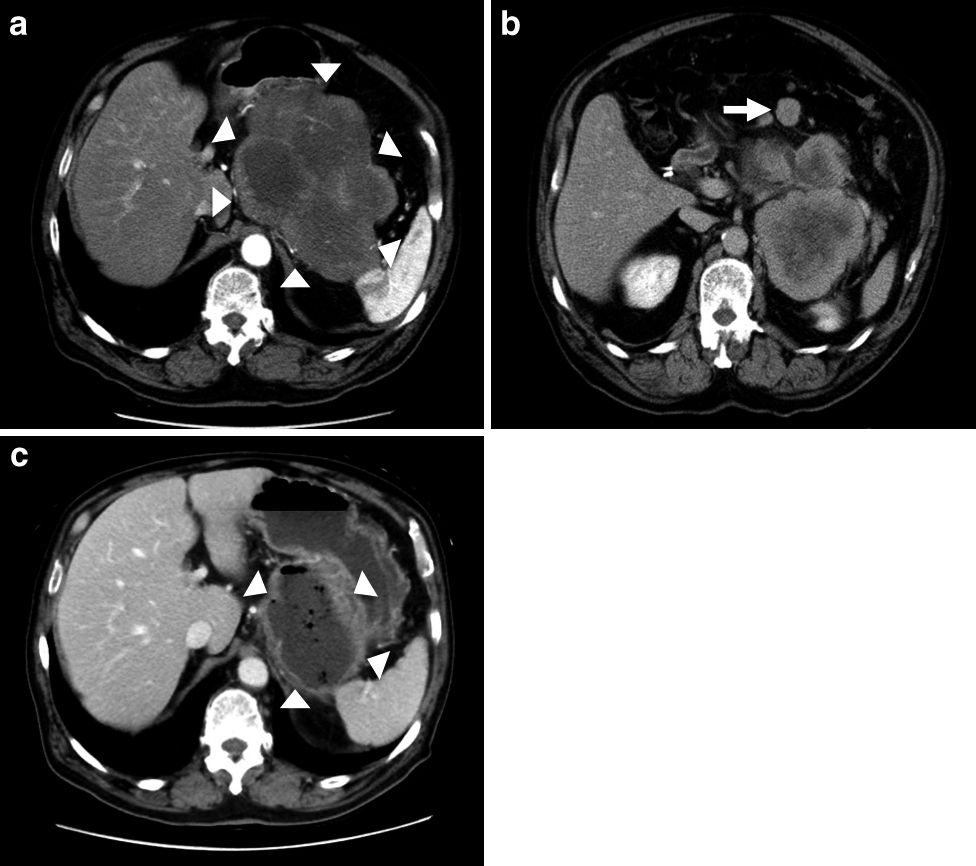
a: A huge tumor 20 cm in diameter in the left upper abdomen derives from the stomach on abdominal CT (arrowheads). b: The abdominal CT shows a suspected disseminated tumor in the greater omentum (arrow). c: The abdominal CT shows shrinkage of the gastric GIST to 11 cm in diameter. Small air bubbles suspicious for abscess formation were observed (arrowheads).
治療経過:腹膜播種を伴った胃GISTと診断し,imatinib(400 mg/day)治療を開始した.治療開始1か月後に発熱性好中球減少症を認め,一時休薬となった.1か月後にimatinib治療を再開するも,発熱および炎症反応の悪化(CRP 22 mg/dl)を認めたため,再度中止し,精査を行った.
腹部造影CT所見:胃腫瘤は最長径11 cmまで縮小を認めた(縮小率:45%).しかし,腫瘤内部にairを認め,腫瘍と胃内腔との瘻孔形成が疑われた(Fig. 3c).
以上の所見より,腫瘍壊死部への感染による膿瘍形成と診断し,imatinib治療継続が困難なため,感染コントロール目的に外科治療の方針となった.
術中所見:腫瘍径が大きく,周辺組織との高度癒着が予想されたため,開腹手術を施行した.腫瘍は横行結腸および膵体尾部,脾臓と強固に癒着しており,周囲臓器との剥離はできなかった.噴門側胃切除および横行結腸,膵体尾部,脾臓合併切除を施行した.また,膀胱直腸窩および大網に腹膜播種病変を疑う白色結節を認め,肉眼的に全て切除した(R0).
切除標本病理組織学的検査所見:胃粘膜下に白色調の充実性病変(82×35 mm)を認めた.病変内部は大きな空洞を形成しており,空洞は胃粘膜を超えて胃内と交通を認めた.病変のほとんどは硝子様間質の増生からなり,それに混在する形で紡錘形細胞の増生を認めた.紡錘形細胞は,c-kit(−),desmin(+),SMA(+)であることから,腫瘍細胞ではなく繊維芽細胞であると考えられた.標本上では,治療前生検で採取した腫瘍細胞と類似する細胞像を認めず,病理学的には化学療法の治療効果判定はGrade 3であった.また,合併切除臓器に浸潤および転移を疑う所見はなく,腹膜播種結節にも腫瘍細胞を認めなかった(Fig. 4).
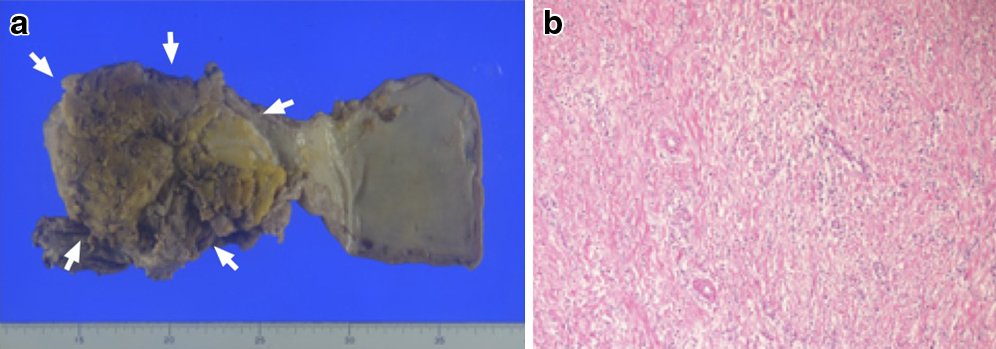
a: A huge gastric GIST (82×35 mm) with a cavity formation (arrows). The tumor strongly adhered to distal pancreas. b: Microscopic findings of resected specimen reveal that the tumor was completely replaced by fiber cells and necrotic tissue. There was no viable GIST cells in the specimen (HE staining, ×20).
術後経過:術後8日目に発熱および炎症反応の悪化を認め,CTで左横隔膜下に腹腔内膿瘍を認めた.超音波ガイド下経皮的膿瘍ドレナージと抗菌薬加療にて軽快した.術後45日目よりimatinib(400 mg/day)治療を再開し,術後73日目に退院となった.現在術後18か月を経過しており,imatinib内服継続中,再発を認めていない.
GISTはまれな疾患であり,その症状は腫瘍径と発生部位と関係しており,腫瘍径が大きくなるまで発見されないこともある.本邦では胃癌検診が普及しているため,腫瘍径が小さく,無症状で発見されることが多く,根治的切除により良好な治療成績を示している4).一方,転移性GISTの場合,仮に転移巣が切除可能であったとしても,全身病の観点から外科手術単独治療は有効とはいえない5).本症例は腹膜播種を伴う胃GISTと診断され,GIST診療ガイドライン3)に基づき,imatinib(400 mg/day)治療を開始した.Imatinib投与開始後4週間の時点で腫瘍縮小効果を認めたが,発熱性好中球減少症により投与を一時中止した.Imatinib治療を再開したが,腫瘍壊死巣への感染により膿瘍を形成していたため,imatinib治療の継続は困難と判断し,手術の方針に至った.
Imatinibの有害事象は95%以上に起こり,浮腫・嘔気・下痢・筋肉痛・倦怠感・皮膚炎などがよくみられると報告されている6).切除不能GIST 147例に対するimatinib治療(400,600 mg/day)の検討では,腫瘍出血を4.8%,消化管出血や消化管穿孔を2.7%で認めている7).医学中央雑誌で1977年から2015年1月の期間で「GIST」,「imatinib」,「手術」をキーワードとして検索したところ(会議録を除く),本邦においてimatinib治療中に外科治療を要した有害事象の症例報告を5例8)~11)認めた.穿孔性腹膜炎または出血を理由に外科治療介入を行った症例をそれぞれ2例認め,本症例と同様に腫瘍内部と胃内腔が交通し,外科治療を要した症例を1例認めた.原発巣または再発/転移巣を切除した症例は本症例を含め4例認め,4例ともに術後よりimatinib治療を再開し,13か月以上の生存を認めた(Table 1)8)~11).
| Case No. | Author | Year | Age | Sex | Location of primary tumor | Site of metastasis | Reason of surgery | Surgical procedure | Residual tumor | Survival time after surgery |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Terada8) | 2004 | 72 | Female | Stomach | Liver/peritoneum | Perforative peritonitis | Primary closure/omental implantation repair | R2 | not listed |
| 2 | Kurita9) | 2009 | 50s | Male | Stomach | Peritoneum | Abscess formation | Total gastrectomy/resection of peritoneum dissemination | R2 | Alive at 13 months |
| 3 | Inagawa10) | 2014 | 81 | Female | Stomach | Liver | Perforative peritonitis | Drain placement | R2 | 7 months |
| 4 | Endo11) | 2014 | 18 | Female | Stomach | Peritoneum | Bleeding | Partial gastrectomy/resection of peritoneum dissemination | R0 | Alive at 29 months |
| 5 | Endo11) | 2014 | 36 | Female | Stomach | Liver/peritoneum/lymph nodes | Bleeding | Distal gastrectomy/resection of peritoneum dissemination | R0 | Alive at 40 months |
| 6 | Our case | 73 | Male | Stomach | Peritoneum | Abscess formation | Proximal gastrectomy/partial resection of transverse colon/distal pancreatectomy/splenectomy/resection of peritoneum dissemination | R0 | Alive at 18 months |
今回,切除不能GISTに対してimatinib治療中の感染コントロール目的に腹膜播種を含めた病巣切除を行った.現時点で切除不能GIST症例に対するimatinib治療中の外科的治療の予後延長効果は示されていない12)13).一方で,Rautら14)はimatinib治療中の切除不能/転移GISTにおいて,病変が不変または局所進行状態であれば,減量手術により全生存期間が延長したと報告している.また,Bauerら15)は,遠隔転移を伴うGISTに対して,転移巣を含めた肉眼的根治切除が生存期間の延長に繋がる可能性があると報告している.本症例では,腹膜播種病変が肉眼的に限局しており,根治切除が可能と判断したため,腹膜播種病変も含めた根治切除を行った.切除不能GISTに対してimatinib治療が第一選択であるが,感染や出血により治療継続が困難な場合や,imatinib治療で奏効が期待できない場合は,外科治療介入が有効と考える.
本症例は,腹膜播種を有するGISTであったが,imatinib投与後手術で肉眼的残存病変はなく,切除標本病理組織学的所見でもimatinibによる病理学的完全奏効を認めた.また,手術により原発巣を切除したため,感染以外の副作用コントロールは可能であり,imatinibの継続投与が可能であった.再発高リスクGIST切除症例に対する3年間の術後補助化学療法の有効性は示されており16),本症例においても血行性転移や腹膜播種再発のリスクを考慮し,imatinib(400 mg/day)治療を再開した.今後3年間の治療継続は必要と考えるが,それ以降に関しての明確なコンセンサスは得られていない.BFR14試験で,imatinib治療で3年間病勢コントロールを維持していたGISTに対するimatinib治療中断の影響を検討しており,中断で再発するが,その後imatinibを再開することで,継続していた症例と比較し,全生存期間に差を認めなかったと報告している17).一方で,Blayら18)は,imatinib治療開始後12か月以上を経過した切除不能・転移性GISTを対象にimatinib継続群と中断群の2群に分け,約8か月間観察した結果,継続群で死亡例および進行例を認めなかった一方で,中断群では進行例を認めたと報告している.また,GIST診療ガイドライン3)でも,imatinib治療により奏効が得られた場合(完全奏効であっても),明らかな進行もしくは耐用不可となるまではimatinib治療を継続することを推奨しており,再発病変の出現や副作用により継続困難とならないかぎり,術後補助化学療法開始3年以降も治療継続の方針である.
腹膜播種を伴う巨大胃GISTに対するimatinib治療中に腫瘍壊死を来し,感染制御目的に切除を行った1例を経験したので報告した.
利益相反:なし