2020 年 53 巻 10 号 p. 784-791
2020 年 53 巻 10 号 p. 784-791
膵神経内分泌腫瘍(pancreatic neuroendocrine tumor;以下,pNETと略記)の多発肝転移に対してスニチニブ投与中に肝転移破裂による腹腔内出血を来した1例を報告する.患者は78歳の女性で,8年前に膵体尾部脾切除術を施行し,pNET G2と診断された.術後2年3か月後に多発肝転移が出現し,エベロリムスと肝動脈化学塞栓療法計10回併用を3年間施行したが,肝外病変が出現したためスニチニブを開始した.2か月後の造影CTで肝転移巣は多血性から乏血性に変化したが,その16日後に肝転移巣の腫瘍破裂による出血性ショックを来し,緊急動脈塞栓術にて救命した.その後,ストレプトゾシンを開始継続し,腫瘍は著明に縮小し,PRを維持して初回手術後8年7か月生存中である.pNETの肝転移に対するスニチニブ投与中に腫瘍が多血性から乏血性に変化した際には,腫瘍破裂の可能性を考慮するべきと考えられた.
We report a case of intraperitoneal hemorrhage due to rupture of liver metastases from a pancreatic neuroendocrine tumor (pNET) during administration of sunitinib. The patient was a 78-year-old woman who had undergone distal pancreatectomy 8 years ago and was subsequently diagnosed with pNET G2. Two years and 3 months after surgery, multiple liver metastases appeared, and she was treated with everolimus with a total of 10 transcatheter arterial chemoembolizations over 3 years. Since extrahepatic lesions appeared, treatment with sunitinib was initiated. Two months after the treatment started, dynamic CT showed multiple metastatic liver tumors exhibiting low-level enhanced hypovascular change. Sixteen days later, she was transported to emergency with hemorrhagic shock due to rupture of the liver metastatic tumors, and was immediately saved by emergency transcatheter arterial embolization. She was subsequently treated with streptozocin, and dynamic CT showed that the metastatic liver tumors shrunk remarkably at 4 months after the initiation of treatment and the partial response continued for 2 years. She was alive 8 years and 7 months after the first surgery. The possibility of rupture of liver metastases from pNET should be considered when dynamic CT shows that lesions exhibit lowly enhanced hypovascular changes during the administration of sunitinib.
膵神経内分泌腫瘍(pancreatic neuroendocrine tumor;以下,pNETと略記)は神経内分泌細胞由来の腫瘍であり,膵腫瘍全体の1~2%と比較的まれな腫瘍であるが,疾患の認識が普及したこと,診断技術の向上したことにより,近年,患者数は増加傾向にある1)2).
pNETの肝転移は50~80%の頻度で認められ,多発性転移が多い傾向にあり,最も重要な予後因子の一つである.肝転移例に対する治療として,切除可能である場合は肝切除,切除不可能である場合は全身化学療法,分子標的治療薬に加え,ラジオ波凝固療法(radiofrequency ablation;以下,RFAと略記)や肝動脈化学塞栓療法(transcatheter arterial chemoembolization;以下,TACEと略記)が推奨される3)4).
今回,我々は極めてまれなスニチニブ投与中のpNETの肝転移巣の腫瘍破裂による腹腔内出血を来したが,緊急動脈塞栓術にて救命し,その後の薬物治療にて長期生存が得られている1例を経験したので,文献的考察を加え報告する.
患者:78歳,女性
主訴:腹痛
既往歴:2005年,胆囊ポリープに対して,腹腔鏡下胆囊摘出術を施行した.
家族歴:特記すべき事項なし.
現病歴:2010年9月,膵尾部の非機能性pNETに対し膵体尾部脾切除術を施行した(Fig. 1).病理診断はwell differentiated neuroendocrine tumor,Pt,TS4(70 mm),pT3(pRP1,pPVsp1),pPCM0,pDPM0,pN0(0/35),核分裂像8(/10HPT),Ki-67指数4.5%であり,2017年のWHO分類ではpNET G2であった5).

Abdominal dynamic CT showed a highly enhanced pancreatic tumor in the early phase, 51 mm in diameter in the pancreas tail (arrow).
2012年12月,多発肝転移が出現したため(Fig. 2),エベロリムス10 mg/dayの内服を開始したが,2015年に間質性肺炎が出現したため中止した.2013年10月からエベロリムスに併用してTACEを2016年10月まで3年にわたって3~6か月毎に計10回施行した.
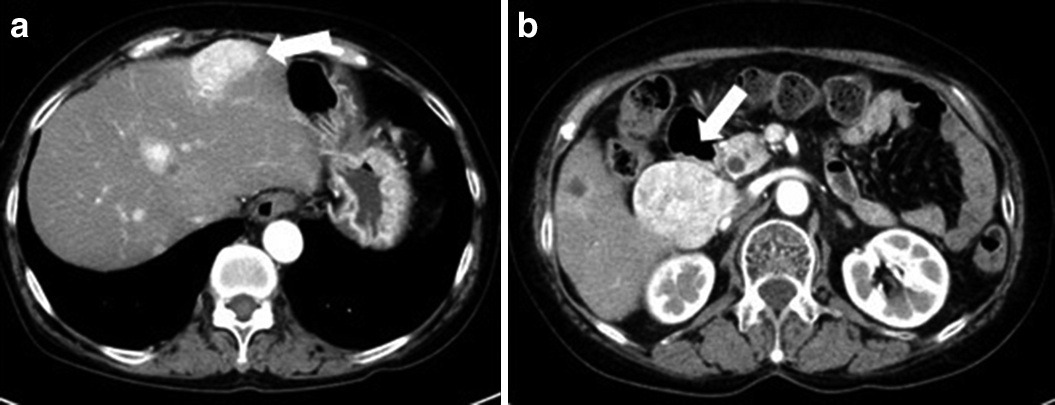
Abdominal dynamic CT showed highly-enhanced multiple metastatic liver tumors in the early phase (arrows) (a, b).
2016年11月,CTにて左胃動脈,腹部大動脈周囲リンパ節転移が出現したため,2017年3月からスニチニブ25 mg/dayの内服を開始した.2017年5月,内服開始後2か月の腹部造影CTにて,多発肝転移出現時より指摘されていた約20か所の肝転移巣は大きさや個数に変化を認めなかったが,腫瘍の早期濃染像が多血性から乏血性に変化しており治療効果ありと判断した(Fig. 3).CTから16日後に,外出先で腹痛,気分不良,嘔気にて動けなくなり,ショック状態となって当院へ救急搬送された.
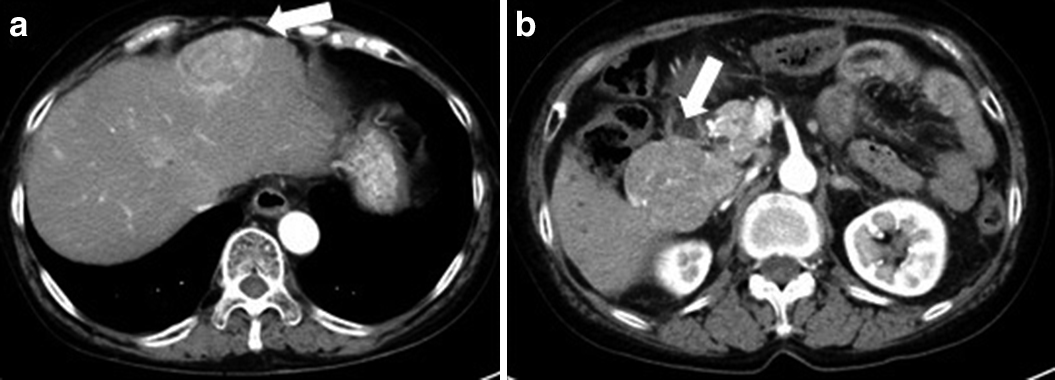
Abdominal dynamic CT showed that multiple metastatic liver tumors did not change in size but exhibited lowly enhanced changes in the early phase (arrows) (a, b).
入院時現症:身長154 cm,体重55.1 kg,体温34.9°C,血圧79/59 mmHg,脈拍71回/分,右上腹部に強い自発痛あり,同部位に圧痛を認めた.
入院時血液検査所見:WBC 31×102/μl,RBC 189×104/μl,Hgb 6.5 g/dl,PLT 4.6×104/μl,AST 45 U/l,ALT 24 U/l,ALP 409 U/l,γ-GTP 125 U/l,Alb 2.1 g/dl
腹部造影CT所見:上腹部を中心に多量の血性腹水を認めた.肝門部~左葉外側区域にかけて顕著な造影剤の血管外漏出像を認め,肝右葉S6内側の6.2 cm大の転移巣は3.7 cm大に縮小し,内部の造影効果がなく壊死を示唆する所見を呈していた(Fig. 4).

Abdominal dynamic CT showed abundant bloody ascites in the upper abdomen and extravasation ranging from the hepatoduodenal ligament to beneath the lateral segment of the liver (arrows) (a, b). The metastatic liver tumor in S6 segment became necrotic and shrunk (arrowheads) (c, d).
以上より,肝S6転移巣の腫瘍破裂による腹腔内出血と診断し,緊急腹部血管造影を行った.
腹部血管造影検査所見:腹腔動脈造影では,複数回TACEの影響で右肝動脈は狭小化し,胃十二指腸動脈から肝右葉への側副血行路が発達していたが,同部位に明らかな血管外漏出像を認めなかった.右腎動脈造影を行ったところ,右腎動脈本幹近位部から頭側へ分岐する右腎被膜動脈の末梢に血管外漏出像を認めた.同部位が腫瘍破裂の責任血管と判断し,ブチルシアノアクリレートとリピオドールの混合液およびコイル2本を用いて塞栓を行った.塞栓後,右腎動脈造影にて造影剤の血管外漏出像が消失したことを確認した(Fig. 5).

Abdominal angiography showed extravasation from the periphery of the right renal capsular artery (arrow) (a). The extravasation disappeared immediately after embolization of the artery using coils and embolic materials (arrowhead) (b).
治療経過:腹腔内に残存した血腫に対して計2回の経皮的ドレナージを施行した後,動脈塞栓術後36日目に退院した.
2017年8月,ソマトスタチン受容体シンチグラフィで多発肝転移と膵周囲や胃小彎リンパ節に集積を認めたことと,膵切除標本の免疫染色検査でSSTR2Aが陽性であったことより,ランレオチド120 mg/月の投与を開始した.2018年1月の腹部造影CTにて早期濃染する多発肝転移巣の増大を認めたため(Fig. 6),3月からストレプトゾシン1,000 mg/m2の1週間間隔投与を開始した.2018年7月の腹部造影CTにて多発肝転移巣は著明に縮小し,RECIST効果判定PRと診断した(Fig. 7).現在,ストレプトゾシンを計55回投与継続しており,初回手術後8年7か月,肝転移破裂後1年11か月,肝転移巣は縮小を維持して生存中である.

Abdominal dynamic CT showed multiple, huge metastatic liver tumors that were markedly enhanced in the early phase 8 months after the arterial embolization (arrows) (a, b).
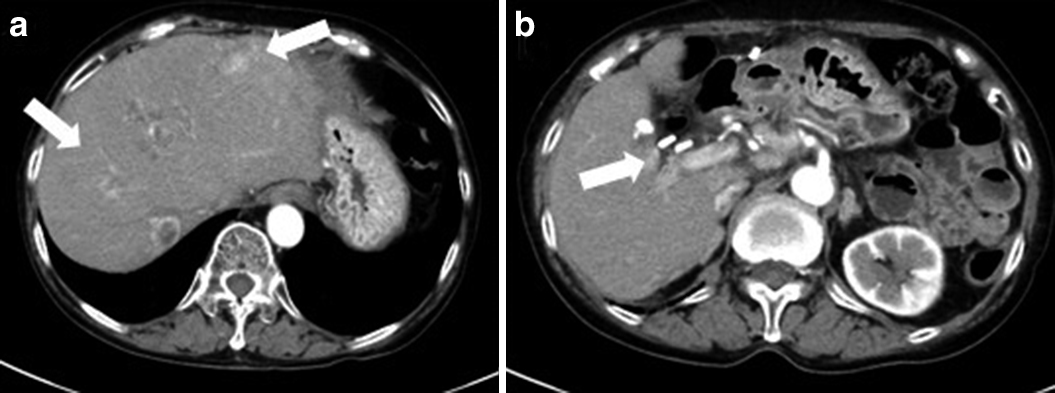
Abdominal dynamic CT showed that the multiple metastatic liver tumors shrunk remarkably at 4 months after the start of administration of streptozocin (arrows) (a, b).
pNETの治療の第一選択は外科的切除であり,遠隔転移や再発病変に対しても完全切除が可能な場合は外科的切除が推奨されている.一方,切除不能例に対しては,ソマトスタチンアナログ,エベロリムスやスニチニブといった分子標的治療薬,ストレプトゾシンなどの細胞障害性抗癌剤に加え,TACEやRFAなどの局所療法を組み合わせた集学的治療が推奨されている.pNETの転移様式は肝転移が最も多く50~80%と報告されている4).外科的切除の適応となる病変は,European Neuroendocrine Tumor Society(ENETS)のガイドラインによると,肝転移の拡がりによってsimple pattern(片葉または限局),complex pattern(両葉),diffuse patternの三つに分け,simple patternとcomplex patternの一部を手術適応としている6).pNET肝転移における切除例の5年生存率は68%と,非切除例の27%より良好と報告されている4).また,切除例とTACE例の比較においても5年生存率はそれぞれ71%,31%と切除例で良好と報告されており,pNET肝転移に対しては切除可能であれば肝切除が第一選択となる.しかし,多くの症例はびまん性多発例であり,切除対象となるのは10~25%に留まるとされる.また,切除後の再発率も高く,5年以内に80%が再発するとの報告もあり7),肝切除術後のフォローアップと再発後の治療が重要である.
本症例は非機能性pNET原発巣切除後,多発肝転移再発を来し,その薬物治療中に腫瘍破裂を来した症例であるが,腫瘍破裂を来した理由として,本来,動脈支配の多血性腫瘍がスニチニブによる抗腫瘍効果で乏血性腫瘍に変化し,壊死による腫瘍崩壊から責任動脈が破綻したと考えられる.右腎被膜動脈から出血を来した理由は,TACEをこれまで10回施行しているため,右肝動脈が狭小化して右腎被膜動脈から側副血行路が発達してS6肝転移巣の支配血管となっていたためと考えられる.医学中央雑誌にて「膵神経内分泌腫瘍」,「腹腔内出血(または腹腔内破裂)」をキーワードに1964年から2018年11月の論文報告(会議録除く)を,PubMedにて「pancreatic neuroendocrine tumor(またはislet cell tumor)」,「hemorrhage(またはrupture)」をキーワードに1950年から2018年11月の論文報告(会議録除く)を検索した結果,pNETの破裂例は自験例を含めて7例であった(Table 1)8)~13).本症例と同様のpNET転移巣の破裂は1例報告されており,この症例もスニチニブ投与中の破裂であった.他の5例は膵原発巣の破裂であり,非機能性pNETは腫瘍が大きくなるまで無症状であることが多く,5例においては腫瘍径が60 mm以上と大きく,内4例は腫瘍の増大により自然破裂に至り,1例は軽微な衝撃により破裂に至ったと考えられた.スニチニブは血管内皮増殖因子受容体(vascular endotherial growth factor receptor;VEGFR)-1,2,3,血小板由来増殖因子受容体(platelet derived growth factor receptor;PDGFR)-α, βおよびKIT蛋白などを阻害するマルチターゲットなチロシンキナーゼ阻害薬である14).消化管間質腫瘍(gastrointestinal stromal tumor;以下,GISTと略記),腎細胞癌,pNETの治療に適応となっており,腎細胞癌やGISTにおいてスニチニブ投与中に腫瘍破裂を来した症例が報告されている15)16).腫瘍破裂の原因としてはスニチニブの抗腫瘍効果による腫瘍の自壊が要因の一つと考えられている.pNETに対するスニチニブ投与中の腫瘍破裂は非常にまれであるが,GISTではスニチニブ投与中に抗腫瘍効果により多血性腫瘍が乏血性腫瘍に変化した際には,腫瘍破裂が起こる可能性が高いことが報告されている17).腫瘍側の因子として,肝細胞癌では,腫瘍径が5 cmを超え,肝表面に突出したものは,腫瘍破裂のリスクが高いとされており18)19),そのような症例には集学的治療の一環としてTACEを外科的切除に先行することが推奨されている20).本症例のようにpNET肝転移巣の腫瘍径が5 cmを超え,肝表面に突出しており,スニチニブにより乏血性腫瘍に変化した場合は,集学的治療の一環としてTACEを併用することを考慮すべきであると考えられた.
| Case | Author | Year | Age/Sex | Histology | Size (mm) | Site | Pretreatment | Intervention | Outcome |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Saltzstein8) | 1981 | 19/F | Islet cell tumor | 75 | Pancreas tail | None | Distal pancreatectomy | N/A |
| 2 | McPherson9) | 1989 | 45/M | Islet cell tumor | 100 | Pancreas head | None | Ligation | 24m alive |
| 3 | Kohno10) | 1994 | 57/F | Islet cell carcinoma | 78 | Pancreas tail | None | Distal pancreatectomy | 17m alive |
| 4 | Ideguchi11) | 2001 | 44/M | Islet cell carcinoma | 60 | Pancreas body | None | Distal pancreatectomy | 77m alive |
| 5 | Zugazagoitia12) | 2012 | 48/F | NET G2 | N/A | Retroperitoneum | Sunitinib | Conservative therapy | N/A |
| 6 | Tsuda13) | 2013 | 62/F | NET G2 | 90 | Pancreas tail | None | Distal pancreatectomy | 48m died |
| 7 | Our case | 77/F | NET G2 | 54 | Liver | Sunitinib | TAE | 23m alive |
N/A: not available
本症例は多発肝転移出現後,TACEを併用しながら,エベロリムスの投与を間質性肺炎が発症するまで,約3年間にわたって継続した.スニチニブは投与開始後約3か月で腫瘍破裂を来したため短期投与となり,ランレオチドは膵切除標本のSSTR2A免疫染色検査とソマトスタチン受容体シンチグラフィの結果からその有効性が期待されたが,効果を認めなかった.最終的にストレプトゾシンの1週間間隔投与が著明な腫瘍縮小効果を示し,PRが8か月継続している.ストレプトゾシンは膵ランゲルハンス島を選択的に破壊する作用を有するアルキル化剤系の殺細胞性抗癌剤であり,pNETに対する化学療法として,1992年にドキソルビシン+ストレプトゾシンvs. 5-FU+ストレプトゾシンvs.クロロゾトシンの比較試験が行われ,ドキソルビシン+ストレプトゾシン群が奏効率,無増悪生存期間ともに有意に良好であることが報告され21),欧米ではストレプトゾシンをメインとしたレジメンが標準治療となっている.本邦においては,ストレプトゾシン単剤の国内第I/II相試験が行われ,有効性と安全性が評価され,2014年9月に保険適応となった.ソマトスタチンアナログや分子標的治療薬は,腫瘍縮小効果は高くはないが,有意な無増悪生存期間の延長が報告されている.一方で,ストレプトゾシンは腫瘍縮小効果が高いことが特徴であり,腫瘍量が多く,増殖速度が早い症例が良い適応と考えられている22).Ki-67指数が5%を超える症例ではよりストレプトゾシンが奏効したとする報告例があり,増殖速度の指標としてはKi-67指数が有用であると考えられる23).原発巣と遠隔転移巣のKi-67指数を比較した研究によると,肝転移巣でKi-67指数がより高値であることが報告されており24),本症例においても,肝転移巣のKi-67指数が原発巣のKi-67指数の4.5%を上回っていた可能性が考えられる.pNETに対する薬物治療では,どの薬剤が効果を示すかを正確に予想するのは困難であり,進行多発病変でも長期に著効する可能性を念頭に,あきらめずに全ての薬剤を使いきることが長期生存を得るために重要と考えられた.
利益相反:なし