2020 年 53 巻 4 号 p. 371-379
2020 年 53 巻 4 号 p. 371-379
症例は42歳の男性で,検診の上部消化管内視鏡検査にて,胃幽門前部に30 mm大の内腔型粘膜下腫瘍を指摘された.腹部造影CT,MRIで腫瘤内に多房性囊胞を伴うことから,異所性膵に発生した膵管内乳頭粘液性腫瘍(intraductal papillary mucinous neoplasm;以下,IPMNと略記)または仮性囊胞と診断し,手術適応と判断した.腫瘤から幽門輪まで5 mmと近接し,局所切除では幽門温存が困難であるため,幽門機能温存を目的に経皮的内視鏡下胃内手術(percutaneous endoscopic intragastric surgery;以下,PEIGSと略記)を施行した.病理組織学的には膵組織とその内部に複数の拡張膵管と幽門腺様構造を認め,異所性膵に併発した胃型IPMNと診断された.胃の異所性膵は比較的高頻度に異形成やIPMN,PanINなどを伴うという報告もあり,囊胞性変化を伴う場合には切除適応が考慮される.また,本症例のように幽門に近接した胃内腔型粘膜下腫瘍に対して幽門温存の観点からPEIGSは有用な術式と考えられる.
We report a case of intraductal papillary mucinous neoplasm (IPMN) arising in the heterotopic pancreas of the stomach which was successfully removed by percutaneous endoscopic intragastric surgery (PEIGS). A 42-year-old man was given a diagnosis of gastric submucosal tumor (SMT) during a medical check-up. Abdominal CT scan and MRI imaging revealed a multicystic lesion in the tumor mass which was diagnosed as heterotopic pancreas with cystic component (IPMN or pseudocyst). The tumor was located in the antrum of the stomach and adjacent to the pyloric ring; therefore, we selected PEIGS as a surgical procedure to preserve gastric function for clinically benign tumor treatment. Pathological examination revealed multiple dilated pancreatic ducts with pyloric gland-like structures in the heterotopic pancreatic tissues. Based on pathological findings, the tumor was finally diagnosed as heterotopic pancreas with gastric type IPMN. We considered PEIGS as a suitable procedure for the intraluminal SMT adjacent to the pyloric ring for its functional preservation.
異所性膵は解剖学的に膵臓と連続性のない部位に生じる膵組織と定義され胃,十二指腸に好発1)し,胃では粘膜下腫瘍(submucosal tumor;以下,SMTと略記)の形態を呈することが多い.異所性膵の診断が術前に確定すれば良性疾患のため切除は必ずしも必要はないが,異所性膵の癌化2)や膵管内乳頭粘液性腫瘍(intraductal papillary mucinous neoplasm;以下,IPMNと略記)3)~12)が発生することがあり,それらが疑われる場合には外科的切除が考慮される.今回,我々は幽門輪に近接した胃異所性膵IPMNに対して経皮的内視鏡下胃内手術(percutaneous endoscopic intragastric surgery;以下,PEIGSと略記)により幽門機能温存をしえた1例を経験したので報告する.
患者:42歳,男性
主訴:なし.
既往歴:特記事項なし.
現病歴:検診の上部消化管内視鏡検査にて,胃粘膜下腫瘍を指摘され当院紹介となった.
初診時現症:身長170 cm,体重65.4 kg.腹部は平坦・軟,圧痛なし.腫瘤は触知しなかった.
初診時検査所見:血算生化学に異常所見は認めず,腫瘍マーカーはCEA 1.8 ng/ml,CA19-9 2.5 U/ml,DUPAN-2 25 U/ml,Span-1 6 U/mlといずれも基準値内であった.
上部消化管内視鏡検査所見:胃角部から前庭部小彎にかけて径30 mm大のbridging foldを伴うなだらかなSMTを認め,肛側縁は幽門まで5 mmと近接していた(Fig. 1a).頂部に陥凹面を認めたが明らかな粘膜開口部は認めず,粘膜側からの生検はGroup 1で腫瘍成分は採取できなかった.

a: Gastrointestinal endoscopy showed a 30-mm submucosal tumor in the lesser curvature of the antrum, adjacent to the pyloric ring (arrow). b: Endoscopic US showed a multicystic lesion located in the submucosal layer. c: Abdominal CT revealed a 30-mm multicystic tumor mass with cystic wall enhancement. d: T2 weighted MRI showed high intensity fluid contents in the cyst, but no mural nodule was detected.
超音波内視鏡検査(endoscopic ultrasound;以下,EUSと略記)所見:腫瘍は粘膜下層に連続し,筋層との連続性は明らかでないことから粘膜下層より発生した腫瘍と考えられた.腫瘍内には内部均一で低エコーの多房性囊胞を認めた(Fig. 1b).囊胞の隔壁は高エコーで軽度の肥厚を認めるが,血流信号は乏しく壁在結節等の悪性疾患を疑う所見は認めなかった.
腹部造影CT所見:胃前庭部小彎後壁から胃内腔に突出する30 mm大の境界明瞭な腫瘤を認め,内部に辺縁平滑な5mmから20mm大の小囊胞を複数認めた.囊胞壁の一部に軽度の造影効果を認めたが壁在結節は認められず,腫瘍による周囲浸潤や膵臓との連続性も指摘できなかった(Fig. 1c).
腹部MRI所見:囊胞内はT2強調画像で高信号の内容液が貯留していたが血性成分を疑う信号はなく,囊胞内腔に突出するような壁在結節は認めなかった(Fig. 1d).膵臓には腫瘍性病変や囊胞性病変は指摘できなかった.
以上の画像所見から,異所性膵に併発した囊胞性病変(貯留囊胞,仮性囊胞,IPMNなど)と診断した.囊胞変性を伴うGISTなども鑑別には挙がったが,囊胞の背景にある腫瘤成分が異所性膵であることはほぼ確定的と考えられたため悪性腫瘍を鑑別するための超音波内視鏡下穿刺吸引法(EUS-fine needle aspiration;以下,EUS-FNAと略記)による組織診断は必須でないと判断し施行しなかった.
異所性膵とそれに併発した囊胞性病変で,囊胞内に悪性を示唆する所見はないことから貯留囊胞や仮性囊胞などの良性疾患を第一に考えた.そのため,経過観察も選択肢に上がったが,囊胞が良性疾患であるという確証はなく,仮にIPMNであった場合には将来的なIPMN-derived cancerの発癌リスクも否定できないことから予防的な意義での手術適応と判断した.大きさは3 cm弱で,囊胞性病変がIPMNであったとしても国際診療ガイドライン13)におけるhigh risk stigmataに合致する所見はないことから術式は局所切除で十分と考えた.しかし,腫瘍肛側縁が幽門まで5 mmと極めて近接しており,局所切除による胃壁全層切除では幽門温存は困難と考えられた.一方で経過観察も選択肢に上がる良性疾患を第一に考えていること,40歳代と比較的若年で長期的なQOLを考慮すると胃切除は極力回避することが望ましいことから,核出術も許容されると判断しPEIGSを選択した.
手術所見:まず経口内視鏡により胃を最大限に送気拡張させて胃角部前壁の位置を体表から確認した.同部が臍部まで進展しなかったため,臍上約4横指頭側の上腹部正中に35 mm横切開をおいて開腹し,胃角部前壁大彎側に全層切開孔を開けて腹壁に挙上し,縫合固定し胃瘻を作成した(Fig. 2a, b).同部にラッププロテクターを挿入し,EZトロッカー3本(カメラ,術者右手,助手)を刺入したEZアクセスを装着し,胃内のCO2送気を開始した.胃内を観察しながら胃前庭部前壁を確認し,同部を鮒田式固定具で腹壁に固定し術者左手用に細径ポート(BJニードル,2 mm)を挿入した(Fig. 2c).胃内をCO2で拡張させ腫瘍を確認し,腫瘍周囲を電気メスでマーキングした後に粘膜下に生理食塩水を局注し,フック式電気メスを用いて粘膜,粘膜下層を剥離した(Fig. 3a).腫瘍は深部で筋層に連続していたため,腫瘍に切り込んで腫瘍被膜を損傷しないよう超音波凝固切開装置を用いて筋層の浅層を腫瘍側に着けるように切離した(Fig. 3b).肛側端では,幽門を確認し温存する位置で切離し,腫瘍を核出した.切除後は粘膜欠損部を4-0モノフィラメントの吸収糸を用いて体腔内結紮で縫合修復した.縫合後の粘膜変形による幽門狭窄を回避するため幽門に近い側から結節縫合にて一針ずつ形態を確認しながら縫合した.欠損範囲は広範囲に及んだが粘膜下層を追加で剥離する必要はなく十分に縫合修復することは可能であり,最終的に幽門が温存されたことを確認した(Fig. 3c).

Port placement and temporary gastrostomy. a: Schema of the port placement. A 35-mm vertical incision for gastrostomy and 2-mm assisted needle instrument port was placed at the anterior wall of the antrum (arrow). b: Temporary gastrostomy was constructed. c: A multi-access port was placed during gastrostomy, and small forceps with 2-mm diameter was inserted from the 2-mm assisted port.
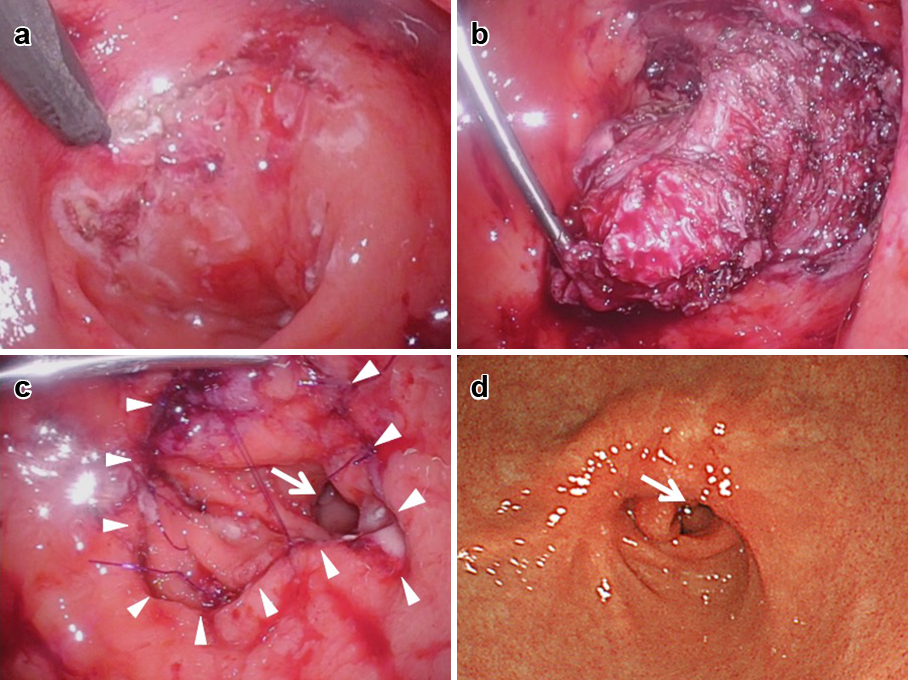
a: Mucosal marking and submucosal injection of saline. b: Tumor was enucleated with attaching partial normal muscle bundles to avoid tumor capsule injury. c: Checking pyloric patency (arrow), defect of mucosa was sutured (arrowheads). d: Postoperative endoscopy revealed preserved pyloric ring without stenosis and no residual foods.
切除標本所見:腫瘍径は30 mmで表面平滑,弾性硬であった.割面は,白色充実性腫瘤で内部に5~10 mm大の複数の囊胞を認めた.切除断端は陰性であった(Fig. 4a).

Histopathological findings. a: Macroscopic findings of the resected specimen revealed a 40×40×15 mm white solid mass within 5 to 10 mm multicystic components. b: Varied size duct components and acinar cells were surrounded by smooth muscle tissues (HE stain, ×40). c: Pyloric gland mucosa-like tissue adjacent to the dilated duct component. Gastric-foveolar-like epithelium showed papillary structure (HE stain, ×100). d: Pancreatic acinar cells were seen in the pyloric glands (HE stain, ×200).
病理組織学的検査所見:粘膜下層から固有筋層にかけて,周囲を平滑筋組織に取り巻かれた大小不同の膵管と,附随した腺房細胞を認め(Fig. 4b),囊胞部は膵管上皮細胞で裏打ちされた拡張膵管であった(Fig. 4c).拡張膵管に連続して幽門腺様構造の増生を認め,胃腺窩上皮細胞は軽度の乳頭状増殖を示し,胃型IPMNに矛盾しない所見であった(Fig. 4c, d).
術後経過:術後1病日より経口摂取を開始し,術後合併症なく7病日に退院した.術後6か月の上部消化管内視鏡(Fig. 3d)では胃内残渣や幽門狭窄の所見なく幽門輪の収縮も観察され,体重減少も認めなかった.術後1年6か月現在,再発や新出病変なく,外来経過観察中である.
異所性膵は胎生期に膵原基の一つである背側膵原基が迷入することで発生するといわれ14),発生部位は胃,十二指腸,小腸など膵原基に近い部分に多く14)~16),胃では前庭部や大彎に多い17).胃の異所性膵の発生頻度は剖検例で1.8%と報告されている18).組織学的にはHeinrichの分類があり,I型はLangerhans島,腺房細胞,膵管をもつ完全な膵組織,II型は腺房細胞,膵管をもつ膵組織,III型は増殖した平滑筋と膵管をもつ組織からなる19).本症例はLangerhans島を認めないII型の異所性膵であった.異所性膵は良性疾患のため確定診断が得られれば経過観察も可能だが,膵臓と同様に炎症,囊胞,膿瘍,癌化の可能性がある.医学中央雑誌およびPubMedにて「異所性膵」,「IPMN」をキーワードに,異所性膵IPMNが最初に報告された2004年から2017年10月の期間で会議録を除いて検索したところ,10例の報告を認めた(Table 1).胃が4例4)5)8)9),回腸3例3)7)12)(2例はMeckel憩室),空腸2例10)11),十二指腸1例6)であり,臓器別では胃が最も多い.胃に発生した4例のうち2例は膵臓内にIPMN/IPMC(intraductal papillary mucinous carcinoma)を併発し,膵切除を含む術式が選択されている.膵病変のない2例は胃切除,または胃局所切除が選択されており,悪性所見があれば癌に準じた郭清を伴う切除,明らかな悪性所見がなければSMTに準じた治療方針で問題ないと考えられる.
| No. | Author | Year | Age | Sex | Location | Size (cm) | Surgical procedure | Pancreatic disease | Malignant findings |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Cates3) | 2005 | 73 | male | Meckel diverticulum | 0.7 | Diverticulectomy | − | − |
| 2 | Phillips4) | 2006 | 80 | male | Stomach | 6.0 | Antrectomy | − | − |
| 3 | Park5) | 2008 | 66 | male | Stomach | 1.2 | Pancreatico-duodenectomy | + | + |
| 4 | Rosok6) | 2008 | 59 | female | Duodenum | 5.0 | Duodenal partial resection | − | + |
| 5 | Ishigami7) | 2009 | 80 | male | Meckel diverticulum | 4.0 | Small bowel resection | − | − |
| 6 | Patel8) | 2010 | 44 | male | Stomach | 3.0 | Gastric partial resection | − | − |
| 7 | Tsapralis9) | 2010 | 60 | male | Stomach | 2.5 | Gastric partial resection, Total pancreatectomy | + | − |
| 8 | Song10) | 2012 | 74 | male | Jejunum | 3.0 | Small bowel resection | − | + |
| 9 | Okamoto11) | 2014 | 75 | female | Jejunum | 1.5 | Small bowel resection | − | − |
| 10 | Lee12) | 2015 | 49 | female | Ileum | 2.2 | Small bowel resection | − | − |
| 11 | Our case | 42 | male | Stomach | 3.0 | PEIGS | − | − |
IPMNは,乳頭状増殖を呈し,粘液産生がみられる特徴を有し,その粘液形質によって4亜型(胃型:gastric type,腸型:intestinal type,胆膵型:pancreatobiliary type,好酸性顆粒細胞型:oncocytic type)に分類される20).本症例では,異所性膵内の拡張膵管に連続して,胃幽門腺粘膜に類似した組織の増殖を認め,胃腺窩上皮型細胞は軽度の乳頭状増殖を示し,幽門腺内には膵腺房細胞が混在していた.したがって,異所性膵内に発生した胃型IPMNと診断した.
胃SMTに対する外科的治療の適応は,GIST診療ガイドライン21)によると,腫瘍径が5.1 cm以上のもの,5 cm以下で悪性所見があるかまたは組織学的にGISTと診断されたものとされている.一般に異所性膵は良性疾患と考えられており,異所性膵の診断が確定していれば経過観察で十分な可能性はある.しかし,Junら22)は外科的に切除された消化管内異所性膵165検体(胃57,十二指腸56,大網30,空腸22)を組織学的に検索した結果,大網を除く消化管内異所性膵135検体のうち,腺房・腺管の異形成(metaplasia)が117検体(87%),PanINs/IPMNsが68検体(50%),4検体(2.4%)でPanINsに隣接してadenocarcinomaが存在したと報告しており,一般的な認識よりも高頻度で異型を伴う変化が存在していることが示されている.また,胃の異所性膵は十二指腸や空腸に比べてPanINs/IPMNsのサイズが大きく,深部進展を示す傾向があると報告されており,胃に発生して長期的なfollow upが必要となる非高齢者に関しては積極的な外科切除も選択肢の一つとして考慮されうる.本症例は最大径3 cmで異所性膵に伴う良性囊胞(貯留囊胞,仮性囊胞)を第一に疑ったが,併発する囊胞性病変がIPMNである可能性も否定できず,また40歳代と比較的若年者であり経過観察とした場合は長期に及ぶことから,診断時点で悪性腫瘍を疑う所見は認めないが,将来的な悪性化の可能性を念頭においた予防的・診断的意義での切除適応と判断した.近年,胃SMTに対しては術前にEUS-FNAによる病理学的検索を行うことが推奨されるが,本症例では画像診断において囊胞の背景にある実質成分が異所性膵と考えられ,また囊胞内の貯留液や囊胞壁の一部を穿刺吸引しても良悪性の診断に寄与する情報が得られる可能性は極めて低いと判断したためEUS-FNAは施行せずに手術を実施した.
胃SMTに対しては系統的なリンパ節郭清は不要で,基本的には臓器機能を温存した部分切除が推奨される21).壁外型のSMTは容易に楔状の局所切除が可能だが,管腔内突出型腫瘍を楔形に切除すると,同時に切除される正常胃壁の範囲が広くなる傾向があることから,近年では経口内視鏡を術中に併施する腹腔鏡・内視鏡合同手術(laparoscopy and endoscopy cooperative surgery;以下,LECSと略記)23)が普及してきた.LECSでは,経口内視鏡下に腫瘍周囲をマーキングし,粘膜下層剥離術の技術を応用して全層切除を行うため,必要最小限の切除で可及的に正常胃を温存できることが利点であるが,実際には全層切除のため最低でも5 mm程度のマージンを持っての胃壁切除が必要となり,噴門や幽門にかかる,あるいは10 mm未満に近接している場合には,それらを温存することが困難となる.本症例は腫瘍肛側縁から幽門まで5 mm程度の距離しかなく,LECSやLECS関連手技での幽門温存は不能と判断しPEIGSを選択した.
PEIGSは,1995年にOhashi24)により考案された術式で,胃の内腔に腹腔鏡用の手術器具を挿入して行う手技である.PEIGSは管腔内から病変を直視することができ,任意の大きさや形態での胃壁切除術と縫合が可能となる.また,臍部または上腹部の横切開創と補助ポートのみであり手術創の整容性にも優れる.一時的に造設した胃瘻からの単孔式手術のため,通常の腹腔鏡下胃局所切除に比べて煩雑な手技となるが,特に噴門(食道胃接合部)にかかるSMTに於いてはLECSなどでの経口内視鏡による管腔側からの視野,操作性が非常に困難である点から,噴門機能の温存と過不足のない切除が可能であるPEIGSが有用であることが報告されている25).本症例は噴門ではなく幽門近接であったが,内腔からの核出により幽門を温存して腫瘍摘出することが可能であった.しかし,GIST診療ガイドライン21)では,腫瘍性SMTの外科治療において核出術は避けるべきであると記載されており,核出術であるPEIGSの適応については議論がある.一般に核出術は腫瘍に切り込む恐れや,偽被膜を損傷するリスクが高まり,その結果として腫瘍の播種や局所再発が危惧される.Kanehiraら25)はPEIGSを行ったGIST 59症例の長期予後を報告しており,全例切除断端陰性で局所再発は1例もないことを報告しており,偽被膜損傷を回避できれば核出術であっても治療効果には差がないことが示唆されている.しかし,これは手技に習熟した外科医による報告と考えられ,その適応には慎重な姿勢が求められる.本症例は比較的若年者で良性腫瘍と診断したため長期的なQOLを考慮してPEIGSの適応と判断した.患者には上記のようにGISTであった場合の播種や局所再発のリスク,囊胞がIPMNで術後病理診断において悪性を疑う所見があれば追加で胃癌に準じたリンパ節郭清を伴う胃切除を行う必要性があることをインフォームドコンセントし手術を実施した.結果として腫瘤に悪性を疑う所見はなく,断端の遺残や腫瘍へ切り込むことのない完全切除と幽門機能を温存できたことは意義深いと考えられた.
胃幽門前部の異所性膵に発生した胃型IPMNに対し,PEIGSにより幽門機能を温存し,過不足ない切除を施行できた.適応を十分に考慮すれば幽門に近接した胃SMTに対してPEIGSは根治性QOLの観点から有用な低侵襲術式の一つと考えられた.
なお,本症例要旨は第79回日本臨床外科学会総会(2017年11月,東京)で発表した.
利益相反:なし