2022 年 55 巻 3 号 p. 207-216
2022 年 55 巻 3 号 p. 207-216
症例は69歳の女性で,腸閉塞を繰り返し,腹部CTにて回盲部腫瘍による回腸末端部の狭窄が疑われた.手術所見では,回盲部は一塊腫瘤状になっており,腹腔内全体に無数の腹膜播種結節を認め,回盲部切除+D1郭清を施行した.病理組織検査にて虫垂原発goblet cell adenocarcinoma(以下,GCAと略記)および腹膜播種と診断した.術後は大腸癌に準じた化学療法を施行され,術後4年2か月の長期生存が得られた.虫垂GCAに対する化学療法や腹膜播種の長期生存例についての報告は少ないため,この症例を報告する.
A 69-year-old Japanese woman complained of repeated abdominal cramping pain. A CT scan showed a stenotic terminal ileum due to an ileocecal tumor, and laparotomy revealed a conglomerated ileocecal tumor with extensive peritoneal dissemination. Ileocecal resection and D1 lymphadenectomy were performed. The histopathological diagnosis were goblet cell adenocarcinoma (GCA) of the appendix and peritoneal dissemination. Several postoperative chemotherapy regimens were used as a colorectal cancer, and the patient has survived for 4 years and 2 months after surgery. We report this case as a relatively rare example of long-term survival after chemotherapy for appendiceal GCA with peritoneal metastases.
Goblet cell adenocarcinoma(以下,GCAと略記)は腸粘膜に存在する胚細胞に類似する細胞の増殖と腺癌成分の混在を特徴とする比較的まれな腫瘍である1)~5).今回,我々は腹膜播種を伴う虫垂原発GCAと診断され,術後化学療法により長期生存が得られた貴重な症例を経験したので,文献的考察を加えて報告する.
患者:69歳,女性
主訴:上腹部痛
家族歴:特記すべきことなし.
現病歴:2016年5月より繰り返す上腹部痛があり近医受診し,腹部CTにて回腸に通過障害が疑われ当院紹介,入院精査となった.当院でのCT再検査にて,Bauhin弁やや口側の回腸で壁の肥厚を認め,その口側腸管に軽度の拡張と,盲腸壁の軽度の壁肥厚も認めた.また,下部消化管内視鏡検査を施行したが,明らかな腫瘍性病変は指摘できなかった.Bauhin弁部には硬化があり,内視鏡は挿入できなかった.同部位の生検組織診断はGroup 1であった.この時点では炎症性腸疾患と考え内服治療を開始し一旦退院した.2か月後の2016年7月に再び腸閉塞となり再入院となった.
入院時血液・生化学検査所見:明らかな異常は認めなかった.CEA,CA19-9などの腫瘍マーカーは正常であった.
腹部造影CT所見(再入院時):虫垂は腫大し,粘膜を中心に造影効果を認めた(矢印).造影効果は虫垂根部に及んでいた(Fig. 1a).Bauhin弁やや口側の回腸を中心として全層性に造影効果を認め,同部に壁肥厚と狭窄を認めた(矢印).造影効果はBauhin弁まで連続して認めた(Fig. 1b).

Enhanced abdominal CT. (a) The appendix was swollen and a contrast effect was present mainly in the mucosa (arrow) and extending to the appendix root. (b) Focal wall thickening and strong enhancement of the wall of the ileum (arrow), which caused stenosis of the terminal ileum.
下部消化管内視鏡検査所見(再入院時):Bauhin弁は確認できたが硬化しており,口側回腸への内視鏡挿入は困難であった.Bauhin弁より虫垂入口部へ連続して発赤を認め,所見としては2か月前と大きな変化がみられなかった.Bauhin弁部の生検を3か所施行したがいずれもGroup 1であった(Fig. 2a, b).

Colonoscopy findings. (a) Redness of the mucous membrane from the Bauhin valve to the orifice of the appendix. (b) The Bauhin valve was hardened and it was difficult to insert the probe in this region.
入院後経過:この時点では炎症性瘢痕による狭窄か,回盲部の悪性腫瘍による腸閉塞かは判別できなかったが,いずれにせよ外科的治療を要する状態と判断され,手術目的にて外科に転科となり,2016年8月に手術を施行した.
手術所見:腹部正中切開にて開腹し腹腔内を検索したところ,小腸間膜,大網,右横隔膜下,ダグラス窩などに米粒大から粟粒大の小結節を多数認め腹膜播種と診断した.回盲部が硬く一塊腫瘤状になっており,このため回腸の狭窄を来しているものと考えられた.その他の胃,卵巣などは異常を認めなかった.回盲部切除術およびD1リンパ節郭清術を施行した(Fig. 3a, b).

Surgical findings. (a) Tumor induration involving the cecum and terminal ileum (arrow). (b) Peritoneal dissemination throughout the abdominal cavity (arrows).
切除標本所見:盲腸,回腸ともに粘膜面には明らかな病変を認めなかった.虫垂は全層性に肥厚・硬化しており(矢印),虫垂原発の腫瘍が疑われた(Fig. 4).

Excised specimen. There were no lesions on the mucosal surface in the cecum and ileum, and the appendix was hardened (arrow).
病理組織学的検査所見:虫垂の粘膜に潰瘍形成を認めた.虫垂壁に索状構造や管状構造を示す低分化から中分化腺癌の集塊を認め,同時に固有筋層内に杯細胞や印環細胞に類似したGCAと考えられる細胞の小集塊を広範に認めた.虫垂の漿膜面の一部で癌細胞の露出が見られ,小腸と大腸へも浸潤していた(Fig. 5a~d).免疫組織学的所見では,chromogranin A陽性,synaptophysin陽性,CEA陽性,CK7弱陽性,CK20強陽性であった(Fig. 6a~e).以上より,虫垂原発のGCA,T4b,NX,M1b,Stage IVB(UICC 8th edition)と診断した.
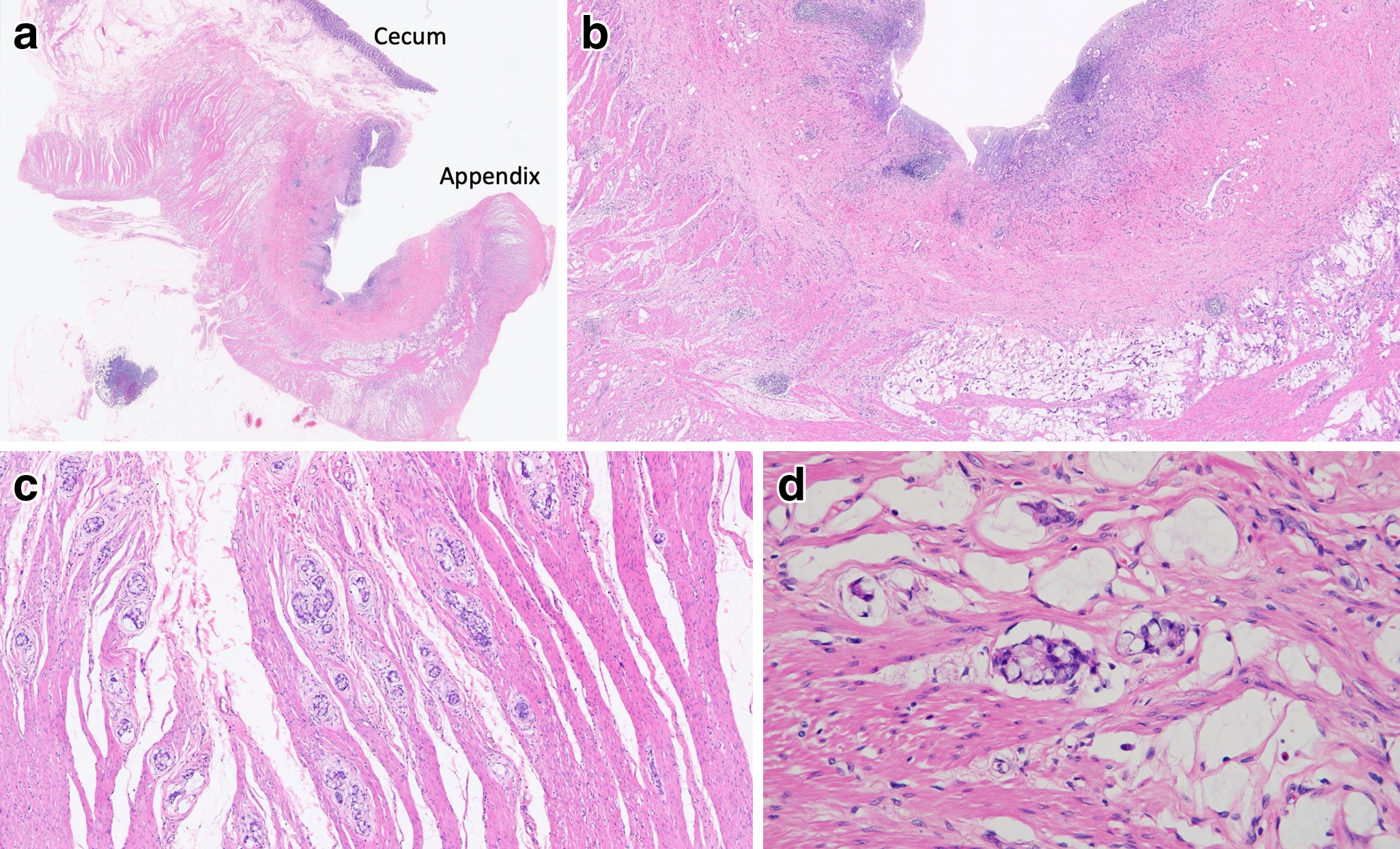
Pathological findings. (a) (HE staining ×1) Fibrous connective tissue proliferation and mucus production in the appendix wall, with infiltration in the large intestine. (b) (HE staining ×4) The mucosa of the appendix was ulcerated. The appendix wall had clusters of poorly to moderately differentiated adenocarcinoma with cord-like and tubular structures. (c) (HE staining ×20) The muscularis propria included small agglomerates of goblet cell-like cancer cells. (d) (HE staining ×40) Tumor cells resembling goblet cells with vacuolar cytoplasm and crescent-excluded nuclei, and signet ring cells with mucus in the cytoplasm.
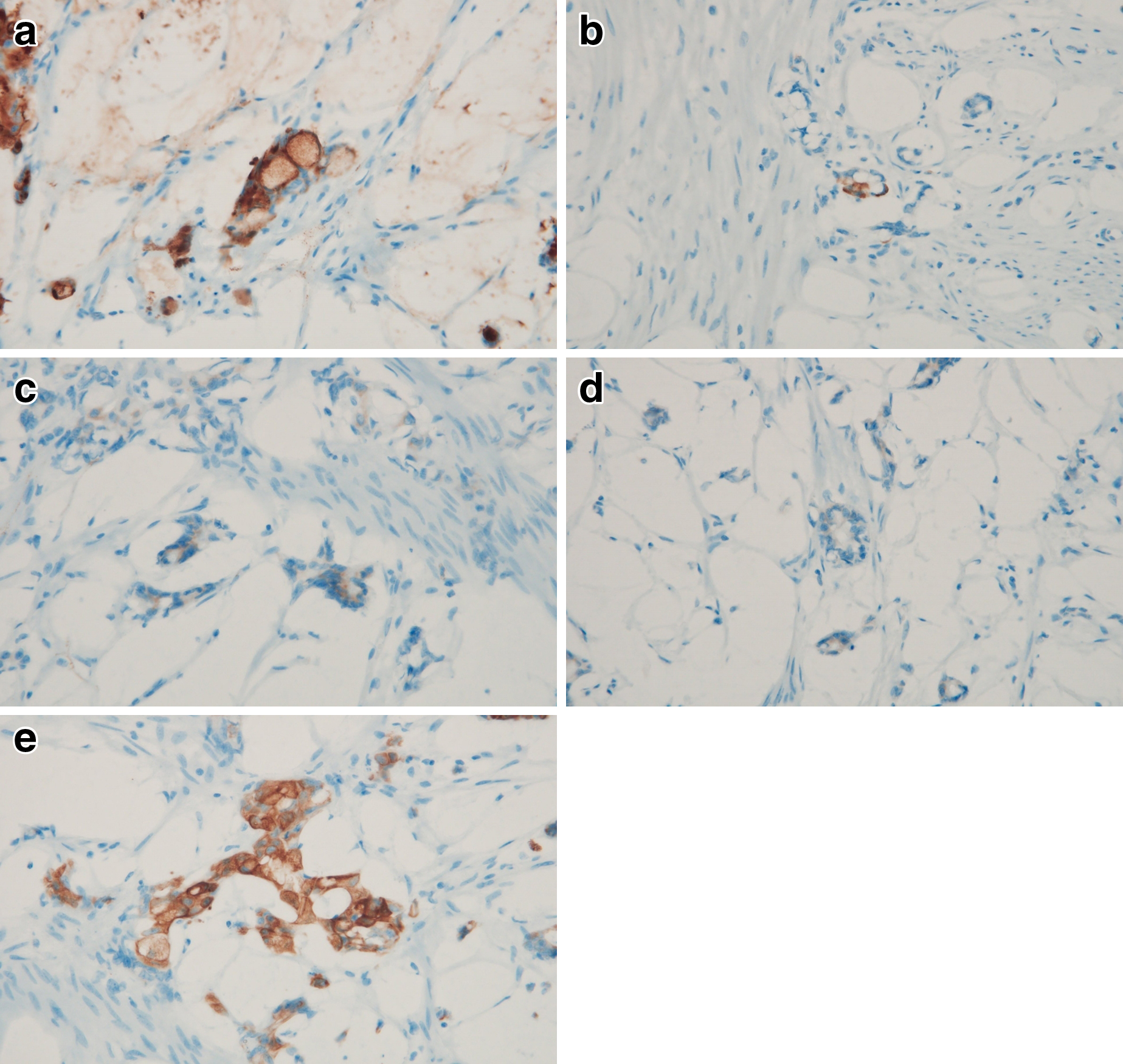
Immunohistochemical findings. Tumor cells were strongly positive for CEA (a), partly positive for chromogranin A (b), positive for synaptophysin (c), weakly positive for CK7 (d) and strongly positive for CK20 (e).
術後経過:術後16日目に退院した.大腸癌に準じた化学療法を選択する方針とし,術後1か月目となる2016年9月よりbevacizumab(以下,BEVと略記)+mFOLFOX6を開始した.4クール施行したところで末梢神経障害が強く出始めたため,その後はBEV+5-FU+l-LV療法に変更した.
2016年12月に施行した腹部単純CTでは,特に腹膜播種を指摘できる所見を認めず,化学療法を継続した.2017年10月骨盤内に微小結節像や少量の腹水貯留が出現し,若干の増悪が疑われたが,抗癌剤変更が必要な変化とは判断せず,2018年3月施行のCT撮像時の判断も同様であった.そのため,術後2年1か月目まで計39クールを施行した.この時点までRECISTガイドラインにおける評価病変と定められる病変はCT画像上認められず,stable diseaseと判断された.2018年9月右卵巣転移と腹水の明らかな増加が出現し,progressive diseaseと考え,抗癌剤の変更を検討した.
Oxaliplatin(以下,L-OHPと略記)については4クールのみの投与でBEV+5-FU+l-LV療法に変更しており,L-OHPの再投与が有効である可能性が考えられ,BEV+mFOLFOX6を再開した.5クール施行した時点の2019年1月に腹部造影CTを施行したところ,右卵巣転移に明らかな縮小は指摘できなかったが,腹水の減少が見られた.Partial responseと判定はできなかったが,有効である可能性が考えられた.しかし,6クール目を投与開始したところ,L-OHPの副作用と思われる全身掻痒感と発疹が出現したため,やむなく中止した(Fig. 7).

Course of treatment. Reduction of ascites was seen with L-OHP chemotherapy, but there were no obvious changes in right ovarian metastasis.
術後2年6か月後となる2019年2月よりBEV+FOLFIRIに変更した.しかし,5クール施行した時点の2019年5月に施行した腹部造影CTにて右卵巣転移,腹水の増加が明らかであった.分子標的薬は,化学療法開始当初より,BEVを使用していたため,RAS遺伝子は野生型であることを確認したのちに,術後2年10か月後となる2019年6月より,panitumumab(以下,PANIと略記)+mFOLFOX6に変更し,3クール施行した.しかし,2019年8月の腹部造影CTにて右卵巣転移,腹膜播種結節の増大をさらに認め,progressive diseaseと判断した.治療歴を検討したところ,L-OHPは有効性が期待できる薬剤ではあったが,副作用である即時型アレルギー様症状出現のため中止となっていた.このため前投薬として投与していた抗アレルギー薬とステロイドを増量し,慎重に経過をみることで対応し,術後3年目となる2019年8月よりPANI+mFOLFOX6を開始し,3クール施行した.しかし,3クール目投与時に再び全身掻痒感と発疹が出現したため,中止とした.患者は新たな薬剤の使用は希望しなかったため,PANI+5-FU+l-LVを月に1度行っていたが,術後3年6か月経過時点で全身状態の悪化が見られ,また本人の希望もあり化学療法は中止した.
その後腹水貯留,亜腸閉塞,貧血などで入退院を繰り返し,緩和ケア中心に治療したが,徐々に全身状態が低下し,術後4年2か月となる2020年10月に永眠された.
虫垂GCAは比較的まれな腫瘍であり,1974年Subbuswamyら1)が疾患名称を虫垂杯細胞カルチノイドとして報告し,それ以降虫垂GCA報告例は本邦に限っても100例を超える.
GCAの本体はgoblet cellの名前の通り,杯細胞あるいは印環細胞類似の核偏在性の粘液を含有する細胞である.この細胞と均一小型で弱酸性細胞質をもつ細胞の2種類の腫瘍細胞が充実胞巣状,索状ないし腺管構造をとって増生し,カルチノイド類似病変と腺癌類似の病変を有することを特徴とする.リンパ節転移や腹膜播種を伴い生物学的悪性度が高く,消化管神経内分泌腫瘍とは区別し,むしろ腺癌の1亜型として捉える考えが主流となっている2)~5).2010年のWHO分類ではmixed adeno-neuroendocrine carcinoma(MANEC)に相当する病変として取り扱っていたが,2019年に新たに発表されたWHO分類では,近年の分子生物学的検討の結果も含め,もはや神経内分泌腫瘍とは考えないこととなり,“carcinoid”という名称は用いず,goblet cell adenocarcinomaあるいはgoblet cell carcinomaという名称を用いることとなった6).大腸癌取扱い規約第9版においては,GCAはカルチノイド腫瘍とは区別され,悪性上皮性腫瘍として腺癌と併記されている7).膵・消化管神経内分泌腫瘍診療ガイドライン第2版においても腺癌の1亜型とされ,mixed neuroendocrine-non-neuroendocrine neoplasm(MiNEN)とは別に扱われるとされている8).
膵・消化管神経内分泌腫瘍診療ガイドライン第2版では現在までの報告例を踏まえその病態について簡潔にまとめられており,これによると大きく二つの病態を認識する必要があるとされている.胚細胞様細胞の核異型が軽度で,間質反応に乏しく,その一つは,核分裂像がほとんど見られない,いわゆるlow-grade GCA成分が主体の段階では,虫垂壁は種々の程度の壁肥厚を示すが,限局性で臨床的に見過ごされやすい病変である.もう一つは進行病変で,通常の腺癌の様相を呈する.異型の強い腺系細胞の複雑な構築の浸潤や胚細胞,印鑑細胞様細胞の浸潤を示し,desmoplasticな間質反応,多数の核分裂像,壊死を伴うhigh-grade GCAが主体となり,浸潤性で固く,大型の腫瘤を形成する8).これは本症例の病態と合致するものと考えられる.
GCAの主座は粘膜深層から粘膜下層にあり,腫瘍が粘膜下を浸潤性に増大し粘膜面に露出することが少ないのが特徴であり,本症例のように術前診断は非常に困難とされている3).一方で,坂本ら9)の報告のように,下部消化管内視鏡にて虫垂開口部およびBauhin弁からの生検で診断が得られる例もまれながら報告されている.
GCAの予後については,混在する腺癌の組織型や量により分類,検討する報告が見られる.Tangら4)はGCAの組織亜型が予後に大きく影響すると報告しており,組織学的所見により,GCAをGroup A(典型的GCA),Group B(GCAに印環細胞型腺癌を合併),Group C(GCAに未分化型腺癌を合併)の3グループに分類し,Stage IV期の症例で比較すると,5年疾患特異的生存率は,Group A,B,およびCでそれぞれ100%,38%,および0%であったとしている.また,Taggartら10)は,組織学的にadenocarcinomaの含まれる量により,142例をGroup 1(GCAのみまたは腺癌を25%以下含む),Group 2(腺癌を25%から50%含む),Group 3(腺癌を50%以上含む),また比較対象として,Group 4(虫垂低分化型腺癌)の4グループに分け検討した.平均生存期間はGroup 1:83.8か月,Group 2:60.6か月,Group 3:45.6か月,Group 4:33.6か月であったとしている.また,各グループ内でのStage IVの占める割合は,Group 1:4%,Group 2:22%,Group 3:67%,Group 4:75%であったと報告しており,腺癌の含有量は,発見時の病期と予後に関連がみられたとしており,癌性成分の量が臨床的特徴および病期と相関し,生存の主要な予測因子と考えられるとしている.
これら二つの分類について,自験例がどのグループに属するかについて病理医が詳細に検討したところ,Tangら4)の分類ではGroup C,Taggartら10)の分類ではGroup 2にそれぞれ分類された.つまり予測される予後は,Tangら4)の報告によると5年疾患特異的生存率は0%,Taggartら10)の報告によると平均生存期間は60.6か月となる.しかし,前述のとおり,Taggartら10)の報告において,Stage IVはGroup 2では22%しか含まれておらず,Stage IVの全生存期間は32.7か月であったとしている.Taggartら10)の報告は1999~2007年の症例を対象としてなされている.大腸癌化学療法の変遷を確認すると,2004年にFOLFOXの大腸癌に対する臨床試験が報告され,BEVの切除不能進行・再発大腸癌に対する臨床効果を示す最初の第III相試験も2004年の報告であることを考えると,多くの症例は現在の化学療法のレジメと異なる可能性が高い11)12).自験例は術後4年2か月(50か月)の生存期間であり,5年生存は得られなかったが,Taggartら10)の報告より比較的長い予後が得られている.これは大腸癌に対する現在の標準的な化学療法を施行したことの結果である可能性がある.
以上より,GCAに対する化学療法は,GCAに含まれる腺癌量が予後に大きく関与する可能性があり,大腸腺癌に準じた化学療法が最も妥当であると考えられる.Consensus guidelinesでは,GCA進行再発症例は大腸癌化学療法に準じて5-FUベースの化学療法を行うべきと記載されているが,その適応とレジメン選択については具体的には記載されていない13).海外でも化学療法に関する報告例は少ない.Tsangら14)は19例の切除不能GCAについて報告し,この内の10例に化学療法を施行している.レジメンはFOLFOX(4例),FOLFIRI(1例),BEV+FOLFIRI(2例),capecitabine(2例)で,大腸癌化学療法に準じて施行されている.また,本邦でも進行再発症例に対してBEVを併用し奏効したという報告がある15)16).
自験例で化学療法治療歴を検討すると,BEV+mFOLFOX6やBEV+5-FU+l-LV療法にて2年のstable diseaseが得られていることや,progressive diseaseが判明後にL-OHPを追加することで腹水の減少が確認されたことから,5-FUベースの化学療法にBEVとL-OHPを追加することが延命に寄与したと考えられたが,PANIとirinotecanは無効であった.
医学中央雑誌にて,1964年から2020年3月までの期間で,「虫垂」,「胚細胞」,「腹膜播種」をキーワードとして検索したところ,会議録を除いて14例の報告を検索しえた.このうち治療内容や経過が確認できたものは12例であり,これに自験例を加えた13例について検討した(Table 1)15)~24).予後に関しては,平均生存期間は25.1か月であった.播種性転移を認める大腸癌症例の術後平均生存期間は約11.5か月と報告されており,GCA腹膜播種の予後は比較的良好であると考えられる25).さらに,2008年までの3例の平均生存期間は9.3か月と短く,3例ともに原病死していた.一方,2013年以降の報告で,FOLFOX,FOLFIRI療法などのいわゆるdoublet療法が施行された症例は8例であった.この8例の平均生存期間は26.1か月と,2008年までの症例の平均生存期間と比較して延長しており,同時に6年9か月もの長期間生存している症例も認められる.したがって,虫垂原発GCAの腹膜播種と診断された場合でも,大腸癌に準じて化学療法を施行することで,長期予後が得られる可能性があるため,積極的な化学療法を施行すべきと考えられる.しかし,一方で,Table 1の症例No. 7,No. 12のように積極的な化学療法を施行していないにもかかわらず長期間生存している症例も認められるため,GCAを組織学的にsubtype分類することは,治療法選択にあたって有用である可能性があると思われた.
| No. | Author | Year | Age/Sex | Extent/location of peritoneal dissemination | Treatment | Outcome |
|---|---|---|---|---|---|---|
| 1 | Yamasita17) | 1999 | 71, M | P3 | CDDP+OK-432 IP+CDDP-5-FU | 10M dead |
| 2 | Yamada18) | 2005 | 55, F | Greater omentum, Intestine | MMC IP+MTX, 5-FU, LV | 5M dead |
| 3 | Nakamura19) | 2008 | 77, F | Not described | PTX IP→S-1 | 13M dead |
| 4 | Isozaki20) | 2013 | 47, F | P3 | FOLFIRI+Bv. | 18M alive |
| 5 | Sibahara15) | 2013 | 46, M | Mesentery, Small intestine | XELOX+Bv.→IRIS+Bv. | 17M alive |
| 6 | Watanabe16) | 2014 | 52, M | Ireocecum, Douglas’s pouch | FOLFOX+Bv. | 8M alive |
| 7 | Iwasaki21) | 2016 | 69, M | Mesentery, Greater omentum | No treatment | 48M dead |
| 8 | Iwasaki21) | 2016 | 69, M | Mesentery, Intestine | UFT/LV→FOLFOX+Bv.→FOLFIRI→Pmab+CPT-11 | 81M dead |
| 9 | Iwasaki21) | 2016 | 64, F | P3 | FOLFOX+Bv. | 10M dead |
| 10 | Iketani22) | 2016 | 72, M | Mesentery | mFOLFOX6+Bv.→sLV5-FU+Bv.→sLV5-FU | 24M alive |
| 11 | Isiyama23) | 2017 | 45, M | Not described | UFT/LV→FOLFOX | 7M alive |
| 12 | Suganuma24) | 2017 | 69, M | Greater omentum, Abdominal wall | S-1 | 50M alive |
| 13 | Our case | 69, F | P3 | Bv.+mFOLFOX6(SD)→Bv.+FU+l-LV(SD)→Bv.+FOLFIRI(PR?)→PANI+mFOLFOX6(PD)→PANI+FOLFIRI(PD) | 50M dead |
IP=intraperitoneal injection, SD=stable disease, PR=partial response, PD=pregressive disease
利益相反:なし