2022 年 55 巻 3 号 p. 199-206
2022 年 55 巻 3 号 p. 199-206
症例は77歳の女性で,受診3日前から湿性咳嗽,発熱があり,SARS-CoV-2 RNA検査陽性で前医入院となった.受診日に酸素化低下,食事量低下・嘔吐があり,CTで小腸壊死を疑う所見を認め,当院に転院搬送された.術前胸部CTで肺炎像を認めず,小腸壊死による腹膜炎の診断で緊急開腹小腸部分切除術を施行した.術後腹部症状は改善したが肺浸潤影が急速に増悪し,術後5日目に呼吸不全で死亡した.SARS-CoV-2 coronavirus disease 2019(以下,COVID-19と略記)患者に手術を施行すると肺合併症のため術後死亡率が高くなるという報告があり,可能なら手術の延期や非手術治療の選択が推奨されている.本症例は小腸壊死の疑いで非手術治療が困難だったことで緊急開腹術の適応と考えられたが,術後肺炎が急激に悪化し死亡した.術前肺炎像のないCOVID-19患者でも全身麻酔手術後の予後が不良であることを示唆する1例であり,周術期の感染対策と併せて,報告する.
A 77-year-old woman was admitted to another hospital with a positive SARS-CoV-2 RNA test, complaining of a wet cough and fever that had started 3 days earlier. On the day of admission, she had decreased oxygenation, decreased food intake, and vomiting. A CT scan showed suspicious findings of small bowel necrosis, and the patient was transferred to our hospital. A preoperative CT scan of the chest showed no pneumonia. The patient underwent emergency laparotomy for diagnosis of peritonitis due to necrosis of the small intestine. Postoperatively, the abdominal symptoms improved, but the pulmonary infiltrate rapidly worsened and the patient died of respiratory failure on the fifth postoperative day. It has been reported that surgery in patients with SARS-CoV-2 coronavirus disease 2019 (COVID-19) is associated with higher postoperative mortality due to pulmonary complications, and it is recommended that surgery be postponed or nonoperative treatment be chosen if possible. In this case, the suspected small bowel necrosis made nonoperative management difficult, and emergency laparotomy was performed. However, postoperative pneumonia rapidly worsened and the patient died. This case suggests that the prognosis after general anesthesia surgery is poor in patients with COVID-19, even in the absence of preoperative pneumonia. Here, we report this case and discuss the literature and perioperative infection control measures.
2019年12月に中国の武漢より広がった肺炎は,2020年2月11日に世界保健機関(World Health Organization;以下,WHOと略記)によりSARS-CoV-2 coronavirus disease 2019(以下,COVID-19と略記)と名付けられ1),現在まで日本を含めて世界的に広がりをみせている.
COVID-19患者の81%は軽症であるが,14%は重症となり,5%がショックや呼吸不全,多臓器不全から集中治療を要し,その死亡率は2.3%に達する2).増悪のリスク因子は高齢・悪性腫瘍・慢性閉塞性肺疾患・慢性腎臓病・2型糖尿病・高血圧・脂質異常症・喫煙・肥満・移植後免疫不全・妊娠後期とされているが3)4),COVID-19患者では緊急手術後の30日以内の死亡率が25.6%と高く5),手術も増悪因子として認識しておく必要がある.
手術の適応に関しては,「新型コロナウイルス陽性および疑い患者に対する外科手術に関する提言」において,COVID-19患者は医療救急体制がひっ迫している状況では,致死的でない,急を要さない疾患の予定手術は原則延期とし,致死的でないが重症化する可能性のある疾患は可能であれば手術を延期する,致死的になりうる疾患は十分な感染対策を講じ慎重に手術を実施することを推奨している6).その後,COVID-19に関する知見が集積され,本邦でも発症日から10日間経過し,かつ症状軽快後72時間が経過していれば周囲への感染性が低くなることから7),隔離解除・退院可能となっており,医療者への感染リスクを低減するためには,発症後10日以後の手術が望ましいと考えられる.一方で患者の合併症を減らす観点からは,発症から7週間は延期すること8),あるいは症状消失から8週間は延期し,術前に心肺機能の評価を行うこと9)が推奨されている.以上より,COVID-19患者の緊急手術では,少なくとも10日間の待機が不可能な症例にかぎり,十分な感染対策を講じて手術を行うことが望ましいと考えられる.
我々は,小腸壊死を発症した肺炎像のないCOVID-19患者に対し,保存的加療は不可能と判断し緊急手術を行ったが,術後肺炎症状が急速に出現・増悪し死亡した症例を経験した.術前に肺炎像を認めていないCOVID-19患者でも,全身麻酔手術後の予後が不良であることを示唆する1例であり,術前・術中のCOVID-19の感染対策とあわせて,文献的考察を加えて報告する.
患者:77歳,女性
主訴:発熱,嘔吐
現病歴:当院転院の3日前から湿性咳嗽,発熱があり,SARS-CoV-2 RNA検査で陽性のため,COVID-19肺炎としてデキサメタゾン6 mgを前医で開始されていた.その後食事量低下と嘔吐,酸素化不良がありCTを施行されたところ,小腸の血流不良を認め,絞扼性腸閉塞の疑いで精査加療目的に当院へ転院搬送された.
既往歴:50歳時に混合性結合組織病,全身性エリテマトーデス(systemic lupus erythematosus;以下,SLEと略記)と診断され,以後プレドニゾロン10 mg/dayを内服継続していた.認知症のため意思疎通は困難で,脊柱管狭窄症のためADLは全介助であった.
入院時現症:GCS15(E4V5M6),体温36.7°C,血圧111/74 mmHg,脈拍122回/分,呼吸数27回/分,SpO2 94%(鼻カヌラ酸素1 l),苦悶様顔貌で腹壁はやや緊張し,腹部膨満および,腹部全体に圧痛を認めた.APACHE IIスコアは14点であった.
血液生化学検査所見:炎症反応の上昇と腎機能障害,電解質異常が認められた.また,凝固系機能も異常値を示した(Table 1).
| WBC | 5.8×103/μl | LD | 678 U/l |
| RBC | 3.45×106/μl | CK | 2,301 U/l |
| Hb | 10.8 g/dl | AMY | 903 U/l |
| Platlet | 186×103/μl | Lipase | 9 U/l |
| CRP | 36.29 mg/dl | BUN | 88 mg/dl |
| Procalcitonin | 319 ng/μl | Cre | 2.33 mg/dl |
| Na | 136 mmol/l | eGFR | 16.3 ml/min/1.73 m2 |
| K | 6.6 mmol/l | PT | 55% |
| Cl | 104 mmol/l | PT-INR | 1.36 |
| Ca | 6.8 mg/dl | APTT | 105.8 sec |
| blood glucose level | 42 mg/dl | Fib | 748 mg/dl |
| TP | 4.9 g/dl | D-dimer | 10.72 μg/ml |
| Alb | 2.2 g/dl | ||
| T-Bil | 0.4 mg/dl | pH | 7.406 |
| AST | 153 U/l | pCO2 | 36.3 mmHg |
| ALT | 37 U/l | pO2 | 73.2 mmHg |
| ALP | 100 U/l | HCO3 | 22.3 mmol/l |
| γ-GTP | 9 U/l |
Elevated inflammatory response, renal dysfunction, and electrolyte abnormalities were observed. The coagulation system function was also abnormal.
胸腹部単純CT所見:肺浸潤影は明らかではなかった.広範囲の小腸に血流不良域と考えられる低吸収域を認め,腹水貯留を伴っていた(Fig. 1, 2).
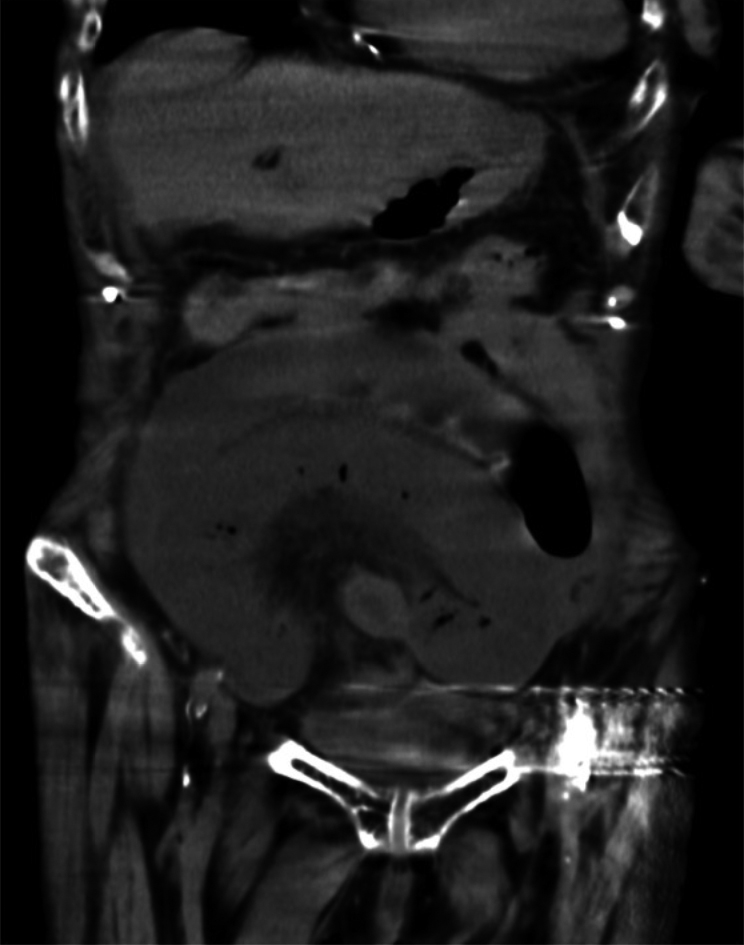
CT of the abdomen at the time of admission, showing low-density areas in a large area of the small intestine, which were thought to be areas of poor blood flow, accompanied by ascites effusion.

CT of the chest at the time of admission, showing no obvious pulmonary infiltration.
患者は認知症のため治療方針の意思決定は困難であり,本人の意思推定が可能な家族と治療方針の相談を行った.術前診断は絞扼性腸閉塞で小腸壊死に至っており,救命のためには緊急手術が必要な状態だと考えられた.術前のCTでは明らかな肺炎像を認めないが,COVID-19患者であり,術後の呼吸不全のリスク・致死的になる可能性が非常に高いことの説明を受け,家族は救命のための緊急手術は希望したが,術後の状態悪化時には気管挿管・人工呼吸管理・心肺蘇生などの侵襲的な治療については行わないことを希望した.
術式:小腸部分切除術,手術時間:55分,出血量:410 ml(腹水を含む)
周術期感染対策:日本環境感染症学会の「医療機関における新型コロナウイルス感染症への対応ガイド」10)を参考とした.陰圧手術室を使用し,手術中はN95マスクとフェイスシールド付きのサージカルマスク,キャップ,2重手袋,長靴を着用した.また,エアロゾルの発生を減らすため,超音波凝固切開装置は使用せず11),エネルギーデバイスは電気メスのみを使用し,血管処理は絹糸で適宜結紮して止血処理を行った.術前評価で腸管切除が必要となる可能性が高く,短時間で手術を終了するために外科医3人が手術に参加した.手術室全体の感染対策を指揮・監督するために感染制御部の医師も1人同席した.切除した小腸は,腸液にCOVID-19が存在するという報告があることから12),切開せずにホルマリン液に浸漬し病理検査に提出した.
手術所見:仰臥位で手術を開始し,正中上下腹部にメスで皮膚切開を置いた.腹腔内を観察すると,小腸は約1 mにわたり壊死していた.虚血の原因となるような捻転・絞扼を疑う所見は認めなかった.上腸間膜動脈支配領域の腸管は広範囲で白色調を呈し血流不良が示唆されたため,動脈塞栓・血栓症による小腸壊死と診断した.1.5 m長の壊死小腸を切除し,腸管血流が比較的良好な部位で縫合器による機能的端々吻合を施行した.吻合部周囲にドレーンを1本留置した.腸管穿孔などの腹腔内の明らかな汚染はなく,腹腔内の洗浄は施行しなかった.筋膜を1-0吸収性モノフィラメント縫合糸で単結節縫合し,創部皮下を洗浄した.皮膚を3-0ナイロン糸でマットレス縫合して,閉腹し手術を終了した.
病理検査結果:切除腸管のうち,菲薄化・変色している部位では粘膜や筋層・腸間膜にかけて壊死が見られ,間質にはうっ血を伴っていた.循環障害に伴う虚血性変化と考えられ,壊死部近傍の血管には血栓やフィブリノイド壊死が散見された.以上より,上腸間膜動脈の循環障害に伴う小腸壊死と診断した.
術後経過:胸部X線で術後1日目より両肺浸潤影が出現し,術後2日目に肺浸潤影が急速に悪化した(Fig. 3, 4).術後3日目には両肺に胸水貯留も出現した(Fig. 5).また,術後2日目にDダイマー 35.39 μg/mlと上昇があり,術後3日目よりヘパリンカルシウムの皮下注射を開始した.腹部症状は徐々に改善し,炎症反応の低下も認められたが,急激に酸素化が悪化し,術後5日目に呼吸不全で死亡した(Fig. 6).
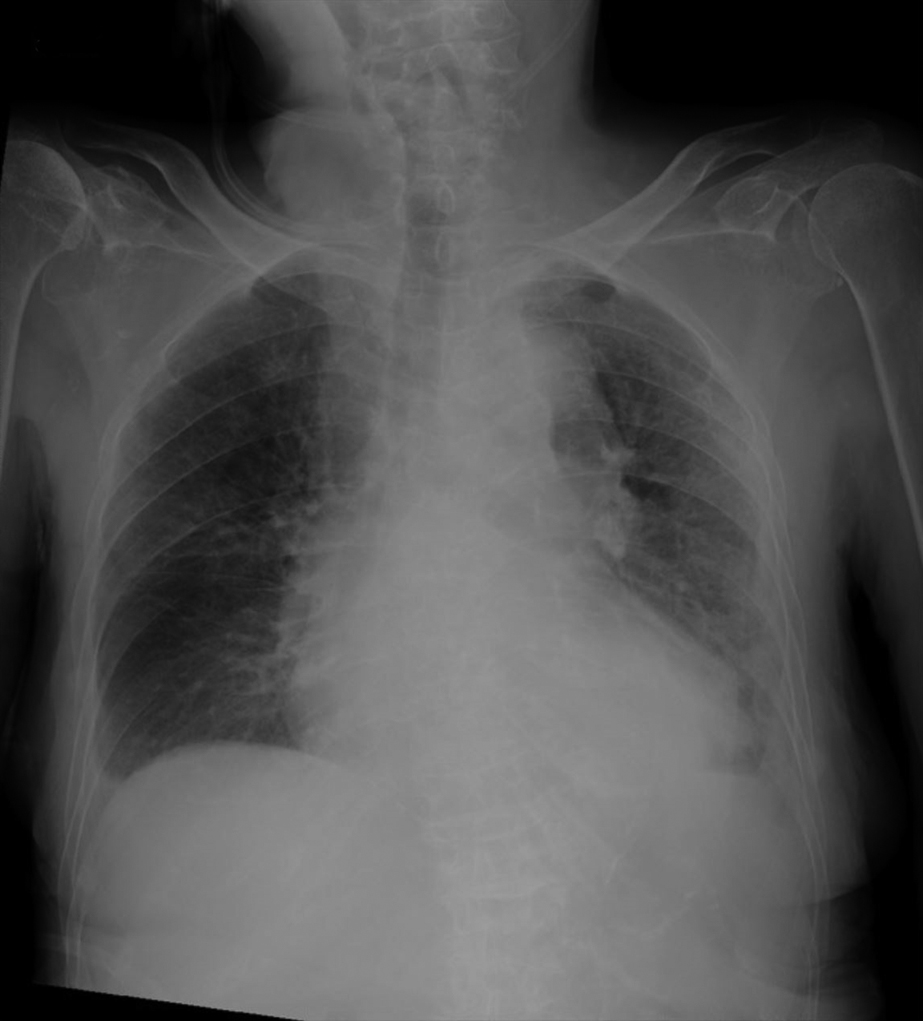
Chest radiograph on the first postoperative day. Shadows of infiltration appeared in both lungs, which were not present before surgery.
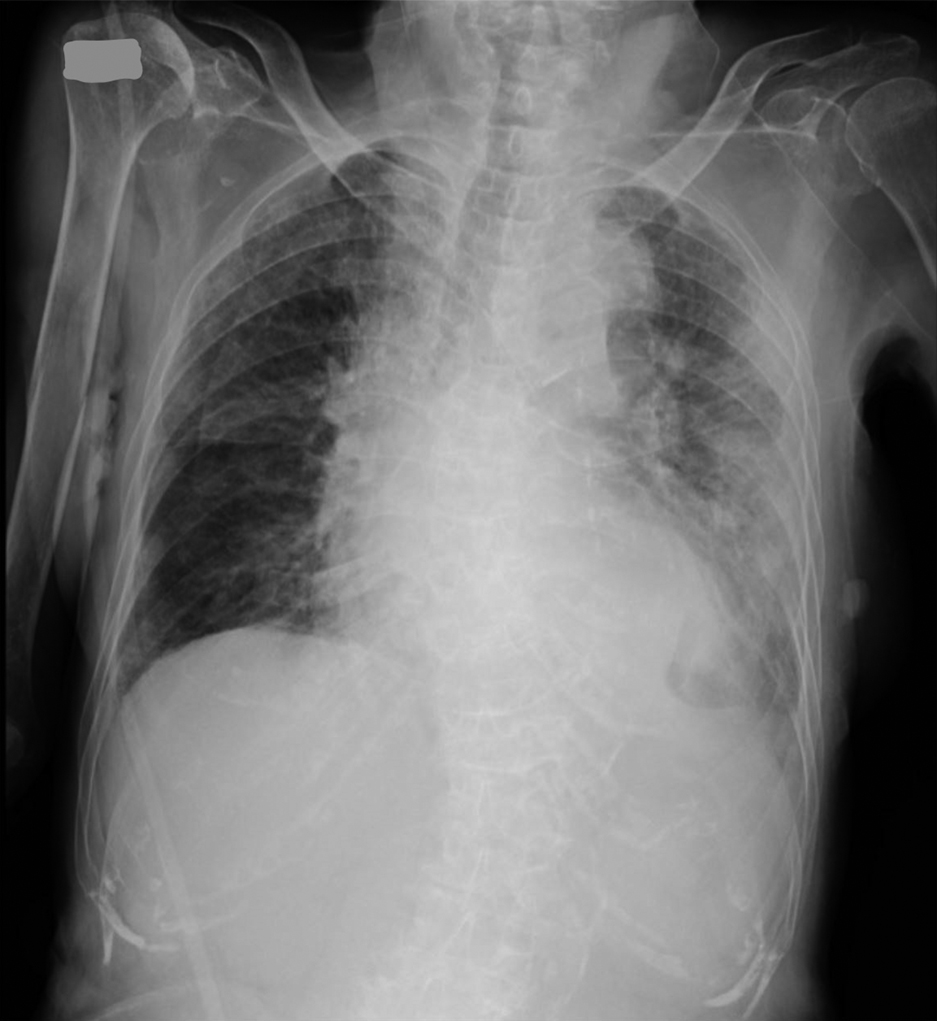
Chest radiograph on the second postoperative day. Both lung infiltrates had worsened rapidly.

Chest radiograph on the third postoperative day. Pleural effusion was observed in the right lung between the pleura.
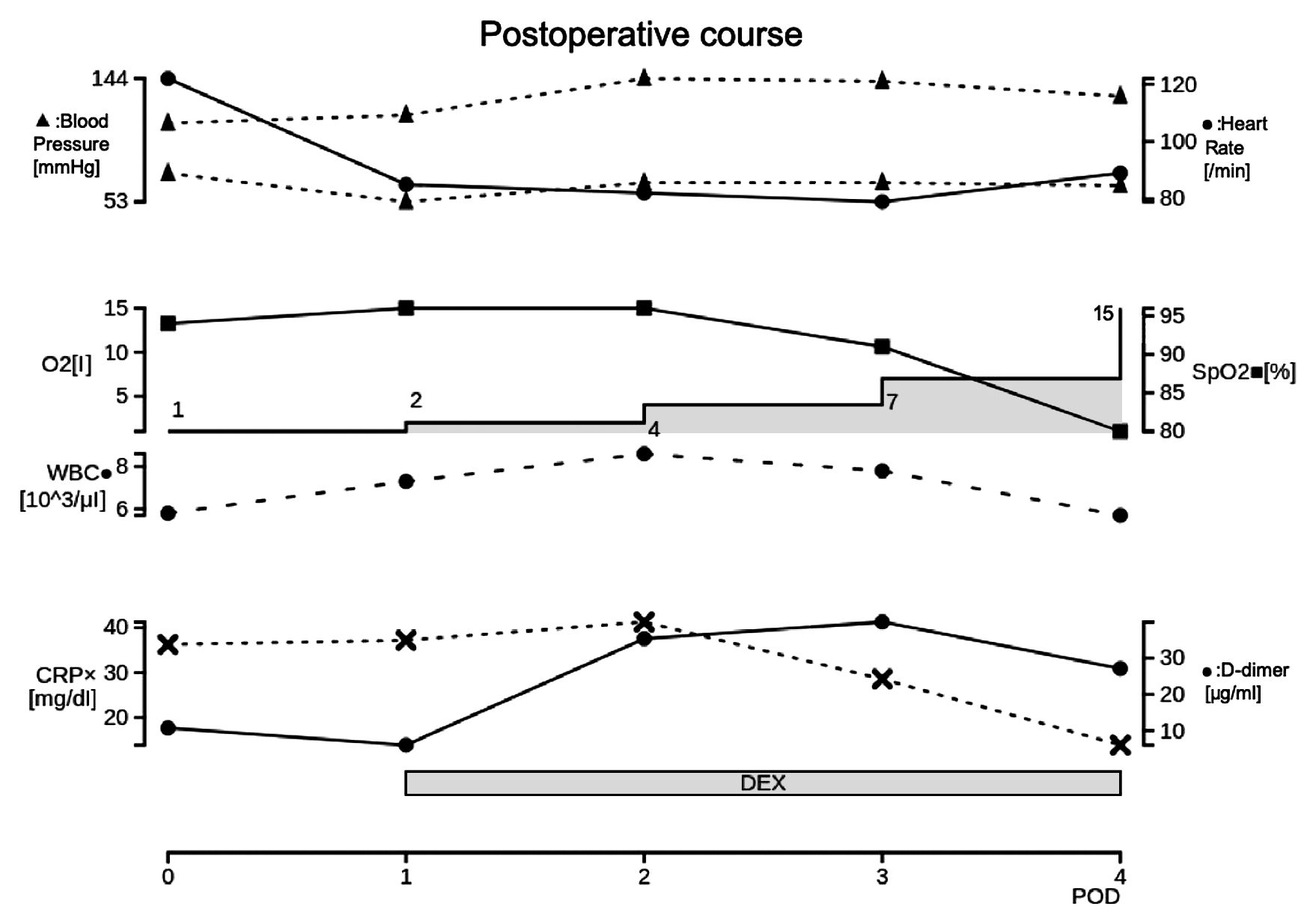
Postoperative chart. The top row shows the pulse (solid line) and blood pressure (dotted line), the second row shows SpO2 (solid line) and oxygen administration (bar graph), the third row shows WBC count (dotted line), and the fourth row shows CRP (dotted line) and D-dimer (solid line) levels. DEX: dexamethasone, POD: postoperative day.
本症例は,術前にCOVID-19肺炎の診断であったが胸部CTでは明らかな肺炎像を認めなかった.絞扼性腸閉塞による小腸壊死の疑いで保存的治療が困難な状態であったことから緊急手術を行った.APACHE IIスコアは14点で,もしCOVID-19感染の影響がなければ,手術治療時の術後死亡割合は7%となり,救命が見込まれる症例であった.実際に,術後腹部症状や炎症所見は改善していたが,肺炎像が急激に出現・悪化したため,術後5日目に死亡した.これまでの報告では,手術前7日から術後30日までに新型コロナウイルス感染を来した症例は,25.6%が30日以内に死亡し,その8割以上が肺合併症であったとされている5).本症例も,術前には肺炎像を認めていなかったが,術後に肺炎症状が急激に悪化し,呼吸不全のため死亡した.COVID-19患者は術後肺炎増悪や死亡のリスクとなることを再認識させる結果であった.
本患者は認知症のため,治療方針は本人の意思推定が可能な家族と相談し,手術は行うが術後にCOVID-19感染症状が増悪した場合は気管内挿管・人工呼吸管理・心肺蘇生などは施行しない方針となった.事前に家族へ急性増悪の危険性について説明していたため,術後の急激な状態悪化においても,家族の戸惑いや混乱は少なかったと考えられた.COVID-19患者に緊急手術を計画する場合は,保存的加療や手術治療のリスク・ベネフィットの説明だけでなく,術後に肺炎が急激に増悪した場合を想定しアドバンス・ケア・プランニング(advance care planning)に準じて相談を行っておくことも重要と考えられる.
術式の選択については,腹腔鏡手術やロボット手術で腹腔内へCO2を注入することによりSARS-CoV-2ウイルスが飛散する恐れがあるものの,開腹手術を推奨する明確なエビデンスはない13)~16).ただし,腹腔鏡手術を選択する場合は,エアロゾルによる感染予防のために高精度フィルター(HEPA/ULPAフィルター)および排ガス装置などを使用し14)~16),超音波凝固切開装置や電気メスの使用を減らす,標本摘出時やトロッカーを抜去する前にはトレンデレンベルグ体位を解除し腹腔内を脱気する,気腹圧を低値にするなどの対策を行うことが必要である13)~16).本症例では,手術時間の短縮,手術後の腹腔鏡装置の清拭などの負担を考慮して開腹術を選択した.また,N95マスクを着用して手術を行ったが,手術時間が長時間となる場合には身体的負担が無視できないことから,電動ファン付き呼吸用保護具(powered air purifying respirator)などを準備しておくとよいと考えられた17)18).
COVID-19患者の治療としてさまざまな治療薬が試され,いくつかの薬剤が承認・使用されている.現在ではバリシチニブ,カシリビマブ/イムデビマブも日本で採用となっているが,本患者の入院当時は日本での採用はなく,主にステロイド19)とレムデシビル20)21)を使用していた.バリシチニブは,酸素投与と入院加療を必要とする中等症II以上の患者に対してレムデシビルを併用する場合に使用が認められている.カシリビマブ/イムデビマブはCOVID-19による感染症の重症化リスク因子を有し,酸素投与を要しない患者を対象に投与を行うことと規定されている4).本症例ではステロイドのみで治療を行ったが,残念ながら術後の急性増悪を防ぐことができなかった.また,バリシチニブ,カシリビマブ/イムデビマブの使用が可能な時期であったとしても,本症例は,カシリビマブ/イムデビマブについては酸素投与が必要な中等症IIであること,レムデシビルについては腎機能障害を認めることからあったためいずれも適応外4)であり,術後の急性増悪を防ぐことは困難であったと考えられた.
また,COVID-19の合併症として血栓症が知られているが,本症例はSLEを併存しており,抗リン脂質抗体症候群を合併している可能性があることから,血栓症のリスクは通常より高くなることが考えられた.実際に,術後2日目にDダイマーが35.39 μg/mlと高値となったため,ヘパリンカルシウムの皮下注射を開始した.
これまでの報告によるとCOVID-19患者の緊急手術症例では,術後30日以内の死亡率が25.6%とされる5).さらに,本症例では,死亡リスクの高い高齢かつ緊急手術症例であったこと5),COVID-19感染に加えて,小腸壊死・腹膜炎・急性腎不全・凝固系異常など多臓器にわたり障害がある状況であったことから,治療薬の選択にかかわらず術後死亡率は相応に高かったと考えられる.一方で,保存的加療では感染コントロールは困難であり手術は不可避であったと考えられる.COVID-19患者の手術は代替手段があれば避けるべきだが,緊急手術でしか救命できない疾患もある.その場合は,術前に本人,家族に手術のリスク・ベネフィット,COVID-19患者に手術を行った場合の術後呼吸不全などのリスクについて十分説明し,術後のCOVID-19感染症急性増悪時の対応についても話し合っておく必要がある.
術前に肺炎像を認めないCOVID-19患者に対して緊急手術を行ったが,術後に肺炎が急激に増悪し死亡した症例を経験した.COVID-19患者には極力手術介入を避けるのが望ましいが,救命のために手術が必要であれば,手術を行う場合と行わない場合でのメリット・デメリットとともに,術後に肺炎が急激に増悪した際に人工呼吸器装着などの治療を行うかなど,終末期の治療介入について十分に話を詰めておく必要がある.
利益相反:なし