2022 年 55 巻 8 号 p. 473-482
2022 年 55 巻 8 号 p. 473-482
目的:BRAF V600E変異陽性進行再発大腸癌は薬物療法の効果が乏しく極めて予後不良で,転移巣が切除可能でも切除すべきか否かの判断が難しい.BRAF変異大腸癌の治療成績から切除可能転移巣の手術適応について後ろ向きに検討した.方法:2016年から2020年に治療を開始したBRAF変異大腸癌14例を対象とした.一次治療の初回画像効果判定で,腫瘍がベースラインより縮小または不変の症例をcontrolled disease(以下,CDと略記)群(n=8),増大した症例をuncontrolled disease(以下,UDと略記)群(n=6)に分類し比較検討した.結果:経過観察期間中央値は39.7か月であった.全体の2年全生存率は35.7%で,CD群およびUD群ではそれぞれ50.0%および16.7%であった(P=0.051).転移巣根治切除を6例(42.9%)に施行し,4例で再発を来したが,1例は再転移巣切除を施行した.CD群では転移巣切除を行った3例中2例が無担癌生存中であるが,UD群の3例は全例で術後再発を来し,2例が術後3か月以内の早期再発であった.結語:BRAF変異大腸癌の予後予測因子として一次治療での初回病勢コントロール評価が有用である可能性が示唆された.たとえ切除可能であっても,一次治療での病勢コントロール不良例に対する転移巣切除の適応は慎重に考慮すべきである.
Purpose: Patients with metastatic colorectal cancer (mCRC) with BRAF V600E mutation have a poor response to standard cytotoxic agents and extremely poor outcomes. Thus, the optimal indication for metastasectomy remains debatable, even when the metastatic region is resectable. The aims of this retrospective study were to examine the outcomes of BRAF V600E mCRC, identify risk factors for poor survival, and establish the optimal surgical indication for resection. Materials and Methods: The subjects were 14 patients with BRAF V600E mCRC who started treatment in our department between December 2016 and April 2020. No patients underwent surgery prior to introduction of systemic chemotherapy. Patients were divided into two groups based on the initial response to first-line chemotherapy: controlled disease (CD, n=8) for tumors that shrunk or stabilized from baseline, and uncontrolled disease (UD, n=6) for tumors that increased in size. Results: The median follow-up period was 39.7 months. The 2-year overall survival rate was 35.7% in all patients, and was higher in the CD group than in the UD group (50.0% vs. 16.7%, P=0.051). Six patients (42.9%) underwent curative metastasectomy, of whom 4 developed recurrence and one underwent re-resection. In the CD group, 2 of 3 patients who underwent metastasectomy were alive without cancer, while all 3 patients in the UD group developed recurrence after metastasectomy and 2 had early recurrence within 3 months. Conclusion: This study suggests that evaluation of the initial response to first-line chemotherapy may be a useful prognostic factor in BRAF V600E mCRC. Even if a tumor is resectable, the indication for metastasectomy should be carefully considered in cases with poor disease control in the initial response.
薬物治療や手術手技の発達により,進行再発大腸癌の全生存期間(overall survival;以下,OSと略記)中央値は30か月を越えているにもかかわらず1),一部の患者はいまだ治療抵抗性を示し予後不良である.BRAF遺伝子はRaf蛋白をコードし,変異により上皮増殖因子受容体(EGFR)の主要なシグナル伝達経路の一つであるRAS/Raf/MAPK経路のシグナル伝達を活性化させると考えられている癌遺伝子であり2),本邦では大腸癌の4.5~6.7%にBRAF V600E遺伝子変異を認める3).BRAF V600E変異陽性進行再発大腸癌(以下,BRAF大腸癌と略記)はBRAF V600E野生型大腸癌と比較して薬物療法の効果が乏しく,OS中央値は7.2~15.2か月と極めて不良な予後が報告されており4)~6),日常診療でBRAF大腸癌に対する化学療法レジメンの選択や転移巣切除の適応について判断に悩むことは少なくない.
切除可能な進行再発大腸癌に対しては外科的切除を考慮するのが一般的である7).当科ではBRAF大腸癌の転移巣切除後の高い早期再発率を考慮し8)9),転移巣切除を考慮する場合には術前に化学療法を行うことを基本としてきた.それでもなお,術後早期に再発を来し予後不良である症例は少なくないが,一方で長期生存例も存在する.そこで,BRAF大腸癌の予後を左右する臨床的特徴を明らかにし,切除可能転移巣の至適な切除適応についての検討が必要と考えた.
BRAF大腸癌症例の治療成績を後方視的に検討して長期生存例の臨床的特徴を明らかにし,転移巣の至適な切除適応について検討した.
2016年12月から2020年4月に当科で治療を開始した進行再発大腸癌121例のうち,BRAF V600E野生型92例およびBRAF V600E変異不明15例を除いた,BRAF V600E変異型14例を対象とした.
2. データ収集患者背景,病理学的所見,画像所見,治療法と成績,転帰に関するデータをカルテ記載より収集し,後方視的に検討した.治療期間中,病勢は2~3か月ごとのCTで評価を行った.
3. 一次治療の画像評価一次治療導入後1~3か月(中央値1.7か月)で,CTによる初回評価を行った.通常のRECIST判定とは別に,stable disease(以下,SDと略記)をベースラインから少しでも縮小または不変の病変をgood-SD,少しでも増大した病変をbad-SDに分け,さらにpartial response(以下,PRと略記)とgood-SDをCD群(8例,57%),progressive disease(以下,PDと略記)とbad-SDをUD群(6例,43%)の2群に分け,比較検討した.治療継続中は以降も2~3か月ごとにCTでの評価を繰り返した.
4. 切除可能性治療開始前に全ての転移・再発巣の切除可能性を臓器(部位)毎に評価した.切除可能性は腫瘍学的側面を考慮せず,外科医の技術的および患者の身体的側面から安全にR0切除可能か否かで,切除可能,切除不能および境界病変の3群に分類した.切除可能とは周囲臓器または主要脈管への浸潤を認めず,技術的に容易にR0切除が見込まれるもの,切除不能とは技術的にR0/1切除ができないと判断したもの,それ以外は境界病変とした.具体的には,肝転移は4個以内で主要脈管に浸潤を認めないものを切除可能とし,腹膜播種や遠隔リンパ節転移では切除可能は設けず,技術的に切除可能と判断した病変を境界病変とした.また,肺転移では片側3個以内を切除可能の条件とした.切除可能性はCTごとに繰り返し評価を行った.
5. 統計群間の比較はFisherの正確検定またはMann-Whitney U検定を用いて行った.OSは治療開始日を起点としてKaplan-Meier法で算出し,log-rank検定を用いて評価した.統計学的有意差は5%未満を有意差ありとした.解析にはSPSS software program version 27.0(IBM Japan Ltd., Tokyo, Japan)を用いた.
研究期間中の進行再発大腸癌でのBRAF V600E変異率は13.2%であった.全14例の背景および治療成績をTable 1に示す.治療開始時の年齢は中央値で67(37~74)歳,男女比は1:1で,原発部位は右側が8例(57.1%)であった.8例がステージIV症例で,うち4例で薬物治療に先立ち原発巣切除を行い,その他6例は根治切除後の再発症例であった.転移・再発巣は重複を含み,肝臓7例,遠隔リンパ節7例,腹膜播種4例,肺1例,局所再発1例であった.治療前CTにおいて,全ての転移・再発巣が切除可能な症例は2例(14.3%),境界病変が4例(28.6%)で過半数の8例(57.1%)が切除不能と判定された.
| Case | Age | Sex | Primary site | Primary stage | Recurrent or metastatic site | Timing of metastases | Timing of BRAF mutation testing | Upfront primary resection | Primary depth of invasion | Pathologic type | MSI status | 1st-line regimen | Initial response | Best response | Curative resection | Re-recurrence | OS (months) | Outcome |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 68 | M | Ascending | IV | Liver (R), PALN (UR) | Synchronous | Before 1st-line introduction | Yes | pT4a | Por | High | Pembro* | PD | PD | No | — | 5.9 | Died |
| 2 | 66 | F | Cecum | IIIB | Liver (MR) | Recurrence after curative resection | After 1st-line introduction | — | pT3 | Tub2 | MSS | FOLFOX+BEV | Good-SD | SD | Yes | Yes | 51.6 | Alive with cancer |
| 3 | 37 | F | Tranverse | IV | Liver (UR), PALN (UR), DLN (UR) | Synchronous | After 1st-line introduction | Yes | pT4a | Por | MSS | FOLFOX+BEV | Good-SD | SD | No | — | 14.2 | Died |
| 4 | 67 | F | Ascending | II | Liver (MR) | Recurrence after curative resection | After 1st-line introduction | — | pT3 | Tub2 | Unkown | CAPOX | Bad-SD | SD | Yes | Yes | 8.4 | Died |
| 5 | 69 | F | Tranverse | IIIA | DLN (UR) | Recurrence after curative resection | After 1st-line introduction | — | pT4a | Muc | High | FOLFIRI+AFL | PR | PR | Yes | No | 42.0 | Alive without cancer |
| 6 | 62 | F | Upper rectum | IV | Liver (UR), PALN (UR), peritoneum (UR) | Synchronous | After 1st-line introduction | Yes | pT4a | Por | Unkown | FOLFOX+Cmab | PD | PD | No | — | 4.0 | Died |
| 7 | 74 | M | Cecum | IV | Localized peritoneum (MR) | Recurrence after curative resection | After 1st-line introduction | — | pT4a | Tub2 | MSS | FOLFIRI+RAM | Good-SD | SD | Yes | No | 37.3 | Alive without cancer |
| 8 | 50 | M | Sigmoid | IV | Liver (MR) | Synchronous | Before 1st-line introduction | No | ypT3 | Muc | MSS | FOLFOXIRI | PD | PD | Yes | Yes | 16.8 | Died |
| 9 | 64 | M | Ascending | II | Peritoneum (UR) | Recurrence after curative resection | Before 1st-line introduction | — | pT4a | Tub2 | MSS | FOLFOXIRI+BEV | Good-SD | SD | No | — | 29.3 | Alive with cancer |
| 10 | 73 | F | Low rectum | IIIA | Local recurrence (R), Lateral LN (R) | Recurrence after curative resection | After 1st-line introduction | — | pT4a | Muc | MSS | FOLFOX+BEV | Good-SD | SD | No | — | 15.5 | Died |
| 11 | 63 | M | Middle rectum | I | Lung (UR) | Recurrence after endoscopic resection | After 1st-line introduction | No | pT1 | Tub1 | MSS | CAPOX+BEV | PR | PR | No | — | 22.9 | Died |
| 12 | 65 | M | Ascending | IV | Liver (UR) | Synchronous | Before 1st-line introduction | Yes | pT3 | Por | MSS | FOLFOXIRI+BEV | Bad-SD | SD | No | — | 15.5 | Died |
| 13 | 48 | F | Sigmoid | IV | PALN (MR) | Synchronous | After 1st-line introduction | No | ypT3 | Tub1 | MSS | CAPOX+BEV | Bad-SD | SD | Yes | Yes | 26.2 | Died |
| 14 | 65 | M | Middle rectum | IV | PALN (UR), Peritoneum (UR) | Synchronous | After 1st-line introduction | No | cT4b | Por | MSS | FOLFOXIRI+BEV | PR | PR | No | — | 7.7 | Died |
* clinical trial
Tub1, well differentiated; Tub2, moderately differentiated; Muc, mucinous; Por, poorly differentiated; MSI, microsatellite instability; MSS, microsatellite stable; R, resectable; UR, unresectable; MR, marginally resectable; PALN, paraaortic lymph node; DLN, distant lymph node; BEV, bevacizumab; AFL, aflibercept; RAM, ramucirumab; Cmab, cetuximab; Pembro, pembrolizumab; OS, overall survival
Good-SD: reduced or maintained in SD; Bad-SD: enlarged in SD
一次治療として,doubletレジメンを9例(64.3%),tripletレジメンを4例(28.6%)に導入し,microsatellite instability-high(以下,MSI-Hと略記)の1例は臨床試験としてpembrolizumab(以下,Pembroと略記)を投与した.分子標的薬として血管新生阻害剤を10例(71.4%)に追加した.初回評価CTにおけるRECIST判定はPR 3例,SD 8例,PD 3例で,SD中,good-SDが5例,bad-SDが3例であった.一方,その後の最良評価が初回評価を上回る症例は認めなかった.6例(42.9%)に転移巣の根治切除を施行し,内訳は肝臓3例,遠隔リンパ節2例,限局腹膜播種1例であった.転移巣切除症例の詳細をTable 2に示す.R0,R1切除はそれぞれ4例,2例であった.術前化学療法の組織学的効果判定はGrade 3を2例に認めた.4例で再々発を来したが,うち1例で再転移巣切除を施行した.症例2では肝転移術後から1年11か月後に右卵巣転移を認め,両側付属器切除を施行した.しかし,術後9か月で肺転移を認めた.転移巣切除前のCEA,CA19-9値は再々発群ではそれぞれ中央値で8.3(1.3~22.3)ng/ml,210(19~1,421)U/mlと,無再発症例での3.5(1.2~5.7)ng/ml,26(10~42)U/mlと比較し,それぞれ高い傾向を認めた(P=0.355,0.165).打ち切り症例の経過観察期間中央値は39.7か月で,全体での1年および2年OSはそれぞれ71.4%,35.7%であった.OS中央値は15.5か月であった(Fig. 1).
| Case | Recurrent or metastatic site | Details of metastatic site | Number of metastatic lesions | Pre-metastasectomy CEA (ng/ml) | Pre-metastasectomy CA19-9 (U/ml) | Surgical procedure | Pathological number of lesions | R0/R1 resection | Histological effect of chemotherapy | Re-recurrence | Re-recurrenct site | Duration from metastasectomy to re-recurrence (months) | Re-metastasectomy | Re-re-recurrence | OS (months) | Outcome |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | Liver (MR) | S1, S2, S5, S6, S7, S8 | 7 | 1.3 | 19 | Hepatectomy (Posterior segment, S5, S1l, partial (S2, S8)) | 0 | R0 | Grade 3 | Yes | Right ovary | 23.0 | Yes | Yes | 51.6 | Alive with cancer |
| 4 | Liver (MR) | S1, S3, S4, S5, S6, S7, S8 | 14 | 14.6 | 1,421 | Hepatectomy (S3, S5, partial (S1, S4, S6, S7, S8)) | 13 | R1 | Grade 1a | Yes | Liver, Lung, DLN | 3.2 | No | — | 8.4 | Died |
| 5 | DLN (UR) | Left supraclavicular lymph node | 1 | 5.7 | 42 | Lymphadenectomy | 0 | R0 | Grade 3 | No | — | — | — | — | 42.0 | Alive without cancer |
| 7 | Localized peritoneum (MR) | Right upper quadrant Pelvis |
Several | 1.2 | 10 | Peritoneal dissemination resection | 10 | R0 | Grade 2 | No | — | — | — | — | 37.3 | Alive without cancer |
| 8 | Liver (MR) | S2, S4, S5, S6, S8 | 8 | 22.3 | 76 | Partial hepatectomy (S2, S4, S5, S6, S8) | 10 | R0 | Grade 1a | Yes | Liver, PALN, DLN | 2.0 | No | — | 16.8 | Died |
| 13 | PALN (MR) | PALN | Bulky | 2.0 | 343 | PALN dissection | 3 | R1 | Grade 2 | Yes | Peritoneum, DLN, Lateral LN | 7.1 | No | — | 26.2 | Died |
R, resectable; UR, unresectable; MR, marginally resectable; DLN, distant lymph node; PALN, paraaortic lymph node; CEA, carcinoembryonic antigen; CA19-9, carbohydrate antigen 19-9; OS, overall survival

Overall survival rates in patients with mCRC with BRAF V600E mutation.
初回画像判定によるCD群(n=8)およびUD群(n=6)の患者背景をTable 3に示す.2群間で血管新生阻害剤の使用のみ有意差を認めたが,他に背景因子や治療法に有意差を認めなかった.CD群の1年および2年OSはそれぞれ87.5%および50.0%であった一方,UD群の1年および2年OSはそれぞれ50.0%および16.7%と不良で(P=0.051),OS中央値はCD群の22.9か月と比較してUD群では8.4か月と予後不良の傾向であった(Fig. 2).CD群の3例に転移巣切除を施行した.うち1例で再発を認め再転移巣切除を行ったが,その後再度再発を来した.他の2例は無担癌生存中である.一方,UD群でも3例で転移巣切除を施行したが,全例で再発を来し,うち2例が術後3か月以内の早期再発であった.転移巣切除前のCEA,CA19-9値はUD群ではそれぞれ中央値で14.6(2.0~22.3)ng/ml,343(76~1,421)U/mlと,CD群での1.3(1.2~5.7)ng/ml,19(10~42)U/mlと比較し,それぞれ高い傾向を認めた(P=0.127,0.050).転移巣切除症例のOSはUD群で有意に予後不良であった(P=0.025)(Fig. 3).
| Variables | Total n=14 |
CD group n=8 |
UD group n=6 |
P value* |
|---|---|---|---|---|
| Age | 65.0 (37–74) | 65.5 (37–74) | 63.5 (48–68) | 0.332 |
| Sex | 1 | |||
| Men | 7 (50.0) | 4 (50.0) | 3 (50.0) | |
| Women | 7 (50.0) | 4 (50.0) | 3 (50.0) | |
| Primary site | 1 | |||
| Right-sided | 8 (57.1) | 5 (62.5) | 3 (50.0) | |
| Left-sided | 6 (42.9) | 3 (37.5) | 3 (50.0) | |
| Primary stage | 0.231 | |||
| I | 1 (7.1) | 1 (12.5) | 0 | |
| II | 2 (14.3) | 1 (12.5) | 1 (16.7) | |
| III | 3 (21.4) | 3 (37.5) | 0 | |
| IV | 8 (57.1) | 3 (37.5) | 5 (83.3) | |
| Site of metastatic disease | ||||
| Liver | 7 (50.0) | 2 (25.0) | 5 (83.3) | 0.103 |
| Para-aortic LNs | 5 (35.7) | 2 (25.0) | 3 (50.0) | 0.580 |
| Peritoneum | 4 (28.6) | 3 (37.5) | 1 (16.7) | 0.580 |
| Distant LNs | 2 (14.3) | 2 (25.0) | 0 | 0.473 |
| Lung | 1 (7.1) | 1 (12.5) | 0 | 1 |
| Local (in the pelvis) | 1 (7.1) | 1 (12.5) | 0 | 1 |
| Number of the metastatic site | 0.922 | |||
| 1 | 9 (64.3) | 5 (62.5) | 4 (66.7) | |
| 2 | 3 (21.4) | 2 (25.0) | 1 (16.7) | |
| 3 or more | 2 (14.3) | 1 (12.5) | 1 (16.7) | |
| Resectability of the metastatic disease | 0.332 | |||
| Resectable | 2 (14.3) | 2 (25.0) | 0 | |
| Marginally resectable | 4 (28.6) | 1 (12.5) | 3 (50.0) | |
| Unresectable | 8 (57.1) | 5 (62.5) | 3 (50.0) | |
| Metastasectomy | 1 | |||
| Presence | 6 (42.9) | 3 (37.5) | 3 (50.0) | |
| Absence | 8 (57.1) | 5 (62.5) | 3 (50.0) | |
| Initial chemotherapy regimen | ||||
| Oxaliplatin-based | 7 (50.0) | 4 (50.0) | 3 (50.0) | 1 |
| Irinotecan-based | 2 (14.3) | 2 (25.0) | 0 | 0.473 |
| Triplet | 4 (28.6) | 2 (25.0) | 2 (33.3) | 1 |
| PD-1 | 1 (7.1) | 0 | 1 (16.7) | 0.429 |
| VEGF | 10 (71.4) | 8 (100) | 2 (33.3) | 0.015 |
| EGFR | 1 (7.1) | 0 | 1 (16.7) | 0.429 |
* CD group vs. UD group
CD, controlled disease. UD, uncontrolled disease

Overall survival rates in cases with controlled and uncontrolled disease.
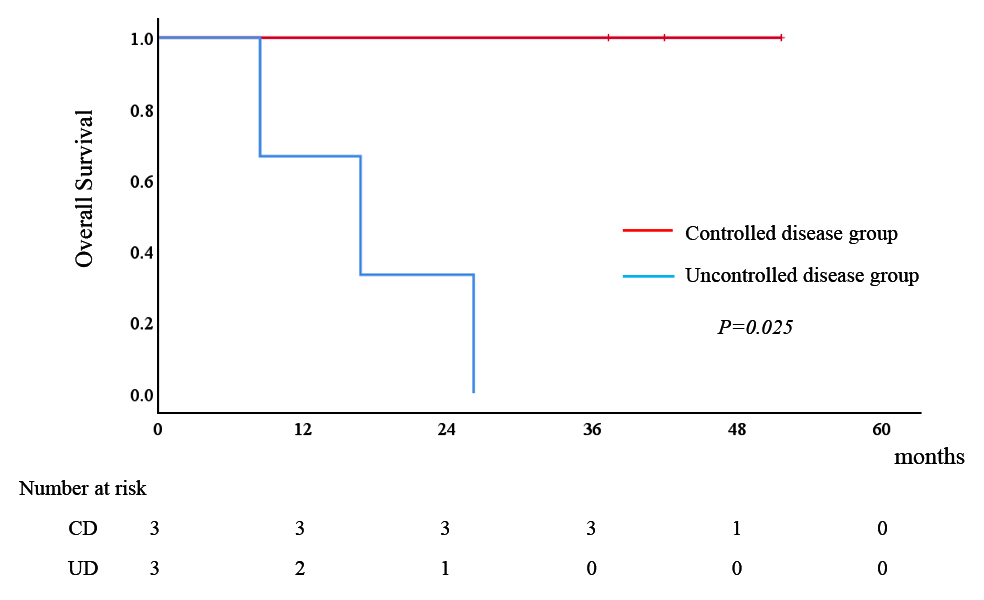
Overall survival rates in cases with controlled and uncontrolled disease that underwent metastasectomy.
BRAF大腸癌の一次治療における奏効率は15.2~56.3%と報告されている10)~14).Doubletレジメンよりtripletレジメンが比較的奏効率は高いが,それでもBRAF野生型と比較すると薬物治療が著効する症例は少ない.本検討においても最良評価がPRであった症例はわずか3例(21.4%)にとどまり,2回目以降の判定で初回判定を上回る症例を認めなかった.また,初回判定がPDという治療効果に極めて乏しい症例も3例(21.4%)に認めた.一方,画像評価ではRECIST判定を用いるのが一般的であるが,SDとは大きな変化を示さない病変を示すものの,その内容は径和が30%縮小から20%増大までと幅広く,縮小病変と増大病変が同じSDの範疇に分類されている.そこでSDをgood-SDとbad-SDに分けることで,腫瘍が縮小したCD群と増大したUD群の2群に分類し検討したところ,UD群のOSは極めて不良で,症例数が少ないため統計学的有意差は示せなかったものの,CD群と比較して不良な傾向を認めた.初回画像判定でたとえSDであっても,bad-SDの場合はPDと同様な強い危機感を持つ方が良さそうである.本研究期間は,BRAF阻害剤の保険承認前であり使用していないが,BEACON trial15)においてBRAF大腸癌に対する二次治療での有効性が示され,保険承認されている現在,bad-SD症例,特に切除可能病変を有する場合は,機を逸することなくBRAF阻害剤に切り替える戦略が望ましいと考える.また,症例5はMSI-Hであったが,BRAF大腸癌患者においてMSI-Hはmicrosatellite stableに比べ,比較的良好な予後が期待できるとされている16).KEYNOTE-177試験17)ではMSI-HにおいてBRAF V600E変異型または野生型にかかわらず,無増悪生存期間はdoubletレジメン群と比較してPembro群で有意に延長していた.当時は一次治療に免疫チェックポイント阻害剤が臨床試験としてしか使用できなかったが,保険収載された現在,MSI-Hに対しては一次治療からPembroを投与するのが望ましい.
進行再発大腸癌の治療戦略において,切除可能病変に対しては積極的に外科的切除を行うことがガイドラインにおいても推奨されている7).さらに近年では,切除可能病変のみならず,薬物療法に著効した切除不能病変に対するconversion手術後の良好な成績も示されている18).一方,切除可能BRAF大腸癌は診断時に多発転移を伴うことが多いため外科切除の対象となる症例は少なく,肝切除例全体中のBRAF V600E陽性率はわずか2%と報告されている9).BRAF大腸癌肝転移の切除成績はBRAF野生型と比較し,OS・無再発生存率とも悪いとする報告が多く,切除に際しては適応を熟考する必要がある(Table 4)8)9)19)~21).また,大腸癌はもとより固形癌において,転移巣に対する化学療法の効果から至適な手術適応を検討した報告は極めて少なく,Medinaら22)は悪性黒色腫における転移巣切除において,化学療法が奏効し切除を施行した患者のOSは良好であったが,化学療法が奏効せず切除を施行した患者のOSは改善されなかったと述べている.本研究においては6例(42.9%)で遠隔転移切除を施行したが,CD群の3例は2例無担癌生存中であるのに対し,UD群の3例は高率に早期再発を来し,予後は極めて不良であった.薬物療法を先行させ,初回画像判定で手術適応を判断することは有用な可能性があり,治療効果を示さないUD病変に対する手術は,たとえ技術的に切除可能であったとしても,切除の適応は慎重に判断すべきである.また,転移巣切除前のCEA,CA19-9値も再々発群およびUD群でそれぞれ高い傾向を認め,手術適応決定の一助となるかもしれない.
| No. | Author | Year | Number V600E/non V600E/unknown | Follow-up duration (months) | Proportion of preoperative chemotherapy (%) | RFS (months) | OS (months) |
|---|---|---|---|---|---|---|---|
| 1 | Schirripa8) | 2015 | 12/0/0 | 45.6 (median) | 0 | 5.7 | 23 |
| 2 | Margonis19) | 2018 | 33/6/4 | 28.3 (median) | 48.8 | 9.9 | 26 |
| 3 | Bachet20) | 2019 | 55/11/0 | 28.7 (mean) | 77.3 | 10 | 53 |
| 4 | Kobayashi21) | 2020 | 33/0/0 | 49.2 (median) | 21.2 | 5.3 | 31 |
| 5 | Gagnière9) | 2020 | 25/9/1 | 57 (median) | NA | 10 | 40 |
CRLM, colorectal liver metastases; RFS, relapse-free survival; OS, overall survival; NA, not available
初回判定によるCD群とUD群への分類や術前腫瘍マーカー高値が,予後予測因子や手術適応判断因子となりうるか否か,本研究は少数例での後ろ向き研究かつ観察期間が短く,単一施設の検討で一次治療のレジメンが異なるなど,断定的な結論を出すことは困難である.症例数の少ないBRAF大腸癌の単施設での検討には限界があり,多施設・多数例での大規模観察研究が望まれる.また,本研究では評価できていない,BRAF阻害剤併用レジメンによるOS延長や腫瘍縮小効果も評価しなくてはならない.一方,近年の遺伝子解析の進歩により,BRAF V600Eといっても均一な集団ではなく,BM1サブタイプではCMS4タイプが多く,予後不良であると報告されている23)24).CD群・UD群という初期病勢コントロールによる分類とこうした遺伝子サブタイプとの関連性を突き止めることは,さらなる手術適応の至適化に役立つと考える.
利益相反:なし