2020 年 31 巻 1 号 p. 66-70
2020 年 31 巻 1 号 p. 66-70
アプタマー(aptamer)とは標的に特異的に結合する分子を指す,ラテン語のaptus(適合)とギリシャ語のmeros(部分)を合わせた造語である.大別してペプチドアプタマーと核酸アプタマーがあるが,医薬品への応用を目指して開発されているものは後者が多い.核酸アプタマーは一本鎖のDNAまたはRNAから構成されるが,他の核酸医薬品と異なり,細胞内でmRNAやゲノムDNAとのハイブリダイゼーションにより薬効を発揮する作用機序ではなく,抗体と同様に立体構造に依存した標的(タンパク質や細胞)との結合に基づき,主に細胞膜上や細胞外で作用を発揮する.すなわち,元々一本鎖のDNA/RNAが分子内で相補配列に依存して熱力学的に安定な固有の立体構造を形成することで,標的分子に特異的に結合する物質(アプタマー)となる(図1).この原理から,アプタマーは別名「合成抗体」,「化学抗体」あるいは「核酸抗体」などと,核酸医薬品の一形態でありながらしばしば抗体と対比して語られる.
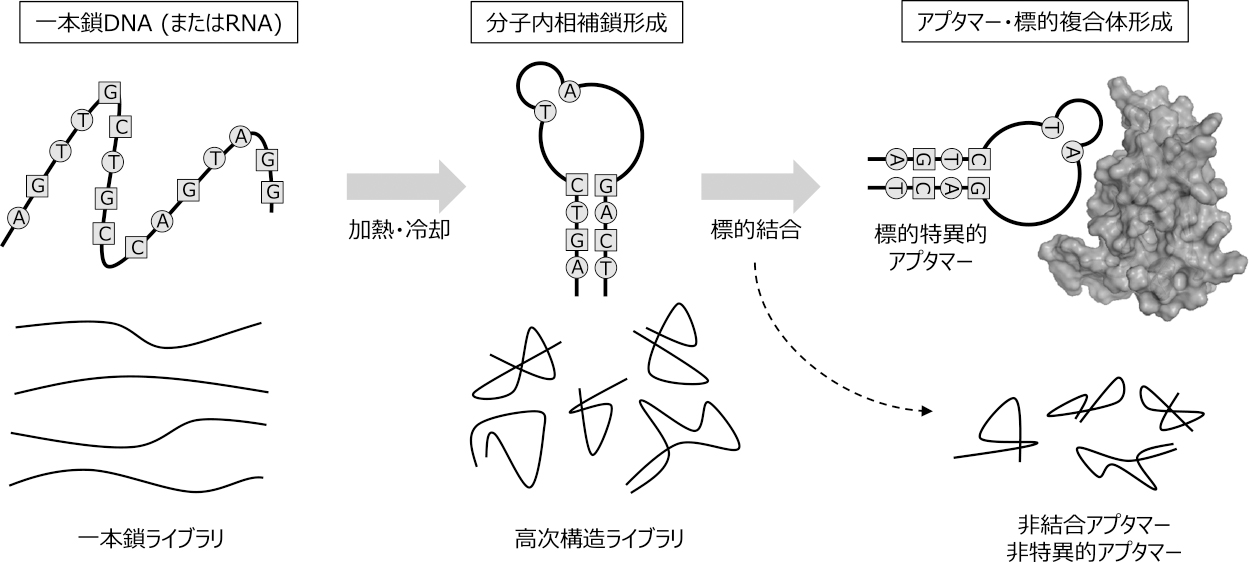
核酸アプタマーの原理
アプタマーの歴史は新しいものではなく,その作製(ライブラリーからの選出)法であるSELEX法(systematic evolution of ligands by exponential enrichment)は1990年に報告され1, 2),それ以降この概念を応用した様々なアプタマー取得法が考案されてきており,低分子から細胞に結合するものまで,興味深いアプタマーが様々な用途で開発されている.
2004年に滲出型加齢黄斑変性症の治療薬として血管内皮増殖因子に対するアプタマーであるpegaptanib sodium(Macugen®)が世界初のアプタマー医薬品として承認を受け,アプタマー医薬の実用性が示され,以後様々なアプタマー医薬品の開発が進められている.アプタマー創薬の対象疾患は眼科疾患での開発が多いが,その他,がん,炎症,疼痛,自己免疫,骨関節などの多岐に渡る疾患が対象となっている.中でも,血液凝固系疾患に関連したアプタマーはこれまでに6剤が臨床開発されており,後述する理由からもアプタマーがとりわけ有用である標的疾患として考えられている(表1)3–9).
| Aptamers [Ref] | Lead company | Target | Length | Modification | Structure | Phase |
|---|---|---|---|---|---|---|
| HD1 [4] | Archemix and Nuvelo | Thrombin (ExositeI) | 15 nt DNA | none | G-quadruplex | 1 |
| ARC183 [5] | Archemix and Nuvelo | Thrombin | 15 nt DNA | none | G-quadruplex | 1 |
| NU172 [6] | Archemix Corp. | Thrombin (ExositeI) | 26 nt DNA | none | G-quadruplex | 2 |
| ARC1779 [7] | Archemix | VWF (A1domain) | 39 nt DNA/RNA | 2ʹ-O-methyl-nucleotides 5ʹ/3ʹ-end(5ʹ:PEG/3ʹ:idT) |
Stem-Loop | 2 |
| ARC1172 [8] | Archemix | VWF (A1domain) | 41 nt DNA | none | Stem-Loop | 1 |
| REG-1 [9] | Regado Biosciences | FIXa | 30 nt RNA | 2ʹ-ribopurine/2ʹ-fluoropyrimidines 5ʹ/3ʹ-end (5ʹ:PEG/3ʹ:idT) | Stem-Loop | 2 |
Note: PEG: polyethylene glycol; idT: inverted deoxythymidine.
W Li et al.の論文3)より引用
アプタマー作製法であるSELEX法とは,まず数十から50残基ほどのランダム配列を持つ一本鎖DNA/RNAを合成し,それを加熱・冷却(アニーリング)することで相補配列に基づく三次元構造を形成した膨大な多様性のあるライブラリーを構築する.ここへ標的(タンパク質や細胞)を添加し,結合した配列を回収,PCRで増幅する(RNAアプタマーの場合は逆転写反応を経る).その後,再度単鎖にし(RNAアプタマーの場合はDNAからRNAに転写して)アニーリング操作により立体構造を形成させ,特異的および非特異的結合能を有するアプタマーで構成される二次ライブラリーを構築,再度標的を添加し,同様の工程を数回~十数回繰り返す.この反復の過程で反応条件をより厳しくしていくことで結合親和性および特異性の高いアプタマーを作製することが可能となる.
前述の通り,アプタマーは抗体と同様,標的タンパク質への特異的結合により機能するため,様々な用途への応用が可能である.しかしながら抗体同様,アプタマーの投与方法はこれまで静脈内あるいは局所への注射に限られており,より簡便な投与方法の開発が望まれている.
1)アプタマーの利点抗体との対比で見たアプタマーならではの利点がある.
通常,アプタマーは抗体に比較して血中半減期が極めて短い.一般に抗体は週に数回投与から月1回投与までと,半減期が長いために投与間隔を延ばすことが可能である.その反面,体内から抗体を除去することは難しいため,血液凝固因子に対する抗体などで投与後に何らかの理由で出血が起きた場合でも,薬理学的な中和は困難である.
アプタマーは何ら分子修飾を施していない場合,腎クリアランスが極めて早いため血中半減期は短く,標的分子に結合していないフリーのアプタマーは,数分~15分程度で尿中に排泄される.しかし,ポリエチレングリコール(PEG)修飾やその他のエンジニアリング手法により血中半減期を延ばすことが可能であり,対象疾患に合った投与間隔を設定することができる.
さらに,アプタマーではより積極的に薬効を中和するための薬剤開発も抗体に比べ容易である.アプタマーは核酸で構成されているため,その部分配列に相補的に結合する短鎖の核酸を用いることで,標的への結合部位に拮抗させたり,アプタマーの構造自体を変化させることによって薬効の中和が可能となるからである.このような中和剤を用意できることは血液凝固系疾患の治療薬開発にとって,とりわけ有用であろう.
治療用として投与される抗体は元来生体にとっては異物であり,しばしば抗原となって患者体内で抗薬物抗体(anti-drug antibody: ADA)が生じ,治療が制限されることがある.アプタマーは合成中分子であるため一般にADAが生じないとされており,長期投与や反復投与時に薬効の減弱やアナフィラキシーが生じない等の面でも抗体に比べ安全性が高い.
抗体の作製・製造は生物学的手法に基づくため,性能(特異性・親和性)の高いもの,品質が安定したものを製造するためには長い時間を要し,それに伴いコストも高くなる.一方でアプタマーは作製から製造まで生物学的な工程を要さず,短期間で作製でき,またロット間での品質が安定しているなどの利点がある.
2)医薬品への応用血液疾患に対するアプタマーの開発例は多い.最も先駆的な試みは米国Archemix社(既に解散)による抗トロンビンアプタマーARC183であった.血中半減期が短いため薬効のコントロールがしやすく,ヘパリンやその解毒剤であるプロタミンによる副作用が回避できる等,ヘパリンの問題点を解決できるとして期待されていたが,臨床試験で期待した薬効を示せず,開発は中断された.その後,同社は米国Nuvelo社(後にARCA Biopharma社が買収)と共に,より優れた薬効を期待した第2世代の抗トロンビンアプタマーとしてNU172を開発したが,臨床第II相試験を開始したものの現時点で開発の進捗は見られない(NCT00808964).
REG1(米国Regardo Biosciences社,既に解散)も同様に血液凝固阻害活性を示すアプタマーとして第IXa因子を標的に開発された.本剤は,治療効果を期待した薬効本体RB006(30塩基)に加えて,前述の通りアプタマーの利点を活かし,相補的に結合するオリゴヌクレオチドRB007(15塩基)を「中和剤」として同時に開発された点が注目を集めた薬剤であった.しかしながら,これらの薬剤開発も途中で中断されている.
タグシクス・バイオ(株)はフォン・ヴィレブランド因子(von Willebrand factor: VWF)に対するアプタマーを血栓性血小板減少性紫斑病(thrombotic thrombocytopenic purpura: TTP)あるいは急性肝不全症候群の治療薬候補として開発している10).本アプタマーは独自の人工核酸塩基を導入することで標的タンパク質への結合親和性および特異性を向上させたユニークなDNAアプタマーであり,先行して開発されていたARC1779(米国Archemix社)と同様にVWF-A1ドメインを認識しながら,in vitroでは異なる薬理作用が認められている(図2)11).TTPの治療薬としては2価ナノボディ(ヒト化単一可変領域免疫グロブリン)であるCaplacizumab(Cablivi®,仏Sanofi社)が既に欧米で承認・市販されているが,緊急手術や出血等の発生時に用いることができる中和剤がないため,TAGX-0004が中和剤と共に開発されれば,興味深い差別化となるであろう.

新規人工核酸DNAアプタマーTAGX-0004とARC1779の各種凝固因子による血小板凝固作用とT-TAS®法による血栓形成に対する抑制効果11)
これまでのアプタマーは単量体として用いられることが多かったが,合成により容易に二量体化することも可能である.よって,Cablivi®のように二量体化により活性を向上させることや,Emicizumab(Hemlibra®,中外製薬)のような二重特異性抗体と同様に二重特異性アプタマーを作製することが可能となる.さらに抗体に比べ,2つのアプタマーの空間的配置はリンカーの長さや種類を任意に変えることで自由に調整可能であるため,抗体とは異なる効果も期待できる.
3)デリバリーツールとしての応用アプタマーに低分子や抗体,他の核酸医薬品を結合し,狙った細胞あるいは組織にターゲティングする試みも多く報告されている.同様な手法は抗体薬物複合体(antibody-drug conjugate: ADC)として既に治療に役立っているが,抗体をアプタマーに置き換えることで,薬剤コストの低減が可能と考えられる.
4)医療機器としての応用血液浄化の目的で臨床では様々な吸着機構のアフェレシスカラムが利用されている.疎水結合や静電相互作用,あるいはポリミキシンB等により「選択的な吸着」が謳われているが,実際には血中タンパク質の多くが非特異的に担体に吸着し,病因物質のみをターゲティングしたものでは無い.抗体等を捕捉物質として利用する試みもあるが,万が一抗体が支持体から離脱して体内に移行した場合,その半減期の長さ故に予期せぬ副作用の恐れがある.
アフェレシスカラムにアプタマーを用いた場合,抗体と同様の選択性で標的物質を捕捉することが可能であるのみならず,万が一支持体から外れて体内に移行した際にも,血中半減期の短さ故に容易に体外に排出される,あるいは核酸分解酵素により分解されるなど,安全性の面でも有用であると考えられる.今後,病因物質を特異的に吸着・除去するデバイスの開発が進められれば,新たな治療選択肢になるであろう.
アプタマー創薬はこれまで幾多の試みがなされてきたが,その成果は決して華々しいと言えるものではない.一方で,これまでアプタマー創薬の障害の一つとされてきたSELEX法の特許が2015年に満了し誰もが自由にアプタマーを利用できるようになり,アプタマー創薬を手掛ける会社も増えつつある.アプタマーの開発はこれまでのような単量体にとどまらず,薬物との複合体(aptamer-drug conjugate: ApDC)や二重特異性のアプタマー,アプタマーと抗体の複合体など,様々なアプローチが試みられている.
生物製剤は近年,二重特異性抗体やナノボディに見られるように,より複雑化してきており,薬剤費が高騰し治療コストを増加させる原因の一つとなっている.アプタマーは品質を下げること無く低コストで製造が可能であり,医療経済への貢献も期待される.
今後数年以内にこのような新たな形態のアプタマーがどの程度有用性を示せるか,非常に興味深い.
役員・顧問職・社員など(タグシクス・バイオ株式会社)