2022 年 33 巻 3 号 p. 338-346
2022 年 33 巻 3 号 p. 338-346
新型コロナウイルス(SARS-CoV-2)を病原体とする新型コロナウイルス感染症(以下COVID-19)は,2019年末の中国武漢市に端を発し,瞬く間に全世界へと広がった.2022年2月までに5億7千万人以上の感染者と772万人以上の死者を出している.2年以上が経過した現在においても,本新興感染症の疾病負荷についての認識は混沌としており,医療リソースの逼迫といった医療現場への影響だけでなく,蔓延防止のための隔離や飲食店の営業短縮要請など,社会経済活動への影響も甚大である.一方,2021年2月より日本では主にmRNAワクチンが導入され,現時点で人口の80%近くがワクチン2回接種を完了し免疫学的にナイーブな状態を脱した.これにより,ウイルス性肺炎をベースとした急性呼吸窮迫症候群(acute respiratory distress syndrome: ARDS)に代表される重症化1)といった流行初期の恐れを次第に払拭し,新興感染症との共存に舵を切って進んでいる状況にある.
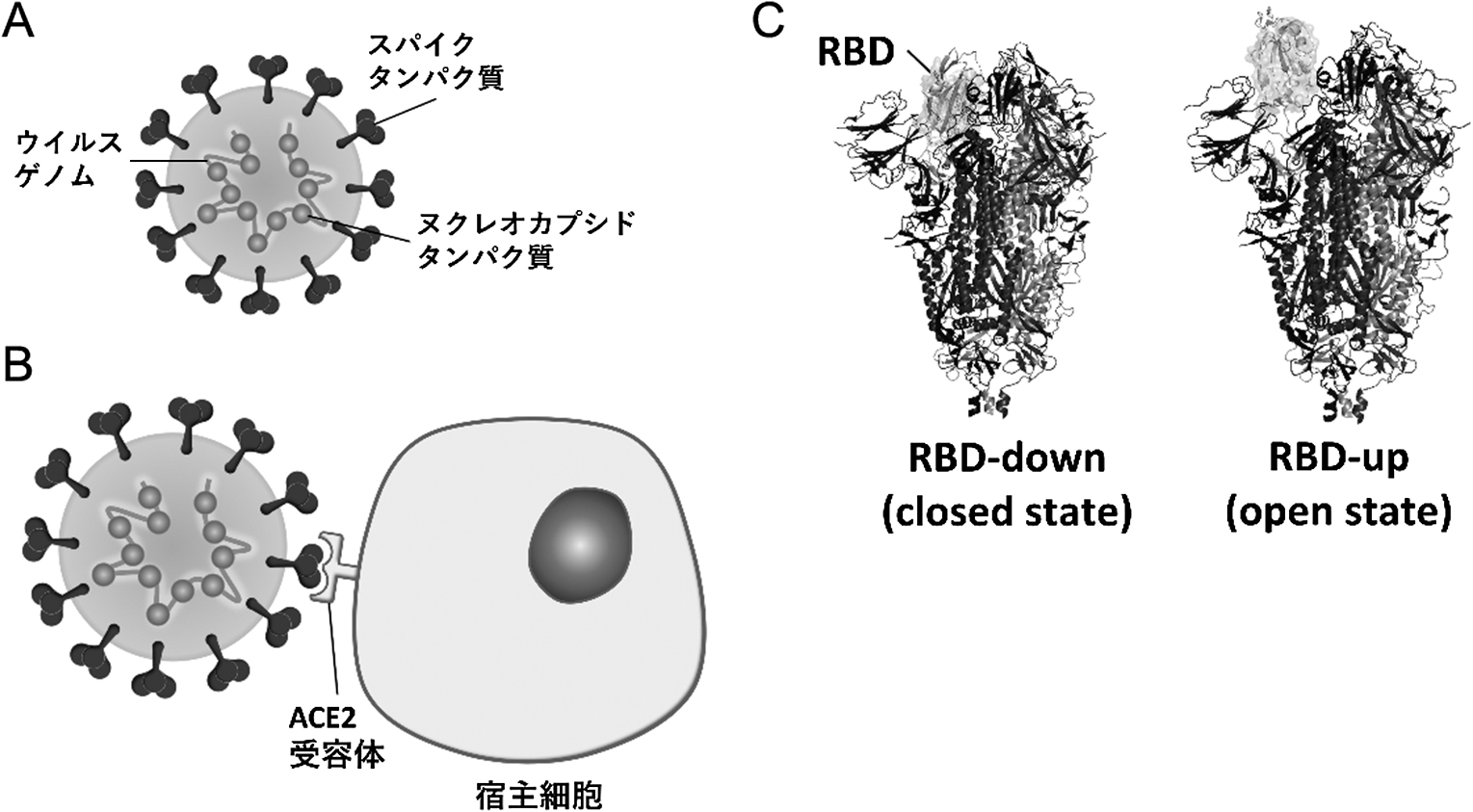
SARS-CoV-2は,コウモリ由来コロナウイルスに変異を生じヒト細胞への結合親和性が高まって派生したと考えられている2).その構造は,従来のコロナウイルスと配列の一致性が非常に高い領域と,SARS-CoV-2に特徴的な遺伝的多様性を持った領域とが混在する3).後者に分類されるタンパク質として,ヌクレオカプシド(N)タンパク質とスパイク(S)タンパク質がある.Nタンパク質はウイルス殻内のウイルスゲノムに巻きつくように存在(図1A)し,ウイルスが複製される際に同時に大量産生される.一方,Sタンパク質はウイルス骨格表面から突起状に突き出し(図1A),ヒト細胞への侵入に大きく関与する.Sタンパク質の一部を構成するreceptor binding domain(RBD)と呼ばれる小ドメインが,ヒト細胞側のangiotensin converting enzyme 2(ACE2)受容体と結合することで,ウイルスが宿主側の細胞に侵入できる(図1B)4).Sタンパク質は三量体として存在し,三量体Sタンパク質の一部がRBDを外側に突き出すRBD-upという状態にある(図1C)5, 6).RBD-upとなって初めてACE受容体と結合できるため,この状態の分子の割合が高いほど感染性が高いと考えられる.武漢株ではRBD-upの分子は全体の3割程度とされるが,ここに入る変異の程度でRBD-up状態の安定性が変化する7)ことが,感染性を規定する一つの因子といわれる.斯くして,このRBDが特徴的なアミノ酸配列を有している8)ため,SARS-CoV-2は人類が初めて出会う新興病原体として出現した.
SARS-CoV-2
(A)スパイクタンパク質とヌクレオカプシドタンパク質のウイルス内局在,(B)ACE2受容体を介したウイルスと宿主細胞の結合,(C)RBD-down(左)およびRBD-up(右)状態のスパイクタンパク質三量体6).単量体はそれぞれグレーカラーの濃淡で分け,RBD部分のみ表面構造を示す.
COVID-19の検査においてもっぱら確定診断に用いられているPCR法をはじめとした核酸増幅検査は,病原体由来成分を検出している.一方,病原体に対する宿主側の反応を検出する検査には,液性免疫応答としてヒトの体内で産生される特異的抗体を検出する血清学的検査,いわゆる抗体検査がある.抗体は,19世紀末,破傷風菌の純粋培養の研究に従事していた北里柴三郎らが,病原体由来の毒性物質を無毒化する無細胞の血液成分「抗毒素」として,診断はもちろん予防や治療に資することを発見した.この概念は21世紀の世界を襲ったCOVID-19のパンデミックにおいても,ワクチンや中和抗体医薬品開発の基盤となった.新興感染症出現以来用いられてきたワクチン,モノクローナル中和抗体,回復者血漿療法,抗ウイルス薬,免疫抑制剤といったCOVID-19の予防・治療法の内,抗体の応用が最初の3つを占めており,依然として血清学的アプローチが感染症克服の主翼であることが分かる.そこでこの総説では,SARS-CoV-2に対する免疫応答の理解を背景として,血清学的診断およびワクチン有効性評価への抗体検査の応用について論じる.
病原体に対する液性免疫応答としてヒトの体内で産生される抗体は一様ではなく,ウイルスタンパク質の中の抗原となりやすいアミノ酸配列に対してポリクローナルに産生される.COVID-19では,特異抗体として主にNタンパク質を認識する抗N抗体と,Sタンパク質を認識する抗S抗体が産生されるが,抗N抗体はウイルス中和活性を有さない一方,抗S抗体の一部はウイルス中和活性を持ち,ワクチン接種が誘導する抗体でもある.
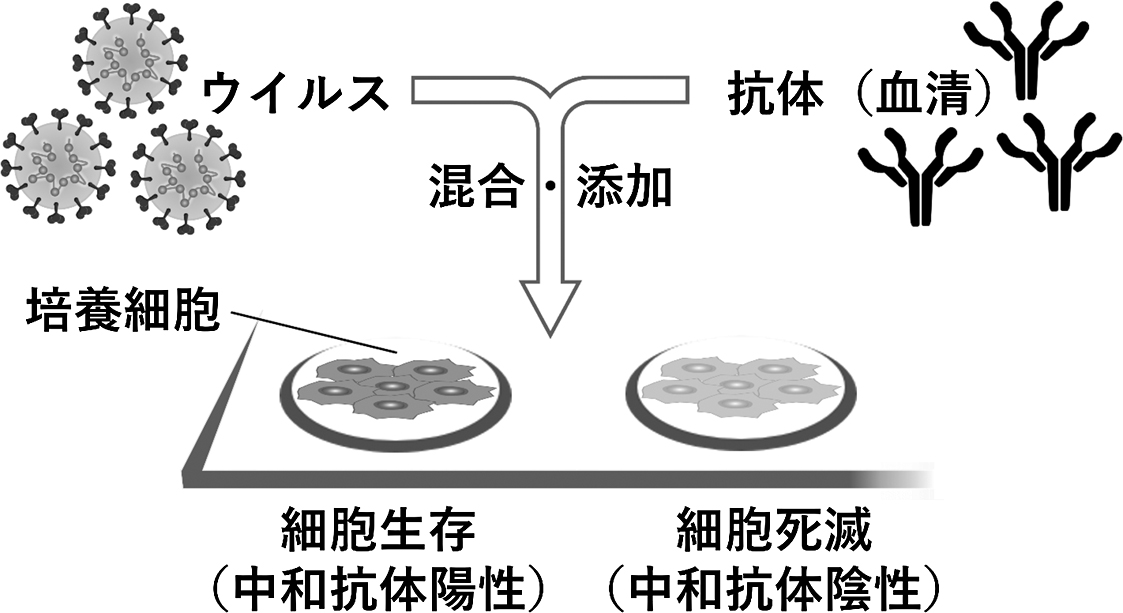
抗体の中和活性評価のゴールドスタンダードとして,古くからウイルス中和試験がウイルス学的な免疫の定量的評価方法として用いられてきた(図2)9).血液あるいは抗体を溶解した溶液を段階的に希釈し,これをウイルスの粒子と混合した後,細胞が播種された培養皿に添加して細胞のウイルス感染率を評価する試験である.感度は高くないものの,中和活性を持つ抗体を特異性高く検出でき,抗体の機能を直接的に観察することができる.しかし,施設間での標準化が難しく,生きたSARS-CoV-2の取扱いにバイオセーフティレベル3設備を要する煩雑な試験であるため,主に基礎研究で用いられる.
ウイルス中和試験
感染性のあるウイルス粒子を希釈した抗体との混合物を培養細胞に添加し,その細胞の生存可否によって中和抗体の有無を検出する.
抗S抗体は,Sタンパク質と宿主細胞のACE2受容体との結合を阻害するため,ウイルスの宿主細胞内への侵入を防ぎウイルスを無毒化(中和)するとされる10).奇しくもこれを裏付けることとなった一症例を紹介する(図3)11).患者は,リンパ腫に対し抗CD20抗体を用いたB細胞除去療法を受け,抗体産生能力が著しく減衰している中でCOVID-19に罹患し,重度の呼吸不全を呈した73歳男性である.この患者の血清学的評価を行ったところ,抗N抗体は他の重症患者と同等のタイミングで同等レベルまで産生されていたのに対し,抗S抗体は時系列を追っても経過中最後まで検出されず(図3AB),患者は不幸にも発症31日目に死亡した.この患者においては抗S抗体が産生されなかっただけでなく,血中からSARS-CoV-2も継続的に検出されていた(図3C)ことから,抗S抗体のセロコンバージョンが起きなかったために全身からのウイルス排除が著しく遅延したと考えられる.

リンパ腫に対し抗CD20抗体を用いたB細胞除去療法中にCOVID-19罹患した症例
(A)抗N抗体価(Abbott)および抗S抗体価(Mokobio),(B)抗N抗体価および抗S抗体価の時系列変化(Abbott),(C)血中ウイルスRNA量の時系列変化,におけるCOVID-19回復者3名と症例との比較.文献11)より一部抜粋改変.
COVID-19自然感染では通常,発症早期から回復期へと時間が経過するに伴って多くの方が中和抗体を獲得していく.中和抗体価の基準値として,血液の含まないウイルスのみを培養皿の細胞に感染させたものを対照に,感染を50%中和する希釈濃度NT50を使用する.自然感染者とワクチン接種者の抗S抗体価と中和活性を比較したところ,自然感染者とワクチン接種者で抗S抗体価は同程度の集団であるにも関わらず(1,000~50,000 AU/mL程度),NT50はワクチン接種者で自然感染者より有意に低いことがわかった(図4A)12).つまり,中和活性は抗S抗体価の大小以外の因子によっても影響を受けていることが示唆された.
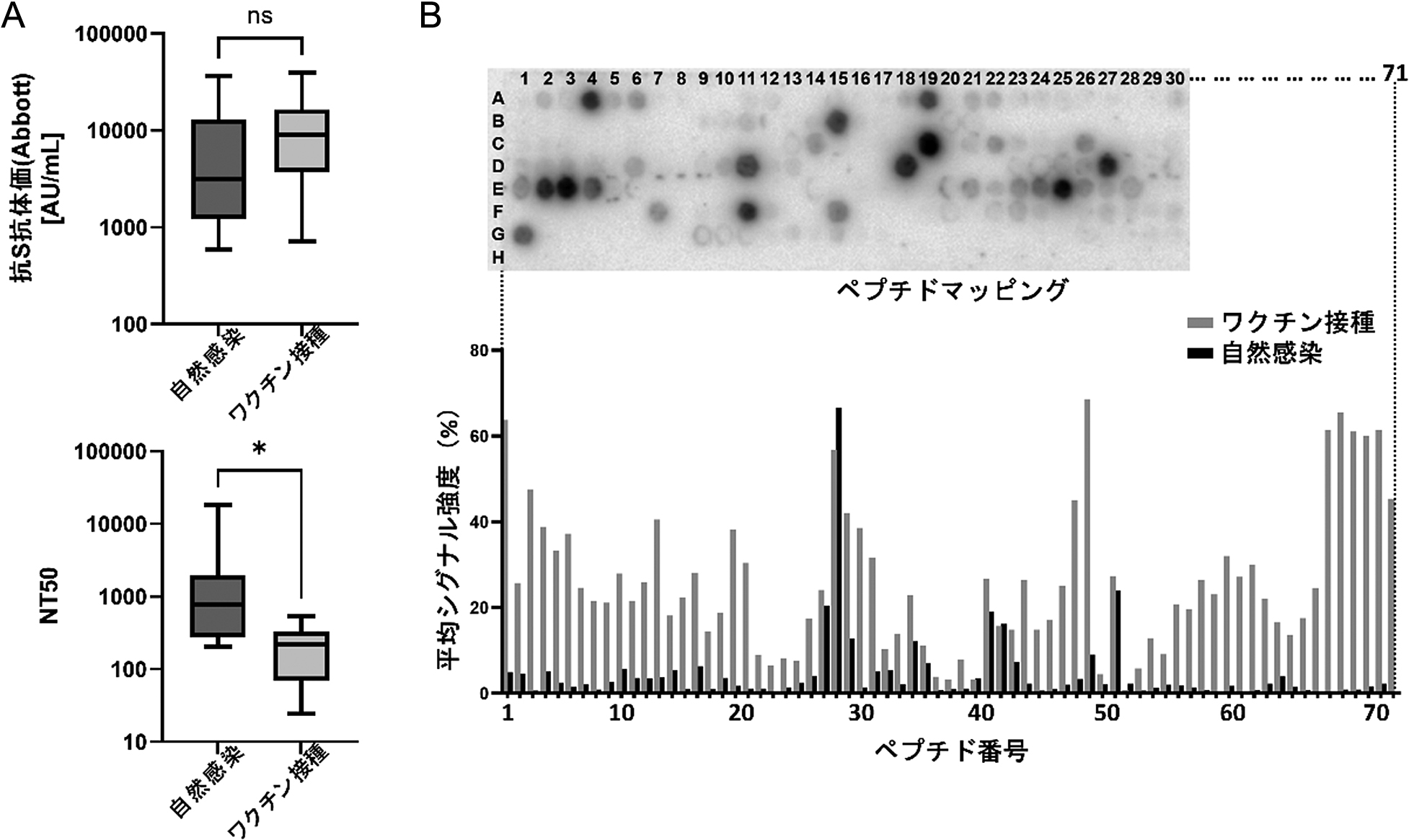
Pfizer/BioNTech mRNAワクチン2回目接種17~28日後(ワクチン接種)およびCOVID-19発症10~63日(中央値39日)後(自然感染)の(A)抗S抗体価(Abbott)とNT50(50%中和抗体価),および(B)RBD内15アミノ酸シフトペプチドアッセイによるエピトープマッピングとエピトープ毎の平均シグナル強度.
本邦で使用されているmRNAワクチンは,接種されたヒトの体内でSタンパク質を抗原として提示させ,抗S抗体が産生されるよう設計されている.これらのワクチン開発13)では,抗S抗体価とウイルス中和活性の両方のデータを指標に中和抗体の獲得を評価する体制が組まれ,中和抗体の獲得に相関して,臨床的アウトカムである感染予防効果と重症化予防効果を発揮することが示された14, 15).また,抗S抗体価に占める中和抗体価を標準化するために,NT50を抗S抗体価で除したNeutralizing Potency Index(NPI:中和比活性)という概念が提唱されている16).測定対象集団の特性が揃っている場合,NPIは比較的均一な値をとるため,抗S抗体価を中和抗体価のサロゲートマーカーとして用いることが可能である.しかしCOVID-19重症度が異なる,あるいは発症からの経過日数が異なるといった,異なる集団間ではNPIは大きく変動する16).したがって,新興感染症に対して集団のほとんどが免疫学的にナイーブな場合,自然感染とワクチン接種が混交して不均一な集団免疫状態にあるため,抗S抗体価をサロゲートマーカーとして中和活性を推し量る場合は注意が必要である.
COVID-19の典型的な症状のひとつは,肺炎である.しかし,ウイルスの排出は症状の出現前から始まっていて,無症候期あるいは全く無症候のまま疾患を乗り越えてしまう人からもウイルスが高頻度に分離されてくる17).この特徴により,症状が出てからPCR検査を実施しても,検出された頃には感染の裾野が大きく広がっていることが世界中で観察された18).また,COVID-19においてウイルスが検出可能な時期は検体の採取部位に依存する19).最も長期間ウイルスが検出されるのは下気道由来検体であり,肺炎を発症する頃には上気道のウイルスはすでに減少傾向に入っているため,鼻咽頭由来PCR陰性のCOVID-19典型肺炎といった症例も少なからず報告されている20).このようなCOVID-19の独特な病態ゆえに,一つの検査法に頼る診断には限界がある.発症早期の診断にはPCRや抗原検査といった病原体を検出する方法を用い,時期を逸してしまった,あるいは何度PCRを行っても陽性にならない疑い例については,診断可能な期間が非常に長い抗体検査が補助診断として有用である21).
2020年5月,12月および2021年12月と,これまで3度の厚生労働省主導の全国抗体保有率調査が行われた.第1回目時点でCOVID-19の有病率は0.1%(東京)と非常に低かった22).有病率0.1%の低い状況で検査を実施する際の問題は,たとえ感度・特異度が理想的な検査であっても,検査前確率が極めて低いため,偽陽性が相対的に多く発生し,陽性的中率が低くなる点(感度・特異度が98%の場合,陽性的中率5%弱)である.この調査においては,陽性的中率を高めるため,高い陽性一致率を発揮する検査を二つ組み合わせるorthogonal testing algorithmを利用した体制23)が採られた.具体的には,異なる2社(Abbott社およびRoche社)の試薬を用い,両方の検査が陽性であったときに初めて感染を暫定判断するという方法で,最終的には中和試験によって診断を確定した.その結果,第1回および第2回24)の調査当時いずれも,PCR検査で把握されていた累積感染者数に比べ,数倍から高くて5倍程度の抗体保有率であった.つまりCOVID-19流行初期は,重症肺炎をきたすような症例の背景に,軽症者あるいは無症候者が無数に存在する感染症であり,PCRで捕捉できる感染者は氷山の一角であったことが示唆される25).直近の第3回目の調査では,有病率2.73%(東京)に対して既感染を示す抗N抗体陽性者は2.80%と両者の差は縮まっていた26).このように個々の感染症の疫学情報を正確に把握することは,適した公衆衛生学的対策の実施および評価に際して極めて重要である.そして,背景に存在する軽症者や無症候者を含めた感染症の氷山全体を把握する唯一の手段が抗体検査なのである.感染性の高いオミクロン株の流行が,実際にはどの程度の広がりがあったかを知るためにも,今後の継続した調査・研究が待たれる.
2022年2月現在において,日本の累積感染者数は約560万人と全人口の5%弱である.一方,2021年2月より始まったmRNAワクチンの2回接種は,人口の80%弱が完了している.したがって,本邦におけるSARS-CoV-2に対する集団免疫は,自然感染誘導免疫よりもワクチン誘発免疫に大きく依存することになり,COVID-19のパンデミックを軽減することに貢献してきた.実際,mRNAワクチンの免疫原性は,2回接種後約一ヶ月で抗S抗体価を自然感染後と同等まで上昇12)させるに十分であることを確認している(図4A).
ここまでみてきた中和抗体のひとつである抗S抗体の抗体価は,抗S抗体の総量を示すが,これはウイルス無毒化の指標として「量的」な一面しか表さない.我々の研究12)で,自然感染者では抗S抗体価がワクチン接種者と同等であっても,ウイルス中和活性は接種者より高いという結果(図4A)が得られており,抗体価とは異なる「質的」な評価の重要性が示された.抗体の中和活性を規定する「質的」因子としては,エピトープ(抗原決定基)と結合親和性(アビディティ)が挙げられる.エピトープとは,抗体が標的として結合する抗原内の短いアミノ酸領域を指す.Sタンパク質RBD内のエピトープを解析した12)ところ,自然感染ではごく一部の領域に強く反応する抗体が作られている一方,ワクチン接種者では幅広い種類の抗体が作られていた(図4B).また結合親和性とは,抗体と標的分子であるウイルスとの結合強度を指す.自然感染者およびワクチン接種者において,時間とともに抗体価は減少傾向であるのに対して,抗体の結合親和性は上昇する27).これはウイルスとより強固に結合できる抗体の選別,つまり抗体の成熟を表しており,「量的」指標である抗体価が減少していたとしても,ウイルス無毒化効果が必ずしも減弱するわけではないことを示唆している.さらに検査系によって測っている抗体の質に差がある場合もある.結合親和性が高い成熟抗体を選択的に測定する傾向にある検査系がある一方,親和性が低いものも引っくるめて感度高く測る検査系もあり,これらが測定値の違い(抗体価比)となって現れる(図5).

自然感染後における抗S抗体価比(Roche/Abbott)の推移と親和性度との関係
親和性度は,尿素処理によって低親和性抗体が除去された後の高親和性抗体価が全体に占める割合を示す.
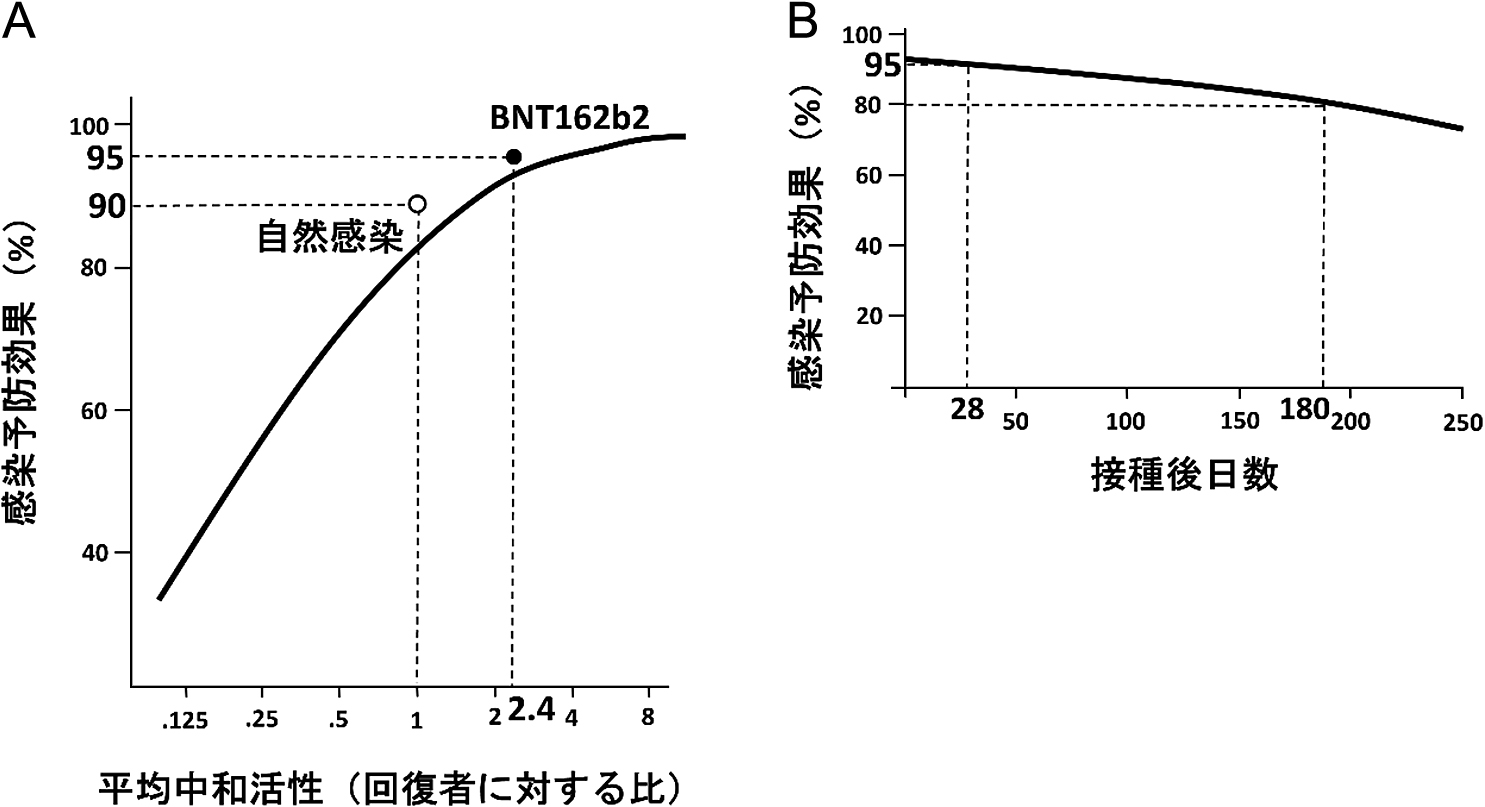
ワクチン接種後の抗体検査に際して最も知りたい情報は,抗体価から推測される感染予防あるいは重症化予防効果である.これまでの研究により,ワクチン接種後の感染予防あるいは重症化予防効果,つまりワクチン有効性とウイルス中和活性/抗体価の関係が徐々にわかってきた.本邦で最初に承認されたPfizer-BioNTech社製mRNAワクチンBNT162b2の治験データ13)では,2回目接種1~2週間で抗S抗体価上昇のピークがみられ,中和活性の指標であるNT50も同様の動態を示す.この時点で自然感染回復者のウイルス中和活性中央値を1として比較すると,BNT162b2接種者では中央値2.4となり,より高い中和活性分布をとる(図6A)28).また,ウイルス中和活性が高いとワクチン有効性も高く28),変異株に対しても同様にワクチン有効性を予測することができる29).BNT162b2接種健常成人を対象とした免疫原性評価研究でも,国際保健機関(WHO)の抗SARS-CoV2免疫グロブリン国際標準規格(the universal binding antibody unit: BAU)30)として2回接種4週間で中央値1,000 BAU/mL程度のピークを認めた(投稿中).この抗S抗体価を中和活性のサロゲートマーカーとして,野生(武漢)株に対する発症予防効果との関係をみると,ピークである1,000 BAU/mLは95%の初期予防効果に対応し,その6ヶ月後には効果が80%程度に減衰していると推測できる29)(図6B).
SARS-CoV-2ワクチン接種後の中和活性と感染予防効果(対野生株)の関係
BNT162b2ワクチン2回接種後2週間時点の中和活性とその後の感染予防効果(A).中和抗体減衰による感染予防効果の経時変化予測(B).BNT162b2ワクチン2回接種後に得られる中和活性の中央値は自然感染回復者の約2.4倍で,95%の感染予防効果であった.ワクチン2回接種4週間後の初期感染予防効果が95%の場合,180日後は80%程度まで減衰すると予測される.文献28)を参照して作図.
ワクチン有効性は経時的な変化や,時の流行株に大きく影響を受ける.ワクチン2回接種直後に抗体価が高くワクチン有効性が高いと予測される場合,野生(武漢)株に対しては抗体価が低下するほどには有効性は低下しない31).ところが,デルタ株に対する発症予防効果は,1年経過しても比較的高く維持できているのに対し,免疫逃避するオミクロン株に対しては大幅に低下する31).また,ワクチン3回接種直後ではオミクロン株に対しても70%程度の発症予防効果を示すものの,比較的短期間に発症予防効果も低下していく31).このように流行株が変化すると,抗体価とワクチン有効性の関係も変化する.
では,今後ワクチン接種の適応はどのように考えればよいのか.現在主流となっているオミクロン株はそれ以前の他の変異株に比べてアミノ酸配列の変異領域が多く,以前の株に自然感染したことで産生される抗体からの免疫逃避性が高く,オミクロン株は無毒化されにくい32).ところがワクチン3回接種,あるいは自然感染後にワクチン1回接種することによって幅広いエピトープに対する抗体が誘導されるため,オミクロン株のみならず他のコロナウイルスまでカバーできるとされる29).したがって,ワクチン2回接種後に3回目のブースト接種,あるいは自然感染後にワクチン接種をすることは,オミクロン株を含めた幅広いコロナウイルス感染症に対する有効性が期待できる.しかし,3回目のブースト接種を終えたとしても,現行のワクチンは野生株を標的として作成されたものであり,オミクロン株にも有効であるとはいえ,ワクチン株に対してほどの効果がないことも明白である.したがって,今後の課題としては,ブースト接種による有効性の持続期間の見極めと,変異株にも対応できるワクチン株選定が中心となってくる.持続期間については,3回接種が人口の25%程度しか完了していない現時点からの追跡調査が待たれるが,未知の変異株をカバーするにはおそらく限界がある.幅広い変異株をカバーする抗体を誘導できるユニバーサルワクチンのデザインとその適応決定について,喫緊の対応が求められている33).
SARS-CoV-2と人類が共生するには,時流を捉えた問題,課題を意識し,アクションに対してアセスメントをして次の行動に繋げるという今までの科学が執ってきたプロセスを経ながら,社会,医療の形を柔軟に変えていく必要がある.COVID-19予防,診断および治療の要である抗体検査を用いたエビデンスを樹立していくことは,社会の全員が盲目的に同一の行動指針を求められてきた2年から脱却し,これからの時代をしなやかに生きていくための羅針盤となるだろう.感染症対策のみに留まらず,レジリエンス高い社会をどのように構築し,次世代へ継承していくか,21世紀前半に生きる我々の真価を問われているのではないだろうか.
本研究の一部は,日本医療研究開発機構(AMED)からの資金提供により実施された:JP20wm0125003(YK),JP20he1122001(YK),JP20nk0101627(YK),JP20jk0110021(YNakagama),同様に日本学術振興会からの科学研究費補助金により実施された:JP21441824(NK),同様に特別研究員奨励費の助成を受けた:22J15985(YNitahara).また,大阪市立大学目的積立金からの資金援助を得た.この研究に参加したボランティアと患者に感謝します.
中釜悠:エクイティ(株など)(クァンタム・モレキュラー・ダイアグノスティックス)
城戸康年:エクイティ(株など)(クァンタム・モレキュラー・ダイアグノスティックス)
本論文発表内容に関連して開示すべき企業等との利益相反なし