緒 言
不育症のリスク因子としては、子宮の形態、染色体、内分泌、凝固、免疫などの各種の異常がある。その中でも主要なリスク因子の1つとして、抗リン脂質抗体症候群のような自己免疫疾患が知られている。抗リン脂質抗体が流死産につながる病的機序は完全には解明されていないが、絨毛細胞に対して、その合胞体化や脱落膜への侵入を阻害し、胎盤における凝固系や補体系を活性化するとされる[1]。また、血管内皮に対してもアネキシンVやβ2-Glycoprotein
Iなど、各種の分子への作用を介して傷害することが知られている[1-4]。このため、妊娠初期には、絨毛細胞の増殖を抑制、絨毛の脱落膜への侵入を阻害して流産につながるとともに、妊娠が進行してからも胎盤内の微小血管の血栓形成は胎児発育不全や胎児死亡につながると考えられる。
妊娠は“生理的な負荷テスト”とも呼ばれる[5]。妊娠糖尿病のように、非妊娠時には臨床的には捉えられない程度(subclinical)であった耐糖能異常が、妊娠という負荷により顕在化することがある。同様にsubclinicalな血管障害が存在していれば、妊娠中に、妊娠高血圧症候群(Pregnancy
induced hypertension: PIH)や胎児発育不全(fetal growth restriction:
FGR)という形で顕在化する可能性がある。抗リン脂質抗体症候群やプロテインS低下症などの女性においても、妊娠前には、必ずしも、臨床症状を伴う血管障害が見られているわけではなく、血液検査をしなければ明らかになることはない。しかし、妊娠による負荷がかかると、PIHやFGRという形で発症し、さらには、一部の流産や死産の原因となる可能性がある。このような女性では、不育症治療により生児を得た後にも、血管への傷害は続き、全身的に動脈硬化が進行することも推測される[6]。
このように、不育症女性においては、流死産への対応という視点で、また、その後の一生にわたる心血管イベント発生の予防という視点でも、血管障害に注目すべきである。
不育症のリスク因子と子宮動脈
妊娠高血圧症候群では、妊娠中に子宮動脈の血管抵抗(Pulsatility index:
PI)値が上昇する例が多く、そのような例ではFGRを来すことはよく知られている[7]。また、妊娠中期の子宮動脈血管抵抗の上昇は妊娠高血圧症候群発症の予測に有用ともされる[8]。
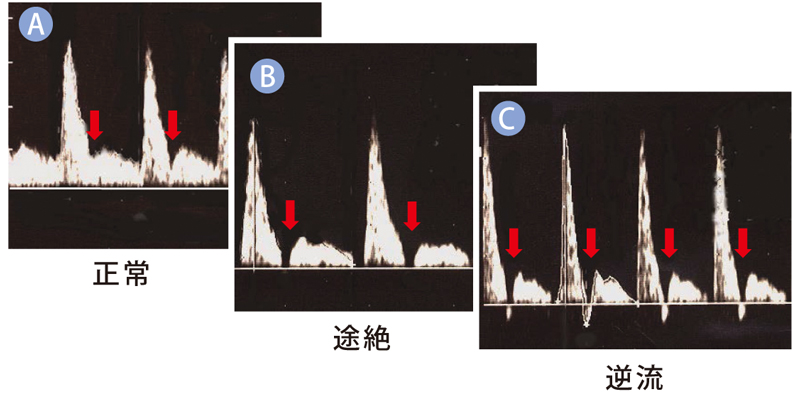
非妊娠時の健常女性の子宮動脈の血流速度波形(図1A)を見ると、拡張期切痕(diastolic
notch)(矢印)は見られるが、拡張期も子宮動脈の血流が途絶えることはない[9]。しかし、不育症女性の中には、diastolic notchが深く、血流の途絶(図1B)や逆流(図1C)が見られる例も存在する。
妊娠初期の子宮循環は、placentationにおける血管のリモデリングなどを反映し、妊娠の予後にも関与する可能性がある[10]。妊娠4~5週における不育症女性の子宮動脈のPI値をみると、健常女性に比較して有意に高値をとる(図2)[11]。不育症妊婦と健常妊婦の子宮動脈PI値の分布はオーバーラップしているが、不育症女性の中に、子宮動脈の血管抵抗の高い一群があることがわかる。
アドレノメデュリンはcAMPを介して血管拡張作用を持つリング状のペプチドであり、血管内皮が傷害を受けると放出されるため、血中での上昇は血管障害の指標となる[12]。不育症女性の黄体期中期の子宮動脈PI値は、健常女性と比較して高値であり、この時期の子宮動脈PI値は、血漿アドレノメデュリン値と相関する(図3)。不育症女性の中でも、特に抗リン脂質抗体症候群の場合は、血漿アドレノメデュリン値や子宮動脈PI値は非常に高い。このように、不育症女性の子宮動脈の血管抵抗値上昇には、血管障害を起こすリスク因子が関与している可能性がある。
不育症のスクリーニング検査が血液検査による生化学的、免疫学的検査が主体である中で、私達は、子宮動脈の血管抵抗値の測定は、数少ない生理学的検査として有用となる可能性を指摘してきた。
原因不明の不育症女性の子宮動脈
不育症専門外来におけるスクリーニング検査によってもリスク因子の見られない原因不明の不育症女性の比率は、依然として高く、流死産回数が増えるにつれ、その対応は困難となる。このような原因不明の不育症女性の中にも子宮動脈の血流が不良な一群がある(図4)[13]。抗核抗体は直接的な流死産の原因にはならないとされるが、抗核抗体陽性例では子宮動脈PI値が比較的高値である。このような例では、抗リン脂質抗体が検出されない場合も、免疫学的な機序による血管障害の存在が推測される。原因不明の不育症女性においても、健常女性と比較して、子宮動脈PI値が高いこと、血漿アドレノメデュリン値も高いことも報告されている[14]。
このように、原因不明の不育症の一部では、未知の不育症のリスク因子が流死産を起こす機序があり、それには子宮の血流異常が関与している可能性がある。原因不明の不育症の病態や治療を考える上でも、子宮動脈の血管抵抗値の測定がそのヒントとなる可能性がある。
不育症妊婦の合併症の予測
抗リン脂質抗体陽性妊婦では、流産を免れても、PIH、FGR、常位胎盤早期剥離などの合併症の発生により、死産、早期産、低出生体重児の発生が高率である。児の予後を考慮すると、これらの合併症を予測できれば、それに基づいて、抗凝固療法に用いる薬剤を選択したり、妊娠途中で変更したりすることが可能となる。不育症妊婦の妊娠合併症の予測のために、子宮動脈のPI値のモニタリングは有用であろうか。
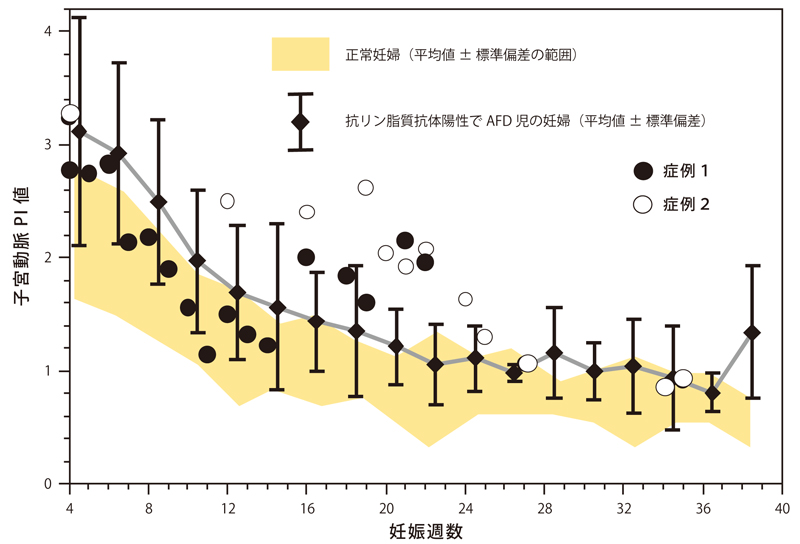
抗リン脂質抗体陽性妊婦の子宮動脈PI値の推移を見ると、AFD(appropriate for
date)児を得た症例でも、正常妊婦の平均値+標準偏差の範囲よりも高く推移する症例が多いものの、いずれも妊娠週数とともに低下傾向を示している(図5)[15, 16]。
しかし、その経過から逸脱する例も見られる。低用量アスピリンとヘパリンとの併用を行った症例1(●印)では、高値であった子宮動脈PI値は一時的に低下していたが、妊娠16週頃から子宮動脈PI値が上昇、徐々にFGR傾向、発育停止となり、救命が困難な状況のまま胎児死亡となった。症例2
(○印)では、低用量アスピリン単独療法により妊娠は継続したが、子宮動脈PI値は高値を持続、胎盤内の血腫形成により胎盤の厚さも増大した。FGR発生が予測されたため、同意のもと、妊娠19週よりヘパリンの併用を開始した。その後、胎盤の変化も目立たなくなり、子宮動脈PI値も正常化、FGRで低出生体重ではあったが生児を得た。
全妊婦の子宮動脈PI値をモニターしていくことは困難であるが、FGR発生のリスクの高い抗リン脂質抗体症候群などのハイリスク妊婦においては有用であると考える。早期に予後を予測し、治療法を再考するためには、胎児の臍帯動脈や中大脳動脈の変化が出現するよりも前に、胎盤の内部の超音波像の観察や厚さの計測[17]、更には、子宮動脈PI値の測定が有用となる可能性がある。
女性の心血管イベント
米国のフラミンガム研究では、50歳以下の女性では心血管系の疾患の発症頻度は低く、男性の1/2以下とされる[18]。このことを考えると、若年にも関わらず、血管障害を持つ女性では、何らかのリスク因子を持っている可能性が高い[19]。一般に、自己免疫疾患症例では、心血管イベント発症のリスクが高いことが知られている[20]。若年女性に好発する全身性エリテマトーデス(systemic
lupus
erythematosus:SLE)では、全身性の炎症に伴い炎症性サイトカインが上昇しており、血管内皮障害が発生し、動脈硬化へ移行する。35~44歳の年齢層で見ると、フラミンガム研究における一般女性の心筋梗塞の発生率が0.16%であったのに対して、SLEの女性では8.39%と高率(オッズ比52.43)である[21]。
流死産と心血管イベント
50~74歳の女性を流産歴で分類して検討すると、分娩歴のある女性、あるいは、流死産歴のある女性では心筋梗塞の発生率が高く(年齢で調整して2.1倍)、流死産回数が増加すると、心筋梗塞の発生率は有意に高くなる(年齢で調整して1.4倍)とされる[22]。また、3回以上の自然流産を経験した女性では、各種の背景因子を調整した後にも、心筋梗塞の発生率は約5倍、脳梗塞・出血の発生率は1.43倍との報告もある[23]。
また、死産の既往は、女性の冠動脈疾患、また、循環器系、腎臓系の異常による死亡リスクと関連していることが知られている[24]。死産の既往があることで、年齢を調整した後にも、動脈のプラーク性変化の発生率は3.43倍[25]、また、年齢、喫煙、アルコール摂取量、BMI(Body mass
index)、運動量、教育水準、妊娠回数、高血圧・高脂血症・糖尿病の比率などを調整した後にも、心筋梗塞の発症率は2.32倍とも報告されている[23]。
不育症のリスク因子と心血管イベント
不育症と心血管イベントとに共通するリスク因子の代表としては、抗リン脂質抗体症候群がある。ホルモン異常、代謝異常なども、不育症のリスク因子であるとともに、心血管イベントのリスク因子となりうる。また、流産後には、程度の差はあるが感染を伴うことが多い。不育症女性における繰り返される感染は心血管イベントのリスク因子になることが推測されている[23]。不育症女性に見られることの多い不安やうつも心血管イベントの発症と関連していることが知られている[26, 27]。
明確な病態の見られない原因不明の不育症女性の中でも、subclinicalな血管障害が存在していれば、その後の心血管イベントの原因となる可能性がある。
不育症女性の全身血管の状態
PIH妊婦では、子宮動脈のみではなく、眼動脈の各種血流指標の異常[28]や上腕動脈の血流依存性血管拡張反応(Flow- Mediated Vasodilatation:
FMD)の低下[7]などの全身の血管の異常が見られる。更に、各種の報告をまとめたメタ解析により、PIHの既往のある女性では、分娩の5~15年後の虚血性心疾患、脳梗塞、静脈血栓塞栓症の発生リスクが約2倍であることが報告されている[5]。
私達は、非妊娠時の不育症女性において、血管の硬化度の指標である脈波伝播速度(Pulse Wave
Velocity:PWV)が、健常女性に比較して有意に高値であり、特に、抗リン脂質抗体陽性妊婦では著明であることを報告している(図6)[29,
30]。
この研究では、原因不明の不育症女性の中にも、同様にPWVが高値である一群があることも明らかになっている。また、原因不明の不育症女性では、上腕動脈のFMDが低下していることも報告されている[31]。細胞由来微小粒子(cell-derived
microparticles)は活性化、あるいは、障害を受けた細胞から放出され、血管内皮を刺激して白血球や単球の接着を亢進、血管拡張因子であるNitric oxide
の放出を阻害する。原因不明の不育症女性における血管内皮細胞由来の微小粒子の血中レベルは上昇していることが報告されており、全身的な血管障害の存在が推測されている[32]。
不育症女性では、抗リン脂質抗体症候群やプロテインS低下症などの凝固異常を持つことも多く、周産期の深部静脈血栓症や脳梗塞のハイリスク群と考えられる。また、不育症女性に見られるPWVの上昇やFMDの低下は、心筋梗塞や脳梗塞などの心血管イベントの発生と関連することが知られている。
更に、血中のホモシステイン[33]、アドレノメデュリン[12]、トロンボモデュリン[37]などの血管障害マーカーは、不育症女性で上昇していることが知られており、これらのマーカーが高値の場合は、特に、その後の心血管イベントへの注意が必要である。私達は、不育症女性では自律神経系のバランスも変化していることを明らかにしている[34]。心血管系への影響も知られていることから、今後の研究が必要である。
不育症女性における心血管イベントの予防
低用量アスピリンは、不育症女性の流死産を予防するとともに、心血管イベントを予防する効果も持つ。しかし、現在のところ、不育症の既往のある女性の全てに対して、血栓予防のための薬物治療を行う必要性を示唆するデータは見られない。
しかし、抗リン脂質抗体症候群や凝固異常が明らかな不育症女性においては、生活習慣を見直し、高血圧、肥満、脂質異常、インスリン抵抗性などの発症に注意するように指導すべきである。もし、これらの心血管イベントのリスク因子が加われば、生活習慣に関する指導を行い、それでも改善されない場合は予防的治療の対象となると考える。
さらに、PWVなどの測定は、不育症女性のその後の人生における心血管イベントの発生の予測につながる可能性があり、データを示すことで、生活習慣改善の動機づけにも有効である。不育症の治療や支援を行う医療スタッフは、妊娠継続へ向けて対応するのは当然であるが、更に視野を広げて、心血管イベントに関する啓発や患者教育により、その後の不育症女性の一生にわたる自己管理を支援する必要がある。
References
- [1] Tong
M
Viall
CA
Chamley
LW. 2015. Antiphospholipid
antibodies and the placenta: a systematic review of their in vitro effects and modulation
by treatment. Hum Reprod Update.
21: 97-118. DOI:10.1093/humupd/dmu049, PMID:25228006
- [2] Negrini
S
Pappalardo
F
Murdaca
G
Indiveri
F
Puppo
F. 2016. The antiphospholipid
syndrome: from pathophysiology to treatment. Clin Exp Med.
2016
Jun 22. [Epub ahead of
print].PMID:27334977
- [3] Oku
K
Amengual
O
Atsumi
T. 2012. Pathophysiology of
thrombosis and pregnancy morbidity in the antiphospholipid syndrome. Eur J Clin
Invest.
42: 1126-1135. DOI:10.1111/j.1365-2362.2012.02697.x,
PMID:22784367
- [4] Willis
R
Pierangeli
SS. 2011. Pathophysiology of
the antiphospholipid antibody syndrome. Auto Immun Highlights.
2: 35-52. DOI:10.1007/s13317-011-0017-9, PMID:26000118
- [5] Mosca
L. 2011. Effectiveness-Based
Guidelines for the Prevention of Cardiovascular Disease in Women—2011 Update. A Guideline
From the American Heart Association. Circulation
123: 1243-1262. DOI:10.1161/CIR.0b013e31820faaf8,
PMID:21325087
- [6] Saponjski
J
Stojanovich
L
Djokovic
A
Petkovic
M
Mrda
D. 2011. Systemic vascular
diseases in the antiphospholipid syndrome. What is the best diagnostic choice?
Autoimmun Rev
10: 235-237. DOI:10.1016/j.autrev.2010.11.002, PMID:21095242
- [7] Takata
M
Nakatsuka
M
Kudo
T. 2002. Differential blood
flow in uterine, ophthalmic, and brachial arteries of preeclamptic women. Obstet
Gynecol
100: 931-939.PMID:12423855
- [8] Pedrosa
AC
Matias
A.: Screening for
pre-eclampsia: a systematic review of tests combining uterine artery Doppler with other
markers. 2011. J Perinat Med
39: 619-635. DOI:10.1515/jpm.2011.077, PMID:21848482
- [9] 中塚幹也.2015.不育症の基礎知識と患者支援のポイント
連載第12回.不育症と超音波検査②.臨床助産ケア.7(1): 77-80.
- [10] Tamura
H
Miwa
I
Taniguchi
K
Maekawa
R
Asada
H
Taketani
T
Matsuoka
A
Yamagata
Y
Ishikawa
H
Sugino
N. 2008. Different changes in
resistance index between uterine artery and uterine radial artery during early pregnancy.
Hum Reprod.
23: 285-289. DOI:10.1093/humrep/dem375, PMID:18037605
- [11] Nakatsuka
M
Habara
T
Noguchi
S
Konishi
H
Kudo
T. 2003. Impaired uterine
arterial blood flow in pregnant women with recurrent pregnancy loss. J Ultrasound
Med.
22: 27-31. DOI:10.7863/jum.2003.22.1.27, PMID:12523607
- [12] Nakatsuka
M
Habara
T
Noguchi
S
Konishi
H
Kudo
T. 2003. Increased plasma
adrenomedullin in women with recurrent pregnancy loss. Obstet Gynecol.
102: 319-324.PMID:12907107
- [13] Habara
T
Nakatsuka
M
Konishi
H
Asagiri
K
Noguchi
S
Kudo
T. 2002. Elevated blood flow
resistance in uterine arteries of women with unexplained recurrent pregnancy loss.
Hum Reprod.
17: 190-194. DOI:10.1093/humrep/17.1.190, PMID:11756386
- [14] El-mashad
AI
Mohamed
MA
Farag
MA
Ahmad
MK
Ismail
Y. 2011. Role of uterine
artery Doppler velocimetry indices and plasma adrenomedullin level in women with
unexplained recurrent pregnancy loss. J Obstet Gynaecol Res.
37: 51-57. DOI:10.1111/j.1447-0756.2010.01318.x,
PMID:21083839
- [15] 中塚幹也,鎌田泰彦,小西秀樹,羽原俊宏,野口聡一,工藤尚文.2003.抗リン脂質抗体症候群の妊娠予後の予測の試み-子宮動脈血管抵抗,凝固関連マーカーの変化-.産婦実際。52:
1623-1627.
- [16] 中塚幹也.2015.不育症の基礎知識と患者支援のポイント
連載第13回.不育症と超音波検査③.臨床助産ケア.7(2): 85-87.
- [17] 中塚幹也.2015.不育症の基礎知識と患者支援のポイント
連載第15回.不育症と超音波検査⑤.臨床助産ケア.7(4): 87-89.
- [18] Kannel
WB
Hjortland
MC
McNamara
PM
Gordon
T. 1976. Menopause and risk of
cardiovascular disease: the Framingham study. Ann Intern Med
85: 447-452。 DOI:10.7326/0003-4819-85-4-447, PMID:970770
- [19] 中塚幹也.2007.若年女性における血管障 害.岡山医学会雑誌。119:
27-32.
- [20] Abou-Raya
A
Abou-Raya
S. 2006. Inflammation: a
pivotal link between autoimmune diseases and atherosclerosis. Autoimmun
Rev.
5: 331-337. DOI:10.1016/j.autrev.2005.12.006, PMID:16782558
- [21] Manzi
S
Meilahn
EN
Rairie
JE
Conte
CG
Medsger
TAJr
Jansen-McWilliams
L
D'Agostino
RB
Kuller
LH. 1997. Age-specific
incidence rates of myocardial infarction and angina in women with systemic lupus
erythematosus: comparison with the Framingham Study. Am J Epidemiol.
145: 408-415. DOI:10.1093/oxfordjournals.aje.a009122,
PMID:9048514
- [22] Kharazmi
E
Fallah
M
Luoto
R. 2010. Miscarriage and risk
of cardiovascular disease. Acta Obstet Gynecol Scand.
89:284-288. DOI:10.3109/00016340903380758, PMID:19943820
- [23] Kharazmi
E
Dossus
L
Rohrmann
S
Kaaks
R. 2011. Pregnancy loss and
risk of cardiovascular disease: A prospective population-based cohort study
(EPIC-Heidelberg). Heart.
97: 49-54. DOI:10.1136/hrt.2010.202226, PMID:21123827
- [24] Calderon-Margalit
R
Friedlander
Y
Yanetz
R
Deutsch
L
Manor
O
Harlap
S
Paltiel
O. 2007. Late stillbirths and
long-term mortality of mothers. Obstet Gynecol.
109: 1301-1308. DOI:10.1097/01.AOG.0000264548.10767.ea,
PMID:17540801
- [25] Kharazmi
E
Moilanen
L
Fallah
M
Kaaja
R
Kattainen
A
Kahonen
M
Jula
A
Kesaniemi
A
Luoto
R. 2007. Reproductive history
and carotid intima-media thickness. Acta Obstet Gynecol Scand.
86: 995–1002. DOI:10.1080/00016340701464374, PMID:17653887
- [26] Neugebauer
R
Kline
J
Shrout
P
Skodol
A
O'Connor
P
Geller
PA
Stein
Z
Susser
M. 1997. Major depressive
disorder in the 6 months after miscarriage. JAMA. 277:
383-388. DOI:10.1001/jama.1997.03540290035029, PMID:9010170
- [27] Janssen
I
Powell
LH
Matthews
KA
Cursio
JF
Hollenberg
SM
Sutton-Tyrrell
K
Bromberger
JT
Everson-Rose
SA. 2011. SWAN study.
Depressive symptoms are related to progression of coronary calcium in midlife women: the
Study of Women's Health Across the Nation (SWAN) Heart Study. Am Heart J
161: 1186-1191. DOI:10.1016/j.ahj.2011.03.017, PMID:21641367
- [28] Nakatsuka
M
Takata
M
Tada
K
Kudo
T. 2002. Effect of a nitric
oxide donor on the ophthalmic artery flow velocity waveform in preeclamptic women.
J Ultrasound Med.
21: 309-313. DOI:10.7863/jum.2002.21.3.309, PMID:11883542
- [29] Nakatsuka M, Noguchi S, Kamada Y, Sasaki A,
C.Chekir, H.Lin and Hiramatsu. 2004. Impaired vascular function in women with recurrent
pregnancy loss: Involvement of antiphospholipid antibodies. In: Makino T. and Sugi T.
(eds.) Proceedings of the IX International Congress of Reproductive Immunology. pp.97-100,
ISIR, Japan.
- [30] Nakatsuka M: Vascular dysfunction in women with
recurrent pregnancy loss. In: Jatoi NA, Marie Tobin AM, Ciccone M, Pende A, Kasirga E.
(eds.) Recent Advances in Cardiovascular Risk Factors / Book 2. InTech, Croatia,
pp.123-150, 2012.
- [31] Germain
AM
Romanik
MC
Guerra
I
Solari
S
Reyes
MS
Johnson
RJ
Price
K
Karumanchi
SA
Valdés
G. 2007. Endothelial
dysfunction: a link among preeclampsia, recurrent pregnancy loss, and future
cardiovascular events? Hypertension.
49: 90-95. DOI:10.1161/01.HYP.0000251522.18094.d4,
PMID:17116761
- [32] Pasquier
E
De Saint Martin
L
Bohec
C
Collet
M
Dignat George
F
Mottier
D. 2013. Unexplained pregnancy
loss: a marker of basal endothelial dysfunction? Fertil Steril.
100: 1013-1017. DOI:10.1016/j.fertnstert.2013.06.008,
PMID:23830152
- [33] Dodds
L
Fell
DB
Dooley
KC
Armson
BA
Allen
AC
Nassar
BA
Perkins
S
Joseph
KS. 2008. Effect of
homocysteine concentration in early pregnancy on gestational hypertensive disorders and
other pregnancy outcomes. Clin Chem.
54: 326-334. DOI:10.1373/clinchem.2007.097469, PMID:18070815
- [34] Kataoka
K
Tomiya
Y
Sakamoto
A
Kamada
Y
Hiramatsu
Y
Nakatsuka
M. 2015. Altered autonomic
nervous system activity in women with unexplained recurrent pregnancy loss. J
Obstet Gynaecol Res.
41: 912-918. DOI:10.1111/jog.12653, PMID:25546149