緒 言
自然流産、妊娠高血圧腎症(Preeclampsia, PE)、子宮内胎児発育遅延(Fetal growth
restriction)など周産期合併症の多くは胎盤形成と密接に関係していることが分かっている。その中で、PEの病態形成として2ステップセオリーが提唱されており、第一ステップとして胎盤形成不全があり、第二ステップとして血管障害が起こるとされている[1]。血管障害に関わる因子としては、多数の因子が同定されており、可溶型血管内皮増殖因子受容体1(VEGFR-1,sFlt-1)、可溶型エンドグリン(sEng)、カテコール-O-メチルトランスフェレース(COMT)、アンギオテンシンIIタイプ1受容体自己抗体(AT1-AA)などがある[2, 3]。一方で、第一段階の胎盤形成不全がなぜ起こるかは不明な点が多い。その病態形成に重要と考えられていることは、絨毛外栄養膜細胞
extravillous
trophoblast(以下EVT)が母体子宮内に浸潤し、らせん動脈をリモデリングすることであり、その機能調節には接着因子、サイトカイン、マトリックスメタロプロテアーゼ、成長因子、免疫細胞等がさまざまな形でその制御に関わる[4]。これまで我々は、細胞自身がもつオートファジー(自食作用)という機構に注目し、EVT機能(浸潤および血管リモデリング)との関係を検討してきた。さらに、PEの病態形成とオートファジーの関与についても概説する。
絨毛外栄養膜細胞浸潤とPE
初期胎盤形成過程においてヒトトロホブラストはvillous trophoblast(VT)とextravillous
trophoblast(EVT)という2つの主要な細胞系列に分化する。VTは胎盤の絨毛を覆うように存在し、母体胎児間のガス交換や栄養および代謝物を、能動的または受動的に輸送する。一方で、EVTは母体側に直接浸潤する細胞であり、ヒト、チンパンジー、ゴリラでは脱落膜化した子宮内膜を越え子宮筋層の約1/3の深さまで浸潤することが知られている。EVTはさらに細分化され、主に子宮のらせん動脈に向かって浸潤するendovascular
EVTとInterstitial
EVTがあるが、その違いがどのようなメカニズムに依存するかは全く不明である。EVT細胞の特性を語る上で最も重要な発見の一つが、Fisherらによって1997年に報告されたもので、低酸素下でEVTは増殖が亢進した[5]。通常、低酸素は細胞にとって強いストレスとなると考えられていただけに、そのストレスの中で細胞増殖が進むことは胎盤研究者のみならず分子生物学者に強い衝撃を与えた。一方で、EVTの浸潤はある一定のルールの中で起こることも特徴である。それらの特徴は癌細胞としばしば対比されるが、①らせん動脈に浸潤するが、静脈には浸潤しないこと
②子宮筋層の1/3までしか浸潤せず、そこで停止すること、である。①に関しては、神経系に類似した分子を介して浸潤が制御されていることが分かってきたが[6]、②に関しては未だ不明な点が多い。
EVTの浸潤は胎盤形成に重要な過程であることは先に述べたが、その浸潤不全が妊娠高血圧症候群(PIH)に関与すると考えられている[2]。その浸潤不全の過程を考える上で我々が注目したのが、初期胎盤におけるEVT浸潤環境周囲における低栄養状態である。妊娠7-12週ではendovascular
EVTがらせん動脈に栓をすることで、能動的に初期胎盤周囲の環境を低酸素と低栄養状態に置くことが知られている[7]。しかしながら、それらの環境は細胞にとってストレスがかかる状況であることは間違いなく、そこで我々は、分子生物学の分野で細胞保全機構として注目を集めていたオートファジーに注目した。
オートファジーとは?
オートファジー=Autophagyのautoは「自己」、phagyはphage等と同義で「食べる」の意味である。日本語では、自食作用とか自己貪食という訳語が使われるが、端的に述べると“細胞内の自己成分分解機能”のことである。細胞を構成するタンパク質などの高分子は、一定期間後細胞によって能動的に分解されており、合成と分解のバランスによって生命は維持されている。それらのバランスを調整する細胞内機構には、プロテアソーム系と呼ばれる短寿命タンパク質の選択的分解を行うシステムと共に、オートファジーと呼ばれる細胞構成成分の多数を占める長寿命タンパク質を非選択的に分解する機構が存在する。具体的には、まず細胞質に隔離膜と呼ばれる扁平な膜区画が出現、湾曲しながら伸長し、細胞質や場合によってはミトコンドリアやペルキシソーム等のオルガネラを包み込む。最後に隔離膜の末端同士が融合し直径約1μmの閉じた2重膜構造が完成し、それをオートファゴソームと呼ぶ。その後リソソームと融合することでオートリソソームとなり自己消化することで、タンパクを除去する[8](図1A)。オートファジーには、主に細胞飢餓によって活性化されるエネルギー産生機構という面と、細胞内の不要タンパクを除去するという2面性をもつ。これらは、共に細胞恒常性の保全メカニズムである。その他、発生・分化、発癌抑制、抗原提示、免疫応答、病原体排除、炎症反応抑制、心不全抑制、糖尿病抑制、プログラム細胞死など多彩な機能に関与する。また、オートファジーと生殖への影響として、オートファジー隔離膜の伸長に必須因子Atg5のノックアウトマウスは、正常に出生するが、出生直後の飢餓(胎盤を介した血液供給の遮断)により、強制的哺乳がなければ、野生型に比し、早期に死亡する[9]。つまり、オートファジーはエネルギー不足を補う機構として、生命の維持に寄与している。
絨毛外栄養膜細胞機能におけるオートファジーの役割
今回の検討は、EVT浸潤が低酸素、低栄養という過酷な環境にありながら、浸潤のためのエネルギーを如何に得るのか?
という疑問に、飢餓時に働くエネルギー産生機構であるオートファジーがEVT浸潤をサポートするのではないか?
という仮説から始まっている。これは筆者らが、EVT細胞のセルラインであるHTR8細胞を2%低酸素培養下において、オートファゴソーム(オートファジーの活性化)を観察したものである[10, 11](図1B)。これは、生理的低酸素(約2%酸素)が、EVTのオートファジーを活性化することを示している。次に、ATG4B遺伝子変異体を発現するレトロウイルスベクター(大阪大学
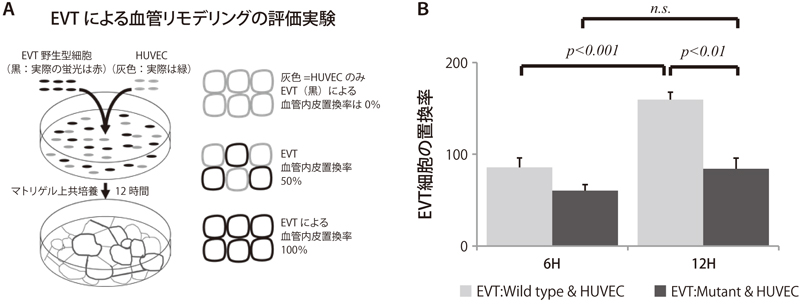
吉森保教授より分与[12])を導入することで、恒常的オートファジー欠損EVTセルライン(以下、AtP欠損細胞)を作成した。その結果、図2で示すように通常のオートファジーが起こる細胞(以下、野生型細胞)では20%酸素と比較し2%酸素刺激によって浸潤能が亢進するのに対し、AtP欠損細胞では2%酸素刺激による浸潤細胞数が有意に減少することが分かった。また、図3Aに示すように、野生型細胞はヒト臍帯静脈由来血管内皮細胞(HUVEC)との共培養によって、時間経過と共に、HUVEC細胞の作る脈管構造をEVT細胞に置換する作用を持つ(血管リモデリングのモデル実験)。そして、EVTによるHUVEC細胞の置換率(12時間)は、AtP欠損細胞において有意に低下することが明らかとなった(図3B)。さらに、コバルト処理(Hypoxia-inducible
factorを強く誘導)による低酸素類似処理において、AtP欠損株では野生型細胞に比し有意に細胞内ATPレベルが低下することも分かった[13]。これらのことは、低酸素刺激によって活性化するオートファジーが、EVT機能(浸潤、血管リモデリング)を支持していることを示している。
可溶型エンドグリンによるオートファジー抑制と妊娠高血圧腎症発症との関連
PEとオートファジーの関係を検討するため、PE関連因子(TNF-α、TGF-β、sENG、sFlt-1)のオートファジーへの影響を検討した。図4Aに示すように、野生型細胞におけるオートファジーは低酸素で活性化したが、sENG存在下で有意にオートファジーが抑制された。機能解析において、低酸素下で亢進する野生型細胞のEVT浸潤は、低酸素下sENG存在下では、浸潤が有意に抑制された(図4B)。一方で、AtP欠損細胞の浸潤にsENGは影響を与えなかった。さらに、野生型細胞の血管リモデリングは、sENG存在下で有意に抑制された(図4C)。sENGに関しては、妊娠初期の絨毛検査においてsENGのmRNAレベルが高い妊婦において、PE発症率が高いことも示されており[14]、sENG高値例においてオートファジー抑制による胎盤形成不全が関与している可能性がある。
最後に、臨床検体とオートファジーの関与を検討するため、胎盤床(胎盤が付着している子宮筋層)のEVT細胞におけるp62/SQSTM1(以下p62)タンパク発現を検討した。p62はオートファジーによって分解される基質で、オートファジー抑制により蓄積する。その発現を解析したところ、PE症例のEVTにおけるp62陽性細胞率は、正常妊娠に比し有意に高値を示した(図4D)。これは、PEのEVT細胞においてオートファジーが抑制されていることを間接的に示唆している。
妊娠におけるオートファジー:今後の展望
これまでに我々はオートファジー抑制がPE発症に関わることを報告してきた。一方で、他のグループからはPE胎盤ではオートファジーが活性化しているという報告もある[15, 16]
。現在我々が進めている検討から、胎盤特異的オートファジー欠損マウスにおいて、胎盤は低形成を示し母獣には高血圧が観察されることが分かっている。つまり、オートファジー欠損は、胎盤低形成のひとつの要因となり得るであろう。一方で、他家で観察されるPE胎盤におけるオートファジーの活性化は、PE軽症例に認められる現象と推測する。PE重症例、特にFGR合併例ではトロフォブラストにおけるオートファジーが枯渇し、オートファジー不全となっていると考えられる。つまり、初期あるいは軽いストレスにはオートファジーが活性化し、その機能が枯渇してくるとPE発症に繋がると考えている。また仮説の域を出ないが、sENGが初期から高い症例などではオートファジーが抑制される状況であり、そのような状態ではPE発症が起こりやすいのではないか、と推測される。現時点では、個々の細胞あるいは各臓器におけるオートファジー機能を推測することは難しいが、今後そのような技術を発見できれば、胎盤におけるPE発症予測ツールとなり得るのではないかと考え、研究を継続していく予定である。さらに、低下したオートファジーを改善することができれば、PEの新たな治療戦略になると考えられる。
References
- [1] J.M. Roberts, C.A. Hubel. 2009. The two stage model
of preeclampsia: variations on the theme. Placenta. 30 Suppl A: S32-37
- [2] Steegers
EA
von Dadelszen
P
Duvekot
JJ
Pijnenborg
R. 2010. Pre-eclampsia.
Lacet.
376: 631-44.PMID:20598363
- [3] Shenoy
V
Kanasaki
K
Kalluri
R. 2010. Pre-eclampsia:
connecting angiogenic and metabolic pathways. Trends Endocrinol. Metab.
21: 529-536. DOI:10.1016/j.tem.2010.05.002, PMID:20646932
- [4] Harris LK. 2010. Review: Trophoblast- Vascular cell
interactions in early pregnancy: How to remodel a vessel. Placenta. 31 Suppl A:
S93-98
- [5] Genbacev
O
Zhou
Y
Ludlow
JW.
Fisher
SJ. 1997. Regulation of Human
Placental Development by Oxygen Tension. Science.
277: 1669-72. DOI:10.1126/science.277.5332.1669,
PMID:9287221
- [6] Red-Horse
K
Kapidzic
K
Zhou
Y
Feng
KT
Singh
H
Fisher
SJ. 2005. EPHB4 regulates
chemokine-evoked trophoblast responses: a mechanism for incorporating the human placenta
into the maternal circulation. Development.
132: 4097-4106. DOI:10.1242/dev.01971, PMID:16107476
- [7] Jauniaux
E
Watson
AL
Hempstock
J
Bao
YP
Skepper
JN
Burton
GJ. 2000. Onset of maternal
arterial blood flow and placental oxidative stress; a possible factor in human early
pregnancy failure. Am J Pathol.
157: 2111-2122. DOI:10.1016/S0002-9440(10)64849-3,
PMID:11106583
- [8] 吉森保.2009.疾患に対抗するオートファジー.実験医学.27:
2918-2923.
- [9] Kuma
A
Hatano
M
Matsui
M
Yamamoto
A
Nakaya
H
Yoshimori
T
Ohsumi
Y
Tokuhisa
T
Mizushima
N. 2004. The role of autophagy
during the early neonatal starvation period. Nature.
432: 1032-36. DOI:10.1038/nature03029, PMID:15525940
- [10] Nakashima
A
Yamanaka-Tatematsu
M
Fujita
N
Koizumi
K
Shima
T
Yoshida
T
Nikaido
T
Okamoto
A
Yoshimori
T
Saito
S. 2013. Impaired autophagy by
soluble endoglin, under physiological hypoxia in early pregnant period, is involved in
poor placentation in preeclampsia. Autophagy.
9: 1-14. DOI:10.4161/auto.22927, PMID:23321791
- [11] 中島彰俊,斎藤滋.2013.絨毛外栄養膜細胞のオートファジー抑制を介した妊娠高血圧症候群発症への関与.産婦人科の実際.62:
1057-1063.
- [12] Fujita
N
Hayashi-Nishino
M
Fukumoto
H
Omori
H
Yamamoto
A
Noda
T
Yoshimori
T. 2008. An Atg4B Mutant
Hampers the Lipidation of LC3 Paralogues and Causes Defects in Autophagosome Closure.
Mol. Biol. Cell.
19: 4651-59. DOI:10.1091/mbc.E08-03-0312, PMID:18768752
- [13] Yamanaka-Tatematsu
M
Nakashima
A
Fujita
N
Shima
T
Yoshimori
T
Saito
S. 2013. Autophagy induced by
HIF1α overexpression supports trophoblast invasion by supplying cellular energy.
PLoS One.
3(8): e76605 DOI:10.1371/journal.pone.0076605,
PMID:24098539
- [14] Farina
A
Sekizawa
A
De Sanctis
P
Purwosunu
Y
Okai
T
Cha
DH
Kang
JH
Vicenzi
C
Tempesta
A
Wibowo
N
Valvassori
L
Rizzo
N. 2008. Gene expression in
chorionic villous samples at 11 weeks' gestation from women destined to develop
preeclampsia. Prenat Diagn.
28: 956-961. DOI:10.1002/pd.2109, PMID:18792924
- [15] Kalkat
M
Garcia
J
Ebrahimi
J
Melland-Smith
M
Todros
T
Post
M
Caniggia
I. 2013. Placental autophagy
regulation by the BOK-MCL1 rheostat. Autophagy.
9: 2140-2153 DOI:10.4161/auto.26452, PMID:24113155
- [16] Akaishi
R
Yamada
T
Nakabayashi
K
Nishihara
H
Furuta
I
Kojima
T
Morikawa
M
Yamada
T
Fujita
N
Minakami
H. 2014. Autophagy in the
placenta of women with hypertensive disorders in pregnancy. Placenta.
35: 974-80 DOI:10.1016/j.placenta.2014.10.009, PMID:25465707