2019 Volume 40 Issue 1 Pages 87-92
2019 Volume 40 Issue 1 Pages 87-92
前立腺癌に対する光線力学技術は,光線力学的療法(Photodynamic therapy: PDT)と光線力学的診断(Photodynamic diagnosis: PDD)に分けられる.PDTは,癌細胞へ特異的に取り込まれる光増感物質に対して治療を行うcellular-targeted photochemotherapyから,血管内の光増感物質に光を照射し,血流を遮断することで抗腫瘍効果を示すvascular-targeted photochemotherapyに移行しており,WST-11を用いた第III相試験で前立腺癌のfocal therapyとしての有効性が示され,臨床応用が期待されている.診断においては,5-アミノレブリン酸を用いた試みが行われているが,さらなる症例の蓄積が必要な段階である.本総説では,前立腺癌に対する光線力学技術について述べる.
本邦において2015年から前立腺癌の罹患数が,男性癌の第1位となり,2016年の罹患数予測は92,600人となった.前立腺癌の死亡数予測は,12,300人となり,男性癌の死亡予測において第6位となった1).前立腺癌への関心が高まり,前立腺癌に対するスクリーニング検査の普及,および前立腺癌の早期発見が増えている2).この状況において,前立腺癌に対する光線力学技術の応用が,様々な方向から試みられ,その有用性に期待されている.
光線力学技術は大きく分けて,光線力学的療法(Photodynamic therapy: PDT)と光線力学的診断(Photodynamic diagnosis: PDD)に分けられる.
PDTにおいては,限局性前立腺癌に対するFocal therapyとしての臨床応用が期待されている.現在の限局性前立腺癌に対する標準治療(手術および放射線治療)には,少なくない副作用およびquality of life(QOL)の低下があるため3),限局性前立腺癌に対して,より副作用およびQOL低下の少ない局所療法が注目を浴びている.限局性前立腺癌に対する局所療法としてはhigh-intensity focused ultrasound(HIFU)4),cryotherapy5),そしてPDTの有用性が報告されている.Windahlら6)が1990年にhematoporphyrin derivativeおよびphotofirinを用いて,前立腺癌患者2症例に対し前立腺癌に対して初めてPDTを行い,前立腺癌に対するPDTの治療効果を示した.しかし,光線過敏症などの強い副作用のため普及しなかった.以降,新たな光増感物質を用いた前立腺癌に対するPDTが報告されてきており,前立腺癌に対する局所療法として,新しい有効な治療法として注目されている.
前立腺癌に対するPDDについても,いくつかの試みが行われている.前立腺全摘除術中の切除断端を決定する診断法としての可能性7)や,尿中に含まれる前立腺癌細胞に対するPDDの有用性8)が報告されている.
本総説においては,これらの前立腺癌に対する光線力学技術について述べる.
前立腺癌に対するPDTには,cellular-targeted photochemotherapy(CTP)と,vascular targeted photochemotherapy(VTP)の2通りの方法がある9-11).光増感物質が癌細胞や組織に集積し,その光増感物質に光が当たることで癌細胞に障害が起こり,抗腫瘍効果を示すcellular-targeted photochemotherapy(CTP)と,光が目的とする組織の血管内に存在する光増感物質に当たることで,血管が閉塞し,腫瘍への血流が遮断され,抗腫瘍効果を示すvascular targeted photochemotherapy(VTP)の2つがある.
CTP:光増感物質が経口または経血管的に投与され,目的とされる癌細胞や組織に取り込まれる.そこに,ある特定の波長の光が当たることで,光増感物質は基底状態(S0)から一重項励起状態(S1)となる.S1となった光増感物質は,蛍光を発してS0へ戻る場合と,三重項状態(T1)へと変換される場合がある9,11,12).前者のS1からS0に戻る際に発せられる蛍光がPDDに用いられる.一方で,後者のT1がPDTにおいて重要であり,T1と周囲の分子との相互作用により,細胞死や細胞の変性を導くとされている9,11,12).その機序として,電子伝達により細胞死や細胞の変性を導くとされているtype Iとエネルギー伝達により細胞死や細胞の変性を導くとされているtype IIの2つの機序があるとされている.Type Iは,T1および周囲の物質間で電子伝達が行われ,反応性の高いフリーラジカルやラジカルイオンの生成が起こり,これらが酸素分子と反応しreactive oxygen species(ROS)が生成され,このROSが生物学的障害を癌細胞に与える機序である9-12).Type IIは,T1と基底状態の酸素分子へのエネルギー伝達により一重項酸素(1O2)が生成され,この1O2が癌細胞の細胞死を導く機序である9-12).Type IおよびType IIの機序で導かれた細胞死や細胞障害に関しては,apotosisやnecrosis,autophagyが関与しているとの報告がされているが,癌種や,光増感物質の種類および投与量,光の強さによって結果に違いがあり,まだ十分に解明されていない部分が存在する11)(Fig.1).このように,癌細胞や組織に存在する光増感物質に対して行うPDTをCTPと分類する.

mechanism of cellular-targeted photochemotherapy (CTP). ROS: reactrive oxygen species.
VTP:VTPに用いられる光増感物質が血管内に投与されると,ほとんどまたは,全く血管外へ流出することなく,光によって消失するまで血管内で循環する13,14).目的とする臓器へ光が照射されると,目的とする臓器の血管内に存在する光増感物質に光が当たり,酸化ストレスが発生,血管内皮がダメージを受け,血栓の形成,血液のうっ滞,血管の閉塞が起こり,その血管より先にある腫瘍病変に障害が起こる15)(Fig.2).このように,標的とする組織の血管内に存在する光増感物質に対して行うPDTをVTPと分類する.

mechanism of vascular targeted photochemotherapy (VTP). PS: photosensitizer substance.
上述したとおり,CTPおよびVTPどちらにおいても,PDTには,光増感物質,光そして酸素の3つが必須である9-11).
2.2 前立腺癌におけるPDT前立腺癌に対するPDTとして様々な光増感物質を用いた報告がされている(Table 1).
| 光増感物質 | 機序 | 励起光波長 | 投与経路 | 利点 | 欠点 |
|---|---|---|---|---|---|
| Photofrin | CTP | 405 nm | 経血管 | 第一世代の光増感物質 | 遷延する光過敏症 |
| 低い腫瘍特異性 | |||||
| 投与から治療への時間 | |||||
| mTHPC | CTP | 652 nm | 経血管 | 投与から治療への時間短縮 | 遷延する光過敏症 |
| 腫瘍への特異性の向上 | |||||
| 5-ALA | CTP | 410 nm | 経口 | 天然アミノ酸 | 深達度が低い |
| 光過敏症が少ない | |||||
| 腫瘍特異性の向上 | |||||
| WTS-11 | VTP | 763 nm | 経血管 | 光過敏症がない | 現在のところ報告なし |
| 投与から治療への時間が短い | |||||
| 波長が長く深達度が高い |
ALA: aminolevulinic acid, CTP: cellular-targeted photochemotherapy, mTHPC: mesotetra (hydroxyphenyl)chlorine, VTP: vascular targeted photochemotherapy
第一世代の光増感物質であり,CTPとして効果を示す.肺癌や,胃癌,子宮頸癌,食道癌においてはPhotofrinを用いたPDTが本邦でも行われている.前立腺癌に関しては,1990年にWindahlら6)が前立腺患者2例にPDTを行い,報告している.経尿道的前立腺切除術(TUR-P)を2回行い,その6週後に,1例目は1.5 mg/kgでhematoporphyrin derivativeを,2例目には2.5 mg/kgでphotofrinを光増感物質として投与し,前立腺部尿道にボール型のデフューザーチップを留置し,405 nmの波長の光を用いて48–72時間かけてPDTを行っている.1例目は,6ヵ月後にPDTおよび前立腺癌とは別の死因で死去され,その後の解剖にて前立腺に癌を認めなかったとしている.2例目はPSAが6 μg/Lから治療5ヵ月後には0.2 μg/Lまで低下したと報告している.良好な治療成績が得られているが,以降前立腺癌に対してHematoporphyrin derivative やphotofrinを用いたPDTは報告されていない.これは,長期におよぶ光過敏症11),2回のTUR-Pが必要であること,および投与から治療までに長時間かかる11)という手技の煩雑さから,Hematoporphyrin derivative およびPhotofrinを用いたPDTは前立腺癌に対して行われなくなったと考える.
2.2.2 Mesotetra (hydroxyphenyl)chlorine(mTHPC)第二世代の光増感物質として前立腺癌に対するPDTが試みられている.mTHPCもCTPとして効果を示す.mTHPCはPhotofrinよりも癌に特異的に集積し,100–200倍第一世代と比較して効率が良いとされている9).Mooreら16)は6例の限局性前立腺癌にmTHPCを用いたPDTを行っている.mTHPCを血管内に投与し,前立腺針生検で癌が検出されたのと同葉側にMRIガイド下で経会陰的に針を刺入し,光(波長:652 nm)を照射しPDTを行っている.6例中4例には2回のPDTを行っている.67%までPSAが低下していたが,治療1ヵ月後の前立腺針生検では前立腺癌が6例すべてに認められた.mTHPCを用いた前立腺癌に対するPDTは一定の治療効果は認めたものの,効果として不十分であり,光過敏症などの副作用,mTHPCの提供先の消滅などの問題から9),mTHPCを用いたPDTは行われなくなった.
2.2.3 5-aminolevurinic acid(ALA)5-ALAは生態内に存在する天然アミノ酸であり,ヘム合成経路における前駆物質である17).Photofrinを初めとする第1,2世代の光増感物質は,非天然物質であり,正常組織からの排泄の遅延のため光過敏症が問題であり,さらに癌特異的な集積も決して高いものではなかった.しかし,5-ALAは,天然アミノ酸であるため毒性が低く,正常細胞での代謝排出も早いため,光過敏症の心配は少ないか,全くない18).そのため,投与後の遮光も不要とされている18).さらに癌特異性も高く,CTPとしての光増感物質としてより理想的な物質と考えられる.また,その他の特徴としては投与経路が経口投与であることも特徴の一つとして挙げられる18,19).
欧州では皮膚癌に対して,5-ALAを用いたPDTが行われているが,前立腺癌において,5-ALAを用いたPDTを臨床で行った報告は1件にとどまる.Zaakら20)は5-ALAを20 mg/kgで投与し,4時間後に経尿道的(n = 3),経会陰的(n = 2)にファイバーを挿入し,PDTを行い,PSA低下が20%–70%に見られたと報告をしている.しかし,その後の追加の報告,長期成績は報告されておらず,5-ALAを用いたPDTは行われていないのが現状と考えられる.5-ALAは400–410 nmの短い励起光により行われるため,深達度が低く,十分な治療効果が得られない可能性があること7)がその原因の一つとして考えられる.また,Bozziniら21)は,ラットの前立腺癌に対して5-ALAを用いたPDTの有効性を検討しているが,5-ALAを用いたPDTは組織が低酸素状態であれば効果が認められず,PP IXが腫瘍部にあまり存在しなかったことを報告しており,こういった面からも5-ALAを用いたPDTは検討されなくなったと考える.
CTPによるPDTは,上述してきたように,光過敏症といった副作用,薬物の投与から光の照射までの時間が長いといった煩雑さ,neruovasucular bandleや尿道括約筋の損傷による下部尿路症状の可能性,さらに,波長が短いために光が十分に腫瘍組織に届かず不十分な治療効果に終わる可能性,などの問題22)から,前立腺癌に対しては行われなくなり,VTPに移行していったと考えられる.
2.2.4 WST-09,WST-11(TOOKAD®)VTPに用いられる光増感物質は血管内に投与され,その後,ほとんど,または全く血管外へ流出することなく,光が当たり消失するまで血管内で循環する13,23).光が目的とする臓器へ照射されると,目的とする臓器の血管内に存在する光増感物質に光が当たり,酸化ストレスが発生し,血管が閉塞,血流が遮断され,抗腫瘍効果を発揮する13,24).照射する光の波長が760 nmであり,CTPで用いられる波長よりも長く,深達度がCTPよりも高いことが22)VTPの利点である.
Padoporfin(WST-09, Tookad®)を用いて,限局性前立腺癌に対するPDTの可能性が検討された.論文としては報告されておらず,abstractまでの報告25)であるが,MRIによる評価で治療効果が得られたと報告している.しかし,高血圧や,心血管イベント,そして血液毒性が認められ,副作用の問題が残った26).そこで,次にその問題点を改善するため,水溶性のpadeliporfin(WST11, Tookad soluble®)の有用性,安全性が検討された.WST11を用いた前立腺癌に対するPDTが検討され,ランダム化試験でその有用性,安全性が報告された26).低リスク前立腺癌(Gleason pattern 3,PSA 10未満,cT2a)に対して,オープンラベルでWST11によるPDTを行う(PDT)群対active surveillance(AS)群にランダム化し,24ヵ月以内における中リスクや高リスク前立腺癌への無増悪生存について検討している.中央無増悪生存期間が,PDT群で28.3ヵ月,AS群で14.1ヵ月であり,有意にPDT群で無増悪生存期間の延長が認められた(p < 0.0001).治療後24ヵ月においてPDT群がhazard ratio 0.34,95%信頼区間0.24–0.46とAS群と比較して,有意に無増悪を認めなかった.QOLにおいては,IIEF-15とIPSSを用いて評価しており,治療後24ヵ月において2群間にはQOLの差を認めなかったと報告している(治療3ヵ月後ではPDT群にQOLの低下を認めているが).さらに,WST11に関連する重篤な副作用は認めなかったとして,安全性についても良好な成績を示した.この第III相試験により,WST11を用いたPDTが低リスク前立腺癌に対するfocal therapyの新たな治療法として期待されている.
前立腺癌に対するPDTは,光増感物質が癌細胞に集積し,そこに光を当て治療効果を得るCTPから,血管内に存在する光増感物質に光が当たることで血流を遮断し抗腫瘍効果を生み出すVTPが中心となっていくことが予測される.特にWST11を用いたVTPが,限局性前立腺癌に対して,副作用やQOLの低下の少ない有効な治療法として発展していくことに期待が寄せられている.
2.3 前立腺癌に対するPDDPDDに関しては,腫瘍特異的な蛍光を認めることが重要であり,PDTの項で述べたWST11のような血管内を循環するような光増感物質ではなく,腫瘍特異的に取り込まれ,腫瘍特異的に蛍光を示す光増感物質が必要とされる.つまり,CTPとして用いられる光増感物質がPDDには有用で,その中でも,5-ALAが副作用の少なさ,そして癌特異性において他のCTPとして使用される光増感物質より優れている.そのため,前立腺癌に対する5-ALAを用いたPDDの可能性についていくつかの報告がなされている.
2.3.1 5-ALA5-アミノレブリン酸(aminolevulinic acid: ALA)は天然アミノ酸の1種で,内因性には細胞のミトコンドリア内でグリシンとスクシニルCoAから生合成され,ヘム合成経路を辿る.途中で一旦,サイトゾルへ移動して再びミトコンドリア内へ戻り,プロトポルフィリンIX(Pp IX)を経てヘムが合成される27)(Fig.3).癌細胞においては,Pp IXと2価鉄からヘムを合成するフェロキラテース(FECH)の発現低下28,29)やPEPT1の発現亢進による5-ALAの取込み増加やABCG2の発現低下によるPp IXの排出減少30,31)などから,外因性に5-ALAを投与すると正常細胞に比べて大量のPp IXが癌細胞に蓄積する.癌細胞に蓄積したPp IXは蛍光物質であり,400–410 nmの青色励起光を照射すると600 nm付近(635 nmにピーク)の赤色蛍光を発する.この原理を利用して,5-ALAを診断薬とした癌のPDDが開発された27).5-ALAを用いたPDDは,グリオーマおよび膀胱癌においてすでに臨床応用されている.
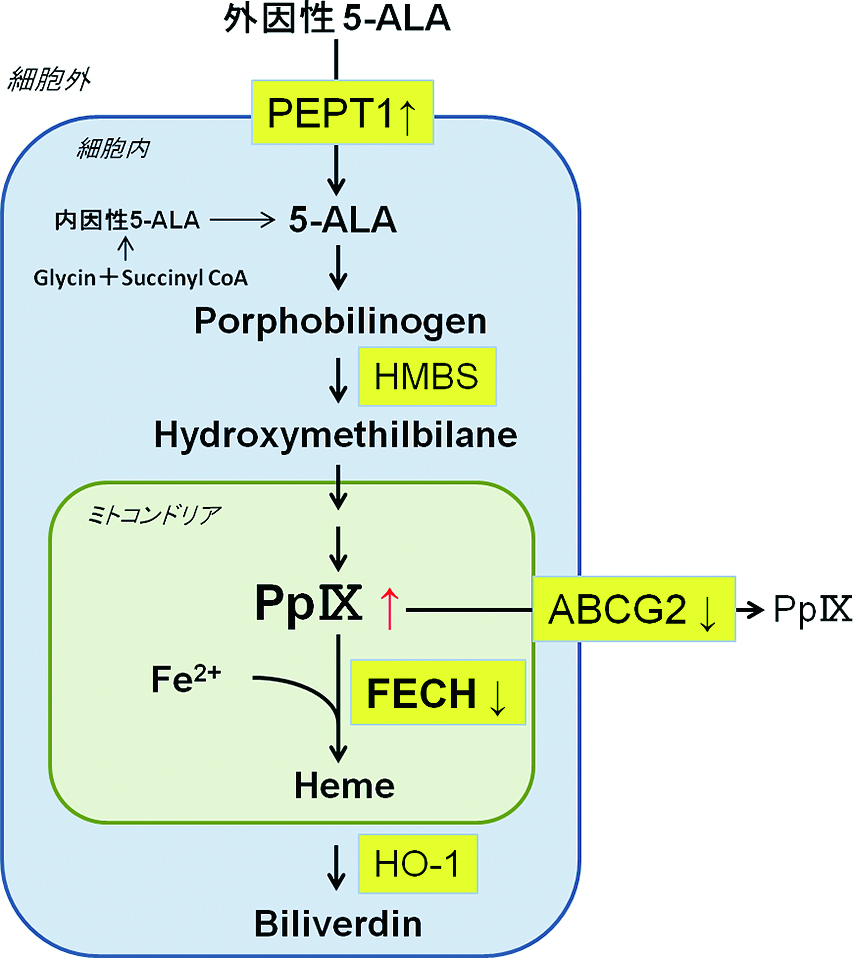
mechanism of PDD using 5-aminolevulinic acid PEPT1: peptide transporter, HMBS: hydroxymethilbilane synthase, ABCG2: ATP-binding cassette sub-family G member 2, FECH: ferrochelatase, HO-1: heme oxygenase-1.
Adamら32)は,前立腺全摘除術における術中のsurgical marginの診断のために5-ALAを用いたPDDを第II相試験で検討している.13/39症例中に断端陽性が認められ,そのうち11例において,5-ALAを用いたPDDで,術中に断端陽性部に蛍光を確認できたと報告している.このことから,術中の切除範囲を決定するツールとしての可能性が示された.その後Fukuharaら33)も前立腺全摘除術中のsurgical marginの診断のために5-ALAを用いたPDDの有用性を示しているが,第III相試験は行われておらず,5-ALAを用いたPDDを用いた切除断端を決定する方法は,臨床応用までには至っていない.
異なったアプローチとして,Nakaiら8)は前立腺マッサージ後の尿中に含まれる前立腺癌細胞に対して,体外にて5-ALAで処理した後,蛍光強度を測定し,尿中に含まれる前立腺癌細胞に対するPDDの有用性を報告している.AUC 0.74,感度77%,特異度67%と,精度の高い結果を示しており,前立腺針生検を行うかを決定する診断方法としての応用が期待されるが,さらなる症例の蓄積が必要である.
前立腺癌に対する光線力学技術として,WST11を用いたPDTが限局性前立腺癌に対するfocal therapyの一つとして臨床応用されようとしている.一方で,PDDとしては5-ALAを用いた診断方法が,副作用の少なさや,癌特異性の高さから試みられているが,今後さらなる検討,症例の蓄積が必要であると考えられる.
前立腺癌に対する光線力学技術がいろいろな角度から試みられており,有効な治療および診断方法として可能性が示されている.しかし,前立腺癌に対する光線力学技術に関しては未だに不十分な面があり,前立腺癌の特性を考慮した,さらなる検討,症例の蓄積が必要であると考える.
開示すべき利益相反なし.