2023 年 18 巻 1 号 p. 11-18
2023 年 18 巻 1 号 p. 11-18
【目的】メトロニダゾールゲル(ロゼックス®ゲル0.75%:以下,本剤)について,長期使用時を含む使用実態下の安全性と有効性に関する情報を収集する目的で使用成績調査を実施した.【方法】がん性皮膚潰瘍部位の殺菌・臭気の軽減のために本剤を初めて使用する患者を中央登録方式にて登録した.観察期間は最長1年とした.【結果】安全性解析対象は301例であった.副作用発現割合は3.32%(10/301例)で,すべて非重篤であった.全般改善割合は73.7%(205/278例)であった.最終観察時の医師評価によるにおい改善割合は80.2%(203/253例)で,患者の治療満足割合は70.1%(82/117例)であった.【結論】使用実態下において,本剤ががん性皮膚潰瘍部位の殺菌・臭気の軽減に対し,安全かつ有効な治療薬であるとともに,本剤の使用により,患者の高い治療満足度が得られることが明らかとなった.
Objective: The drug use-results survey of Metronidazole gel (Rozex® gel 0.75%: hereinafter, this is called “this medicine”) was conducted for the purpose of assessing the safety and effectiveness of this medicine in clinical practice including long-term use. Methods: Patients who initiated treatment with this medicine for sterilization and reduction of odor at cancerous skin ulcer for the first time were registered by the central registration method. The longest period of observation was 1 year. Results: The safety analysis set included 301 patients. The incidence proportion of adverse drug reaction was 3.32% (in 10 of 301 patients), with no serious events. The overall improvement rate was 73.7% (in 205 of 278 patients). At the final observation, the improvement rate of odor by physician's assessment was 80.2% (in 203 of 253 patients) and the improvement rate of patient's satisfaction was 70.1% (in 82 of 117 patients), respectively. Conclusion: The present study demonstrated that this medicine is safe and effective for sterilization and reduction of odor at cancerous skin ulcer, and leads to high treatment satisfaction of patients.
がん性皮膚潰瘍は,がん細胞の皮膚表面への直接浸潤,または皮膚への転移によって起こり,5–14%の頻度で認められる1).さらに,皮膚潰瘍部位から特有の不快な臭気(がん性悪臭)を伴うことが知られており,大量の滲出液,痛み,および出血リスクによる精神的苦痛に加え,患者や家族のQuality of Life(QOL)低下を誘発するため,がん性悪臭への治療の重要性が認識されている2–5).しかしながら,わが国ではがん性皮膚潰瘍に伴う悪臭に対する効能・効果を有する医薬品がなかったため,未承認薬・適応外薬であるメトロニダゾールが院内製剤として調整され,臨床現場で使用されている状態が続いていた6,7).メトロニダゾールは,ニトロ基の還元によって活性化され,嫌気性細菌のDNA活性を阻害し,複製を妨げるラジカルを形成することで殺菌・臭気軽減効果を示す8).2010年に日本緩和医療学会および日本緩和医療薬学会から厚生労働省に対して,がん性皮膚潰瘍に伴う悪臭の軽減を目的としたメトロニダゾール外用剤の市販に関する要望書が提出された.その結果,厚生労働省はガルデルマ株式会社に対して,がん性皮膚潰瘍に伴う悪臭の軽減を目的としたメトロニダゾール外用剤の開発を要請した.その後,メトロニダゾールゲル(ロゼックス®ゲル0.75%:以下,本剤)は,2012年4月より国内第III相臨床試験が実施され9),2014年12月に国内初の「がん性皮膚潰瘍部位の殺菌・臭気の軽減」の効能・効果で承認された.なお,本剤の製造販売承認は,2018年3月にガルデルマ株式会社からマルホ株式会社へ承継されている.
承認申請時の国内第III相臨床試験の対象患者は,乳がん患者21例で,使用期間は14日のみであった.しかしながら,臨床現場では,乳がん以外のがん患者や皮膚潰瘍面積の大きい患者等のさまざまな患者への使用とともに,長期使用される場合が想定される.そこで,長期使用時を含む使用実態下の安全性と有効性,乳がん以外のがん患者に対する安全性と有効性,1日使用量と安全性との関連等について検討するため,本剤の医薬品リスク管理計画に基づく使用成績調査を実施した.
本調査は,医薬品の製造販売後の調査および試験の実施の基準に関する省令(平成16年12月20日厚生労働省令第171号,平成25年3月11日厚生労働省令第26号)に則り実施した.
対象患者本調査の対象患者は,すべてのがん種とし,がん性皮膚潰瘍部位の殺菌・臭気の軽減のために本剤を初めて使用する入院患者,または外来患者とした.ただし,メトロニダゾール外用剤を過去に使用された患者,本剤の禁忌である,メトロニダゾールに対し過敏症の既往歴のある患者,脳・脊髄に器質的疾患のある患者並びに妊娠3カ月以内の女性は除外とした.
調査方法本調査は日常診療における本剤の使用実態下の非介入の観察研究であり,本剤は,承認時の用法・用量である「症状および病巣の広さに応じて適量を使用する.潰瘍面を清拭後,1日1~2回ガーゼ等にのばして貼付するか,患部に直接塗布しその上をガーゼ等で保護する」に従って使用した.患者登録は中央登録方式とし,担当医師が5日以内に登録票を症例登録センターへFAXすることした.観察期間は本剤使用開始から3カ月間とし,本剤の安全性および有効性について調査した.3カ月を超える使用症例は,長期継続使用例として最長1年間まで安全性について追跡調査した.目標症例数は300例とし,調査は2016年3月15日から2020年12月25日までの期間で実施した.
調査項目性別,年齢,がん種等の患者背景因子,本剤使用開始時の所見,前治療薬,本剤の使用状況,併用薬・併用療法・処置,有害事象,本剤使用の継続・終了・中止(観察期間終了時),においスコアの臨床経過,においが生活に与える影響の患者アンケートおよび全般改善度を収集した.重点調査項目は,未知の副作用の発現状況,使用実態下における副作用の発現状況とし,重要な特定されたリスクである潰瘍部位からの出血および重要な潜在的リスクである末梢神経障害について十分な検討を行うこととした.
評価方法においスコアは,担当医師および患者が,本剤使用開始前,使用開始7日後までの毎日,使用開始14日前後,その後は2週間ごとおよび最終観察時に評価し,スコアは「0:においがない,1:においはあるが不快でない(皮膚潰瘍の近傍[20 cm]でわずかに臭う),2:軽度に不快なにおい(皮膚潰瘍の近傍で明らかに臭う),3:中等度に不快なにおい(ベッドサイドで臭う),4:非常に不快なにおい(部屋に入ると臭う)」の5段階とした.最終観察時のにおいスコアが「0:においがない」または「1:においはあるが不快でない」と評価された症例の割合をにおい改善割合とした.
患者アンケートは,本剤使用開始前,使用開始14日前後,使用開始4週前後,使用開始12週前後および最終観察時に実施し,がん性皮膚潰瘍のにおいがライフスタイル,家族との人間関係,友人・他人との人間関係および外出に与える影響に関して各々5段階(1–5)で評価した.また,最終観察時の治療満足度についても5段階で評価し,「1:かなり満足している」または「2:やや満足している」とした症例の割合を患者の治療満足割合とした.
医師による全般改善度は,担当医師が本剤使用開始前と使用開始後を比較し,においスコアの臨床経過,患者アンケートの結果等から患者の改善度を総合的に判断して,3段階(改善,不変,悪化)で評価し,「改善」と評価された症例の割合を全般改善割合と定義した.
がん性皮膚潰瘍の大きさは,担当医師が本剤使用開始前と比較して,使用開始14日前後,4週前後,12週前後および最終観察時に,3段階(拡大,不変,縮小)で評価した.
解析方法量的変数は,平均,標準偏差,最小,最大,四分位数を算出した.カテゴリー間の検定は,カテゴリーが二つの場合はFisherの正確検定,三つ以上のカテゴリーの場合は,順序性がある場合はCochran-Armitage検定とし,順序性がない場合(年齢を含む)はχ2検定を実施した.においスコアの変化,患者アンケート結果はWilcoxonの符号付き順位和検定を用いた.検定の有意水準は両側5%とした.すべての集計解析にSAS 9.4(SAS Institute Japan,東京)を用いた.
78施設において304例が登録され,全症例の調査票を回収した.登録違反の3例を除く301例を安全性解析対象症例とし,承認外の用法・用量の21例,有効性のデータがない2例を除く278例を有効性解析対象症例とした(付録図1).
患者背景,治療状況を表1に示した.女性が92.0%(277/301例),男性が8.0%(24/301例)であった.15歳以上65歳未満の患者が50.2%(151/301例),65歳以上が49.8%(150/301例)であった.本剤使用開始時のがん性皮膚潰瘍の大きさは「10 cm2以上50 cm2未満」が37.2%(112/301例)と最も多く,次いで「10 cm2未満」が17.3%(52/301例)であった.「150 cm2以上」の症例は15.3%(46/301例)含まれていた.がん種は「乳がん」が85.0%(256/301例),「乳がん以外」は15.0%(45/301例)で頭頸部がんと皮膚悪性腫瘍が12例ずつと最も多かった.本剤使用開始時の入院患者の割合は32.6%(98/301),外来患者の割合は67.4%(203/301例)であった.前治療薬は「無」が86.4%(260/301例),「有」が13.3%(40/301例)であり,主な薬剤は白色ワセリン,ゲンタマイシン硫酸塩,ヨウ素であった.併用薬は「無」が51.5%(155/301例),「有」が48.5%(146/301例)であり,主な薬剤は白色ワセリン,ジメチルイソプロピルアズレン,モーズペーストであった.
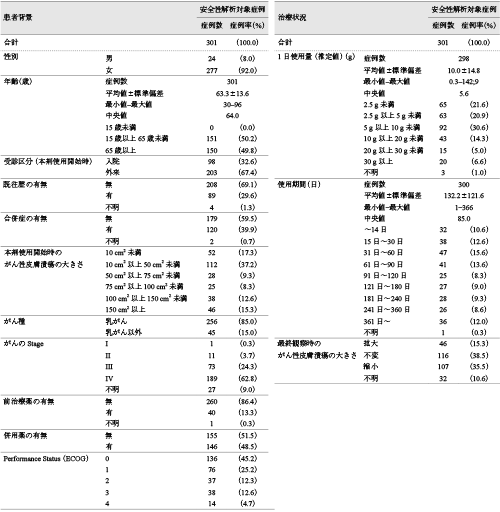
本剤の1日使用量(推定値)の中央値は5.6 gであり,約70%の症例は10 g未満であった.使用期間の中央値は85.0日であり,14日を超えて使用された症例は89.0%(268/301例),観察期間である3カ月(90日)を超えて使用された症例は47.2%(142/301例)であった.1日使用量(推定値)の平均値はがん性皮膚潰瘍の大きさに応じて高かった(付録表1).最終観察時に,がん性皮膚潰瘍の大きさが「拡大」した症例が15.3%(46/301例),「不変」が38.5%(116/301例),「縮小」が35.5%(107/301例)であった.
観察期間終了前に治療もしくは経過観察が中止された症例は59.5%(179/301例)であった.中止理由は,「死亡のため」が18.9%(57/301例)と最も多く,次いで「転院のため」が15.9%(48/301例)であった.
副作用発現割合は3.32%(10/301例)であった(表2).「適用部位疼痛」が3例,「適用部位乾燥」が1例,「滲出液」が1例,「適用部位出血」が6例ですべて非重篤であった.なお,安全性解析から除外した1例(メトロニダゾールに対する過敏症の既往歴)において,非重篤な「適用部位そう痒感」が認められた.未知の副作用は「滲出液」1例であった.
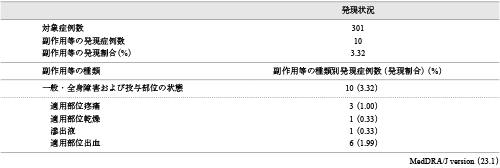
重要な特定されたリスクである「潰瘍部位からの出血」の発現割合は1.99%(6/301例)ですべて非重篤であった.重要な潜在的リスクである「末梢神経障害」の発現は認められなかった.
副作用を発現した症例10例のうち,6例が本剤使用開始後14日以内に認められ,すべての副作用が3カ月(90日)以内に認められた(付録表2).
がん種別の副作用発現割合は,乳がん患者が3.52%(9/256例),乳がん以外が2.22%(1/45例)であり,がん種による差は認められなかった(P=1.000).また,1日使用量(推定値)別の副作用発現割合は,2.5 g未満で1.54%(1/65例),2.5 g以上5 g未満で0%(0/63例),5 g以上10 g未満で5.43%(5/92例),10 g以上20 g未満で2.33%(1/43例),20 g以上30 g未満で6.67%(1/15例),30 g以上で5.00%(1/20例)であり,1日使用量(推定値)による差は認められなかった(P=0.187).
においスコアの臨床経過推移を図1に示した.医師および患者評価ともに本剤使用開始1日後から12週までの全観察時点で開始前に比べて有意な改善が認められた(P<0.001)(付録表3).最終観察時の医師評価のにおい改善割合は全症例で80.2%(203/253例)であり,乳がん患者では84.0%(179/213例),乳がん以外では60.0%(24/40例)であった.最終観察時の患者評価のにおい改善割合は全症例で85.5%(207/242例),乳がん患者では87.7%(179/204例),乳がん以外では73.7%(28/38例)であった(付録表4).
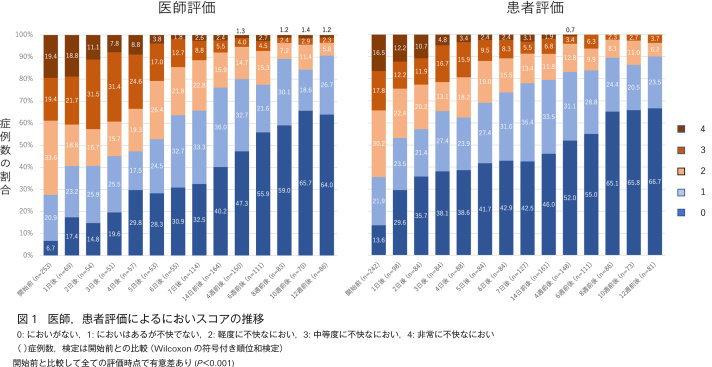
がん性皮膚潰瘍のにおいが生活に与える影響についての患者アンケートスコアの推移を図2に示した.本剤使用開始前と比べて,使用開始14日前後から12週までの全観察時点で,4項目において有意な改善が認められた(P<0.001)(付録表5).

医師による全般改善度および最終観察時における患者の治療満足割合を表3に示した.治療満足割合は,全症例で70.1%(82/117例),乳がん患者で73.7%(73/99例),乳がん以外で50.0%(9/18例)であった.
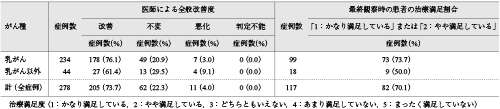
全般改善割合は全症例で73.7%(205/278例),乳がん患者で76.1%(178/234例),乳がん以外で61.4%(27/44例)であった.要因別の全般改善割合では,「最終観察時のがん性皮膚潰瘍の大きさ」,「がん切除の有無」,「がんのStage」,「Performance Status(ECOG)」,「1日使用量(推定値)」で有意差が認められたが,がん種による差は認められなかった(付録表6).
本調査は,乳がん以外のがん患者45例を含む計301例を対象に実施された.海外では少数例の臨床報告が散見されるが10,11),日常診療における,多数例の臨床報告は本調査が初となる.また,観察期間についても,最長1年にわたっており,その臨床的価値は高いと考える.
本調査における安全性解析対象症例301例において,重要な特定されたリスクである「潰瘍部位からの出血」の発現割合は1.99%(6/301例)であったが,いずれも非重篤で,転帰は回復または軽快であった.本剤以外の要因として原疾患の影響や外的刺激が考えられた.国内第III相臨床試験では9.5%(2/21例)に副作用が認められ,いずれも潰瘍部位からの出血で,非重篤であった9).本調査の「潰瘍部位からの出血」の発現割合は,国内第III相臨床試験と比較して低く,いずれも非重篤で転帰が回復または軽快であることから,リスクはあるものの対応を要する大きな課題ではないと考える.
本調査では3カ月(90日)を超えて本剤を使用した症例を長期継続使用例としたが,副作用はすべてが3カ月(90日)以内に発現し,かついずれも非重篤であり,長期使用時の安全性に問題はないと考える.
乳がん患者と乳がん以外のがん患者の副作用発現割合に有意差は認められず,乳がん以外の患者についても安全性上の問題は認められなかった.また,1日使用量と安全性に明らかな関連が認められず,使用量の増大に伴って副作用発現割合が増加する可能性は低いと考える.
本剤の有効性に関して,本調査において医師が評価したにおい改善割合は全症例で80.2%(203/253例)と,十分な有効性が確認されているものの,国内第III相臨床試験の95.2%(20/21例)9)と比較するとやや低値を示した.
本調査では国内第III相臨床試験とは異なり乳がん以外のがん患者が含まれるとともに,皮膚潰瘍面積が150 cm2以上と国内第III相臨床試験と比べ,より重症の症例が含まれていた.また,1日使用量(推定値)の中央値は本調査で5.6 g,国内第III臨床試験で24.6 gであり,使用期間の中央値は本調査で85.0日,国内第III臨床試験で14.0日と,使用量や使用期間にも大きな相違があった.このように患者背景や本剤の使用状況が異なることから,有効性の指標であるにおい改善割合について,本調査と国内第III相臨床試験の結果を直接比較することは適切ではない.しかしながら,本調査の8割以上の症例においてにおいスコアの改善が認められ,医療現場で求められる十分な有効性が確認できたと考える.
においスコアは医師および患者評価ともに本剤使用開始1日後から有意に改善(P<0.001)し,12週まで経時的な改善が認められた.においは患者よりも医療従事者がより敏感に認識するとの報告9)があり,患者が自分のにおいに気づかないことが悩みの一つとして挙げることができる.しかしながら,本調査では,患者と医師双方でにおいスコアが早期かつ経時的な改善を示したことから,本剤による治療は上記の悩みを有する患者にも有用であると考える.
本調査では,がん性皮膚潰瘍のにおいがライフスタイル,家族との人間関係,友人・他人との人間関係および外出に与える影響について患者アンケートを行った.全項目において本剤使用開始14日前後でスコアが有意に改善(P<0.001)し,12週まで経時的な改善が認められた.また,最終観察時の患者の治療満足割合は全症例で70.1%(82/117例)と高い結果であった.本剤の使用は,においが患者の生活に与える影響を改善するとともに,患者に高い治療満足度を与えた.
においスコアや患者アンケートの結果等から医師が総合的に評価した全般改善割合は全症例で73.7%(205/278例)と,十分な有効性が確認された.がん種による差は認められなかった.
本調査にはいくつかの限界がある.本調査は日常診療下における非介入の観察研究であり,においの原因である原疾患の経過,評価時の環境条件,ドレッシング材の交換頻度や患部の洗浄方法など本剤の詳細な使用方法等の情報は入手していない.また,メトロニダゾールは一部の細菌について複数の耐性誘導機構が報告されており12),抗菌作用を有する本剤を長期連用する際には耐性菌の懸念にも留意する必要があるが,本調査においては本剤の使用による細菌の耐性化については検討していない.本剤の有用性をより詳細に評価するためには上記の諸要因についてのさらなる検討が必要である.
以上の通り,本調査結果から,本剤の使用ががん性皮膚潰瘍のにおいとにおいが患者の生活に与える影響を改善するとともに,患者に高い治療満足度を与えることが確認できた.がん性皮膚潰瘍のにおいは,患者にとっての大きな精神的ストレス1)であり,そのにおいを軽減する本剤の高い有用性が示されたものと考える.
本剤を使用した患者における安全性に関しては,重篤な副作用はなく,副作用の頻度も低かった.すべての副作用が3カ月(90日)以内に発現しており,遅発性の副作用も認められなかった.
においスコア(医師/患者)は本剤使用開始1日後から改善し,以降12週まで経時的に改善した.患者アンケートは全項目で12週まで経時的に改善が認められるとともに,患者の高い治療満足度が示された.全般改善割合についても十分な有効性が確認され,がん種による差は認められなかった.
本調査により臨床現場における本剤の有効性および安全性が明らかになったことから,これらの情報は本剤の更なる適正使用に貢献できるものと考える.
本調査にご協力いただき,貴重なデータをご提供いただきました調査担当医師の先生方に厚く御礼申しあげます.
本調査に際しての経費は,マルホ株式会社が負担した.桑山隆志,中村清吾は,本調査の実施に際し,医学専門家としてアドバイザー料を受けている.横田成彬,可児毅,村上尚史,松井慶太は,マルホ株式会社の社員である.
桑山,中村は研究の構想もしくはデザイン,研究データの解釈,原稿の重要な知的内容に関わる批判的な推敲に貢献した.横田,松井は研究データの収集,分析,解釈,原稿の起草,原稿の重要な知的内容に関わる批判的な推敲に貢献した.可児は研究の構想もしくはデザイン,研究データの収集,分析,解釈,原稿の起草,原稿の重要な知的内容に関わる批判的な推敲に貢献した.村上は研究データの解釈,原稿の起草,原稿の重要な知的内容に関わる批判的な推敲に貢献した.すべての著者は投稿論文並びに出版原稿の最終承認,および研究の説明責任に同意した.