我々は、変形性関節症(OA)および関節リウマチ(RA)患者の滑膜組織から滑膜細胞を調製し、分譲している。ここに本細胞の軟骨分化能を調べ、間葉系幹細胞(MSC)としての研究利用について検討した。OAおよびRA由来滑膜細胞は、分化誘導試薬を添加し三次元培養した。形成されたOA由来滑膜細胞のスフェロイドの直径は対照と比べて 1.3 mmに増大し、軟骨分化マーカーのアグリカン、II型コラーゲンおよびSOX9 mRNAの発現が全て増加し、II型コラーゲンタンパク質も産生していた。一方、RA由来滑膜細胞のスフェロイドは、大半がOAと同様に直径が増大し軟骨分化マーカーを発現するが、一部は直径が縮小し、それらのアグリカンmRNAは検出されたがII型コラーゲンの発現はみられずSOX9 の発現も増加しなかった。以上より、RA由来滑膜細胞の軟骨分化能は試料間に差があるが、OA由来滑膜細胞は安定して高い軟骨分化能を持つことが示唆され、MSCとして軟骨分化に関する研究に有用であることが示された。
医薬基盤・健康・栄養研究所・JCRB生物資源バンク・ヒト組織バンクでは、国内医療機関から厳正な倫理手続きを経て提供されたヒト組織(外科手術で摘出された余剰組織)及び組織由来試料を連結不可能匿名化したのち、研究用として産学官の研究機関に分譲している。我々は2010年より関節リウマチ(RA)患者の関節置換手術で摘出された残余滑膜組織より滑膜細胞を調製し、分譲している1)。続いて2011年からは、変形性関節症(OA)由来の滑膜細胞の分譲も開始した。
OAおよびRAの関節における共通の症状として、滑膜細胞の増殖、その後の滑膜組織の関節内侵入、炎症性サイトカインの分泌による関節破壊がみられる。RAは、OAに比べて強い炎症が特徴で、自己免疫疾患であるため根本的原因は異なるが、どちらも高齢化の中で患う人口が増加しつつあり、病態の解明や薬剤の開発が望まれる。RAに関しては、生物学的製剤の利用により劇的な改善がみられるようになっているが、OAには有効な薬剤がないのが現状である。
一方近年、滑膜細胞の間葉系幹細胞(MSC)としての能力が注目されている2,3,4)。滑膜由来MSCは、増殖能と多分化能を併せ持ち、特に軟骨への分化能力が優れていることが知られており5,6,7,8)、軟骨のソースとして移植による半月板の再生への臨床応用が始められている9)。これらに用いられている滑膜由来MSCとされるものは、外傷患者の滑膜組織由来滑膜細胞であるが、最近では、OAやRAの滑膜組織由来滑膜細胞でも軟骨に分化しうることが報告されている2)。
本研究では、我々が調製したOAおよびRA患者由来の滑膜細胞における軟骨分化能を調べ、分化に関する研究利用の可能性について検討した。
本研究で用いた滑膜細胞は、あらかじめインフォームド・コンセントが得られたRA(10検体)およびOA患者(9検体)の、人工関節置換術などの手術時に摘出された残余滑膜組織(表1)から調製し、RA検体由来10試料、OA検体由来9試料を得た。以前に報告した手法と同様に1)、組織はハンクス液で洗浄、細切し、1 mg/mlコラゲナーゼ(Sigma、Type-IS、Clostridium histolyticum由来)、50 μg/mlカナマイシン、0.25 μg/ml Amphotericin B含有DMEM培地にて37°Cで2時間振盪した。コラゲナーゼ消化後、250 μmのナイロンメッシュに通し、細胞塊を除去し、遠沈した。これら細胞は、50 μg/mlカナマイシン、0.25 μg/ml amphotericin B、10%牛胎児血清(FCS)を含むDMEM培地内で5%CO2 気相、37°C、飽和湿度下で培養した。翌日、非接着細胞は除去し、新たな培地を加え、培養を継続した。細胞がコンフルエントに達した後、0.25%トリプシン/0.02%EDTAで継代処理し、抗生物質なしの10%FCSを含むDMEMで培養を継続した。再びコンフルエントに達した細胞は、トリプシン処理後にセルバンカー1(日本全薬工業)にて凍結保存した。調製した細胞は、マイコプラズマ検査および、HBV、HCV、HIV、HTLVを含む10種類のウィルス検査を実施し、全て陰性であることを確認した。
| グループ | 年齢 | 性別 | 薬剤治療歴 | |||
|---|---|---|---|---|---|---|
| 男 | 女 | 免疫抑制/調節薬 | 免疫抑制+生物学的製剤 | 不明 | ||
| OA | 60~80歳代 | 2 | 7 | 0 | 0 | 0 |
| RA | 50~70歳代 | 0 | 10 | 8 | 1 | 1 |
滑膜細胞は、あらかじめMSC Attachment Solution(Biological Industries)でコーティングした培養器にNutri-Stem XF medium(Biological Industries)で解凍、25 cm2 フラスコに1.5×105個の密度で播種した。3-4日培養し、サブコンフルエントになった後、0.25%トリプシンで細胞を剥離し、ソイビーントリプシンインヒビター(Roche)で酵素活性を止め、遠沈した。細胞数をカウントし、Nutri-Stem XF mediumで 1×107 個/mlに調製し、96ウェル丸底プレート(Thermo Scientific)へ 1×105 個/10 μl/wellずつ播種した。以降の実験に使用するため、1試料あたり12ウェルに細胞を播種した。2時間後、細胞が互いに接着し、丸底ウェルの下部にとどまったところで、100 μl/wellの同培地を追加し、さらに培養した。翌日、スフェロイド状の細胞塊になったことを確認し、200 μl/wellの軟骨分化誘導サプリメント添加MSC Go Chondrogenic XF medium(Biological Industries)に交換した。また、半数のスフェロイドはコントロールとして、軟骨分化誘導サプリメント非添加の同培地にて培養したものを対照とした。それぞれ3-4日毎に培地交換し、2-3週間培養した。対照細胞として、骨髄由来間葉系幹細胞(MSC、Lonza、PT-2501)を使用し、同様の処理をした。
遺伝子発現レベルの解析分化誘導2週間後のスフェロイドサンプルから、TaqMan Fast cells-to-CT Kit(Thermo Fisher Scientific)を用いて定法に従いTotal RNAを抽出、相補的DNA(cDNA)を合成した。分化誘導後のスフェロイドは、硬く滑らかな球体で溶解が困難であったため、ホモジナイザー(Nippi、バイオマッシャーII)で磨り潰し、RNAを抽出した。スフェロイドの軟骨への分化誘導を評価するため、mRNA発現レベルをTaqman real-time polymerase chain reaction(qRT-PCR)により測定した。反応系は、10 μlのTaqman Universal Master Mix(Applied Biosystems)、1 μlのTaqManプライマー/プローブセット{TaqMan Assays-on-Demand Gene Expression Product、Applied Biosystems、aggrecan(ACAN)、collagen type II10)(COL2A1)、SOX9、Glyceraldehyde-3-phosphate dehydrogenase11)(GAPDH)、表2参照}、4 μlのcDNAテンプレート、5 μlの水で構成された 20 μl/チューブで実施した。機器は、StepOnePlus Real-Time PCR System(Applied Biosystems)を使用し、マスターミクスに準じたプログラムで行った。
| シンボル | 遺伝子名 | 品番 | リファレンス配列 |
|---|---|---|---|
| ACAN | Aggrecan | Hs00153936_m1 | NM_001135.3 |
| COL2A1 | Collagen type II alpha 1 chain | Hs00264051_m1 | NM_001844 |
| SOX9 | SRY-box 9 | Hs00165814_m1 | NM_000346 |
| GAPDH | Glyceraldehyde-3-phosphate dehydrogenase | Hs99999905_m1 | NM_002046.3 |
得られた数値は、GAPDHでノーマライズし、相対値を算出した。
ELISAによるII型コラーゲンタンパク質の測定分化誘導2週間後のスフェロイドを培養していた培養上清(最終培地交換から3日後のサンプル)を回収した。コラーゲンタイプIIは、Type II Collagen Detection Kit(Chondrex)により定法に従って定量した。
分化誘導スフェロイドのサイズ測定と組織切片培養1日目および分化誘導3週間後のスフェロイドを顕微鏡下で観察し、スケールとともに撮影、その直径を測定した。直径の測定は、スフェロイド画像の中央を通る、少なくとも2辺を測定した平均値で求めた。分化誘導3週間後のスフェロイドは、球体を呈するものがほとんどだが、一部楕円形を呈したスフェロイドは、その中央を通る直径の最短辺および最長辺を測定し、平均値を求めた。その後、PBSで洗浄し、4%パラフォルムアルデヒド溶液で固定した。切片作製を容易にするため、定法に従って固定したサンプルをさらにゼリー化試薬(iPGell: GenoStaff)で固化した。固化したサンプルはパラフィン包埋し、3 μmの切片を作製した。アルシアンブルー(Millipore)により、細胞外基質を、ヌクレアーファストレッド溶液(Sigma)により核を染色した。得られた切片の画像をもとに、各3切片ずつ細胞核数を解析した。
統計的解析データの有意差の検定はKruskal-Wallis testで解析し、Dunnの多重比較を使用した。スフェロイドのサイズと遺伝子発現レベルの相関関係は、Spearman相関で評価した。統計解析ソフトは、GraphPad Prism 6 を使用した。上記の全ての実験は、n=2或いはn=3で実施した。全ての図のプロットは、作製したスフェロイド個々のデータを示している。
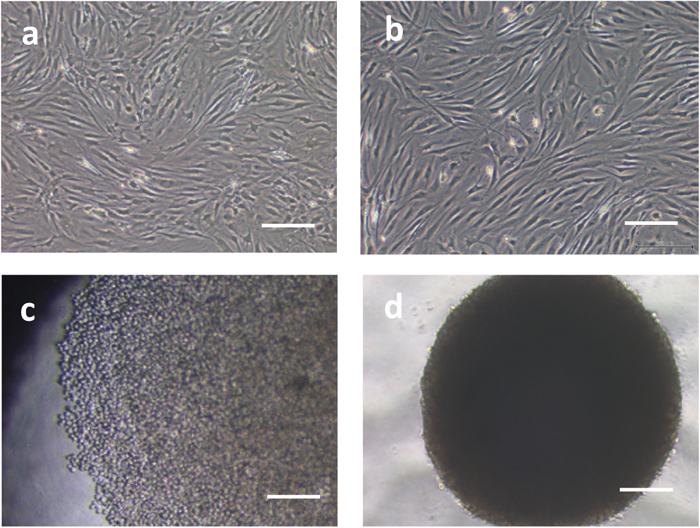
今回調製した滑膜細胞は(図 1-a:OA由来滑膜細胞、1-b:RA由来滑膜細胞)、トリプシン処理後、96ウェル丸底プレートに播種した2時間後には隣接する細胞同士が互いに接着し(図 1-c)、翌日には球体のスフェロイドとなった(図 1-d)。
滑膜細胞の軟骨分化誘導
a:OA患者由来滑膜細胞の単層培養像。b:RA患者由来滑膜細胞の単層培養像。播種後3~4日でサブコンフルエントに達した。c:丸底プレート播種2時間。細胞はウェル底面に単層に集積(OA患者由来滑膜細胞)。d:丸底プレート播種1日。細胞は球体のスフェロイドを形成(OA患者由来滑膜細胞)。(スケールはいずれも 200 μm)
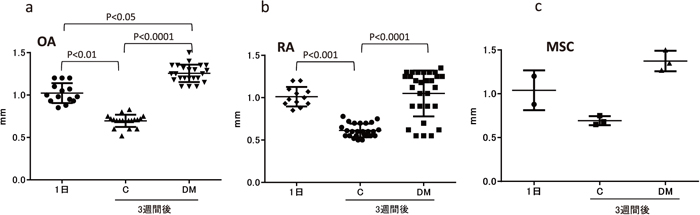
軟骨形成に向かう経過において、細胞外基質の蓄積に伴うスフェロイドのサイズ増加は、軟骨への分化を評価する有用な方法として示されている12,13)。本実験の軟骨分化誘導には、スフェロイド作製に用いる細胞数を全て1×105 個に統一したにもかかわらず、分化誘導後のスフェロイドのサイズ(直径)に変化が見られた。OA患者由来滑膜細胞の丸底プレートへの播種1日目は、スフェロイドの平均サイズが約 1 mmだったが、培養3週間後には、分化誘導剤非添加のスフェロイドは約 0.7 mmに縮小し、対照的に分化誘導スフェロイドは約 1.3 mmに増大した(図 2-a)。RA患者由来滑膜細胞の播種1日目のスフェロイドにおいても、OA患者由来滑膜細胞の1日目と同様に約 1 mmだったが、培養3週間後には、同じく分化誘導剤非添加のスフェロイドは約 0.6 mmに縮小し、また、分化誘導スフェロイドは約 1.1 mmまで増大した。しかしながら図に示すように、RA患者由来スフェロイドのサイズは、分化誘導後、増大するものと縮小するもの、また、その間の中間のサイズに分かれたため、統計的には分化前とサイズが変わらない結果であった(図 2-b)。OA患者由来スフェロイドのサイズ変化は、対照細胞とした骨髄由来MSCのパターンと類似していた(図 2-c)。
軟骨分化誘導後のスフェロイドサイズ
OA(a)、RA(b)および骨髄由来MSC(c)における分化誘導1日目および3週間後のスフェロイドサイズの比較。C:分化誘導剤非添加(コントロール)、DM:分化誘導培地
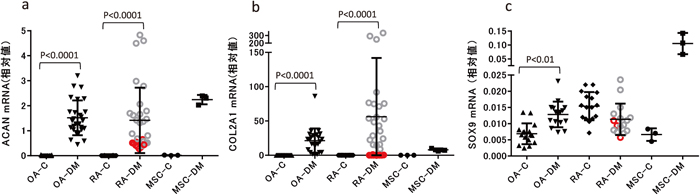
軟骨形成への分化の指標となる遺伝子は、ACAN、COL2A1、およびSOX9 等が知られているため2,3,4,14)、本実験では軟骨分化誘導2週間後のスフェロイドにおいて、これらの遺伝子発現を調べた。その結果、分化誘導剤非添加で培養したコントロールでは、OA、RA由来滑膜細胞および骨髄由来MSCのいずれにおいてもACANおよびCOL2A1 の発現が検出限界以下だったが(図には0で表示)、軟骨分化誘導したスフェロイドには全ての試料でACANの発現が検出された(図 3-a)。一方COL2A1 に関しては、OA患者由来滑膜細胞のスフェロイドでは全てに発現が検出されたのに対し、RA患者由来滑膜細胞のスフェロイドでは、検出されない試料があった(図 3-b)。これらの試料は、分化誘導後に縮小したスフェロイドであり、相当するスフェロイドを赤で示したところ、その他ACANとSox9 においてもその遺伝子発現レベルは低かった(10試料中3試料(スフェロイド9個:赤色で表示))。SOX9 の発現量は、ACANとCOL2A1 に比べて非常に少なかったが、OA患者由来滑膜細胞でコントロールと比較して有意に増加した(図 3-c)。OA患者由来滑膜細胞のACAN、COL2A1、およびSOX9 の遺伝子発現動態は、対照細胞とした骨髄由来MSCの遺伝子発現動態と類似していた。
滑膜細胞および骨髄由来MSCの軟骨分化誘導後におけるスフェロイドの遺伝子発現レベルの比較
軟骨分化誘導2週間のスフェロイドにおけるACAN(a)、COL2A1(b)、SOX9(c)の相対値(対GAPDH比)C:分化誘導剤非添加(コントロール)、DM:分化誘導培地
cの図において、Sox9 の発現量が微量のため(CT値≧35)、正確な相対値の算出が不可能なデータを省略した。
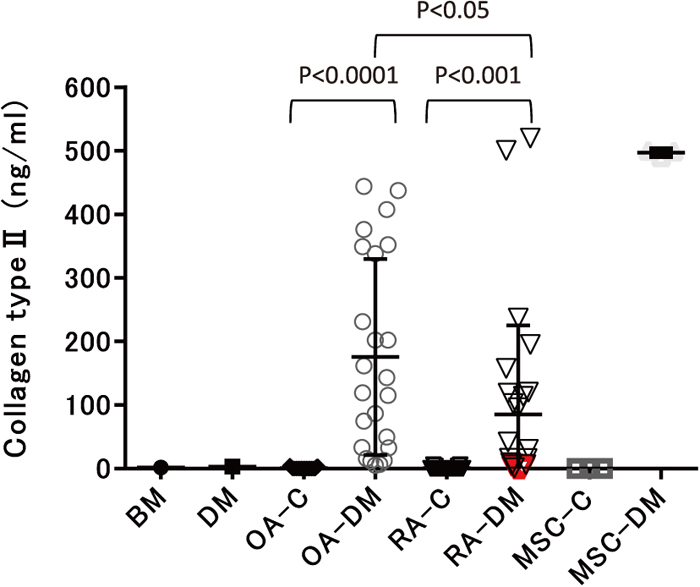
分化誘導後の軟骨への分化を確認するため、II型コラーゲンタンパク質の分泌量をELISA法で測定した(図4)。その結果、分化誘導剤非添加のコントロールの発現は検出限界以下であったが(図には0で表示)、分化誘導したスフェロイドでは、試料による差はあるものの、520 ng/mlまでの濃度で分泌が確認された。OA患者由来滑膜細胞では全てにII型コラーゲンタンパク質の発現が検出されたのに対し(5.1~444.3 ng/ml)、RA患者由来滑膜細胞では、7試料が 5.4~520 ng/mlの範囲で検出され、3試料は発現が認められなかった。これら3試料(スフェロイド9個)は、分化誘導後に縮小したスフェロイドであり(図4、赤色で表示)、RT-PCRでCOL2A1 mRNAの発現が確認できなかった試料(図 3-b、赤色で表示)と一致していた。また骨髄由来MSCでは、OA患者由来滑膜細胞と同様に高濃度のII型コラーゲンタンパク質が検出された。
滑膜細胞および骨髄由来MSCの軟骨分化誘導後におけるスフェロイドのII型コラーゲンタンパク質分泌
軟骨分化誘導2週間のスフェロイドにおける培養上清中のII型コラーゲン量を測定
C:分化誘導剤非添加(コントロール)、DM:分化誘導培地、BM:分化誘導剤非添加培地(Basal medium)
スフェロイドの切片を作製してアルシアンブルーとヌクレアーファストレッドで染色した結果、OAおよびRA患者由来滑膜細胞共に、分化誘導によりサイズが増大したスフェロイドでは、対照とした分化誘導剤非添加のスフェロイド(図 5-a:OA由来スフェロイド、図 5-c:RA由来スフェロイド)に比べ、濃い青に染色された酸性プロテオグリカン等の細胞外基質が豊富に認められた(図 5-b:OA由来スフェロイド、図 5-d:RA由来スフェロイド)。また、RA患者由来スフェロイドの中で、分化誘導したにも関わらず縮小した試料においては、一部にアルシアンブルーの染色性は見られたものの、青く染色される細胞外基質で満たされた状態は確認できず、多数の染色されていない部分が観察された(図 5-e)。この試料は、ACAN mRNAは発現しているがII型コラーゲンmRNAおよびタンパク質の発現が検出されなかった3試料のうちの1試料であり、軟骨分化が十分でない可能性が考えられた。
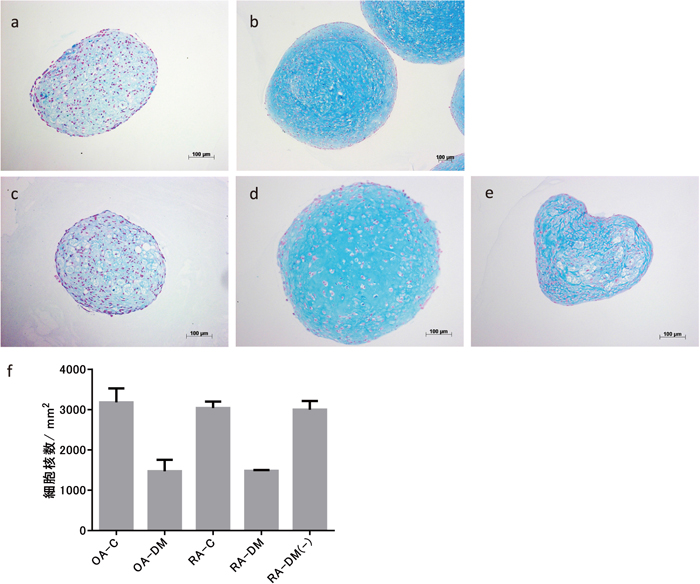
軟骨分化誘導後のスフェロイドのアルシアンブルー染色像(a:OA患者由来滑膜細胞の分化誘導剤非添加のスフェロイド、b:OA患者由来滑膜細胞の軟骨分化誘導後のスフェロイド、c:RA患者由来滑膜細胞の分化誘導剤非添加のスフェロイド、d:RA患者由来滑膜細胞の軟骨分化誘導後のスフェロイド、e:RA患者由来滑膜細胞の軟骨分化誘導後の縮小したスフェロイド)、f:切片の画像解析図(スフェロイド切片 1 mm2 あたりの細胞核数を測定、C:分化誘導剤非添加(コントロール)、DM:分化誘導培地添加、DM(-):分化誘導したが縮小したスフェロイド)
また、切片の染色画像から、スフェロイドの面積と核の数を計測することで、一定面積当たりの核の数を調べた結果(図 5-f)、分化誘導剤非添加のOA由来スフェロイド(図 5-a)は3,180個/mm2、分化誘導剤非添加のRA由来スフェロイド(図 5-c)は3,041個/mm2、分化誘導によりサイズが増大したOA由来スフェロイド(図 5-b)は1,471個/mm2、RA由来スフェロイド(図 5-d)は1,480個/mm2、および分化誘導したにも関わらず縮小したRA由来スフェロイド(図 5-e)は3,000個/mm2 であった。サイズが増大したスフェロイドは、分化誘導剤非添加のスフェロイドやサイズが縮小したスフェロイドに比べて面積当たりの核の数が少ないことから、サイズの増大は、分化誘導中の細胞外基質の蓄積によることが推測された。
RA患者由来滑膜細胞における軟骨分化スフェロイドのサイズと遺伝子発現の相関RA患者由来滑膜細胞の軟骨分化誘導後のスフェロイドのサイズは試料間に差があり、また、遺伝子発現レベルにも大きなばらつきがみられた。そこで、個々のスフェロイドのサイズと遺伝子発現レベルの相関を調べたところ、ACANおよびCOL2A1 にそれぞれ相関関係が認められた(図 6-a、b)。スフェロイド直径が大きいほど、ACANおよびCOL2A1 の発現レベルが高い傾向を示した。一方で、SOX9 の発現レベルに関してはスフェロイドのサイズとの相関は見られなかった(図 6-c)。
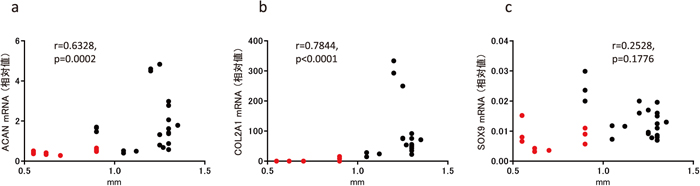
RA患者由来滑膜細胞における軟骨分化スフェロイドのサイズと遺伝子発現の相関
ACAN(a)、COL2A1(b)およびSOX9(c)との相関図
分化誘導したにも関わらず縮小し、II型コラーゲンmRNAおよびタンパク質が検出されなかった3試料(スフェロイド9個)について、各遺伝子の相関図に赤色で明示した。
近年、報告されている滑膜由来MSCは、骨髄由来MSCと同様の細胞表面抗原の特徴があり13,15)、脂肪、骨、軟骨へと分化する能力が示されている5,6,7,8)。我々が滑膜組織より調製したOAおよびRA患者由来の滑膜細胞も、CD90 およびCD105 が陽性であること、脂肪および骨への分化が可能であるという共通した特徴を確認している(データ非表示)。最近、滑膜由来MSCが、特に軟骨への分化能力に優れていると報告されていることから5,6,7,8)、我々が調製した滑膜細胞の軟骨分化能について調べた。
実験の結果、OA患者由来滑膜細胞は、全ての検体由来の試料で分化誘導後のスフェロイドにおいてACAN、COL2A1 およびSOX9 の遺伝子発現レベルが高く、軟骨特有のII型コラーゲンタンパク質も検出された。また、スフェロイドのサイズも大きく、アルシアンブルーで染色される細胞外基質も豊富であり、軟骨へ分化しやすい性質を持っていると考えられた。一方、RA患者由来滑膜細胞は、一部の検体由来の試料でスフェロイドのサイズが分化誘導剤非添加のコントロールと同程度で小さく、これらは、ACANおよびSOX9 の遺伝子発現レベルが低く、COL2A1 遺伝子およびII型コラーゲンタンパク質の発現が検出されず(図3、4に赤色で表示)、アルシアンブルーの染色性もコントロールと類似しており(図 5-e)、軟骨への分化が確認できなかった。しかしながら、ほとんどの試料は、OA患者由来滑膜細胞と同様に分化誘導後のスフェロイドのサイズが大きく、ACANおよびCOL2A1 の遺伝子発現レベルが高い傾向があり、また軟骨特有のII型コラーゲンタンパク質を分泌し、細胞外基質も蓄積されていた(図 5-d)。このことから、RA患者由来滑膜細胞は、軟骨への分化誘導が可能な例もあるが、OA患者由来滑膜細胞に比べて試料により分化の程度に差がある可能性が示唆された。
RAの病態の特徴の一つとして、炎症性サイトカインであるinterleukin-1(IL-1)やtumor necrosis factor-alpha(TNF-α)の過剰生産によるIL-6 やMMP-3 などの増加が、関節内の滑液や滑膜細胞で生じ、関節の破壊につながることが知られている1,16)。興味深いことに、これらIL-1 やTNF-αは、軟骨分化のマスター調製因子である転写因子Sox9 の発現を減少させ、それに伴い軟骨特有の遺伝子COL2A1、マトリックス分子であるACANの発現をも抑制することが報告されており17)、ヒトMSCの軟骨分化を抑制する報告もある18)。またTNF-αはRA患者由来滑膜細胞やマウス軟骨前駆細胞株であるATDC5 の軟骨分化を抑制するという報告もある19,20)。このことから、今回の結果であるRA患者由来滑膜細胞の軟骨分化能における試料差は、RA患者由来滑膜細胞の炎症性サイトカインの産生に関する性状の差異に起因する可能性も考えられた。さらに最近の研究では、RA患者への生物学的製剤の使用により、滑膜内の細胞外基質の構造や構成に変化を与える可能性を示唆するものがある21)。また抗リウマチ薬の一つであるメトトレキサートの投与は、非投与の健常人やOA患者に比べ、RA患者の滑膜細胞にアポトーシスを誘導することが報告されている22)。今回実験に使用したRA患者由来滑膜細胞の中で、軟骨分化の傾向が観察されなかった試料の一つは、全身性エリテマトーデス(Systemic Lupus Erythematosus: SLE)を合併している患者由来であったことや、調製した細胞はほぼ全て、生物製剤を含む抗リウマチ薬(主にメトトレキサートやプレドニゾロン)による治療歴のある患者由来であったことなどから、病態や、薬剤の影響が軟骨分化能に関係する可能性も考えられた。
近年の研究は、健常人由来に比べ、OA患者由来滑膜MSCの軟骨分化能が劣ると示唆するものや23)、OAおよびRA患者由来滑膜MSCも健常人由来と同様に、軟骨分化能を持ち、再生医療の材料としての可能性を示すものもあり2)、滑膜MSCの分化能の高低差に関しては多くの議論がある。今回の実験では健常人由来滑膜細胞との比較は行っていないが、少なくともOA患者由来滑膜細胞は、調べた全ての検体由来の試料について、良好な軟骨分化能を持つことが示唆された。RA患者由来滑膜細胞については、個々の検体の病態の多様性が軟骨分化能に影響している可能性が考えられた。
現在、我々が分譲している滑膜細胞は、OAおよびRAの病態解明、創薬等の研究開発に利用されているが、今後、MSCとして軟骨の分化に関わる再生医療等のより広い研究にも有用であることが示された。