要旨
歯周炎は細菌感染とそれに対する宿主反応のバランスが関与する炎症性疾患であり,全身の健康にも悪影響を及ぼす。歯周炎は多因子性疾患として捉えられるが,最近の研究では喫煙に代表される環境因子の役割も明らかになりつつある。本稿ではタバコ煙が歯周組織に及ぼす影響について,特に歯肉上皮細胞と代表的な歯周病原細菌であるPorphyromonas gingivalisとの相互作用に焦点を当てて解説する。
はじめに
喫煙は疾患の原因中で予防できる最大かつ単一のものであるとされている1)。我が国では習慣的に喫煙している者は減少傾向にあるものの,その割合は20.7%2)と先進国のなかでは未だ高いのが現状である。
歯周病のリスクファクターには細菌因子,環境因子そして宿主因子があるが,なかでも喫煙は環境面における重大なリスクファクターである。日本歯周病学会としては,2011年に禁煙推進委員会が喫煙の歯周組織に対する影響に関しポジション・ペーパーを発表し,その中で,喫煙が歯周病の最大の環境リスク因子であることは科学的に明らかで,一番の影響はニコチンの血管収縮および線維芽細胞への障害作用であるとしている3)。これらが喫煙者に見られる歯周組織の修復能力や歯周治療効果の低下に影響しているものと考えられている。また,喫煙は付着の損失と骨吸収に関与しており4,5),再生療法などの治療効果においても,歯周組織の反応に悪影響を及ぼす6)とされている。
一方で,歯周炎は歯周病原細菌による感染およびその生体反応として捉えられ,特にグラム陰性嫌気性桿菌であるPorphyromonas gingivalisは,様々な形で病因に関与している7)。P. gingivalisの宿主細胞への侵入は,宿主の免疫応答から逃れ,組織損傷に寄与し,潜在的な病原因子であると考えられている8)。さらに,P. gingivalisの上皮細胞への侵入は,細胞遊走および増殖を阻害することが報告されている9)。
また,歯周炎患者において,喫煙者は非喫煙者よりも歯周病原細菌の検出率が高いという報告がある10,11)。喫煙は宿主因子と細菌因子の双方に作用することは明らかであることから,喫煙が歯周病の発症と進展,そして歯周病治療に及ぼす影響を明らかにするうえで,宿主細胞と歯周病原細菌との相互作用の視点からも検討する必要がある。
タバコ煙の影響を検討する実験系
これまで,喫煙と歯周病に関する基礎研究においては代表的な有害物質であるニコチンや,その代謝産物であるコチニンを使用した研究が多く行われてきた。我々の研究グループは,in vivo実験として,ニコチンをマウスの腹腔内に投与し,その後の血清サイトカインレベルを測定することで免疫応答に及ぼす影響について報告した12)。他にも,飲料水としてニコチン含有蒸留水を摂取させる研究13)などが行われている。In vitroの実験系としては,細胞培養の培地中にニコチンを加える方法などがある。ニコチンやコチニンの代わりにタバコ煙全体の影響を検討する目的で,直接タバコ煙を曝露させる方法14)やタバコ煙抽出液(cigarette smoke extract;CSE)を使用した実験系が報告されている15,16)。これらの方法は使用するタバコや抽出方法によってばらつきがあり,標準化が難しいという問題がある。近年,実験用タバコの煙をケンブリッジフィルターに吸着させ,溶媒に溶出して作成したタバコ煙濃縮物(cigarette smoke condensate;CSC)も使用されている17)。異なるタバコ煙の曝露方法と宿主細胞の反応に関する主な研究14-26)を表1に示す。
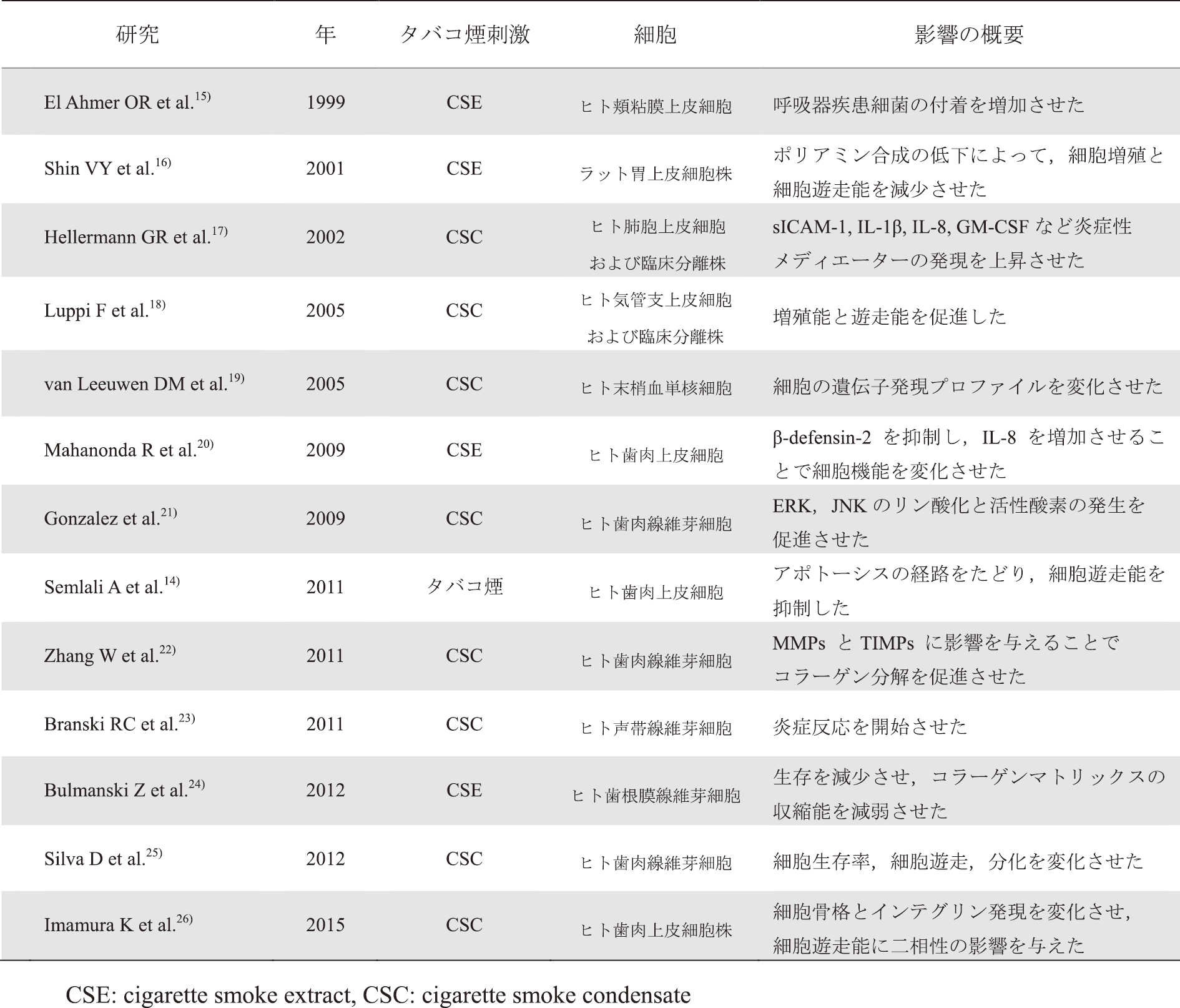
表1
タバコ煙刺激が宿主細胞に及ぼす影響に関する主な研究
CSE, CSCと上皮細胞,線維芽細胞について
粘膜表面を取り囲む上皮細胞は,タバコ煙のような外部からの刺激因子に最初に曝露される27)ため,口腔上皮や気管支細胞はタバコ煙刺激の研究対象となっている。これらの細胞の遊走および増殖は,創傷治癒や組織再生を含む多くの生物学的な過程において重要である9)。細胞遊走に対するニコチンの作用としては,生理学的な濃度範囲において,促進28)と阻害29)という相反する報告がある。これは,細胞の違いに加えて,ニコチンの濃度や曝露時間などの違いによるものだと考えられる。タバコ煙成分が歯周組織の修復に及ぼす影響としては,歯肉上皮細胞や歯肉線維芽細胞の生存や遊走能を変化させることが報告されている14,21,25,30)。
CSC刺激によるヒト歯肉上皮細胞への影響
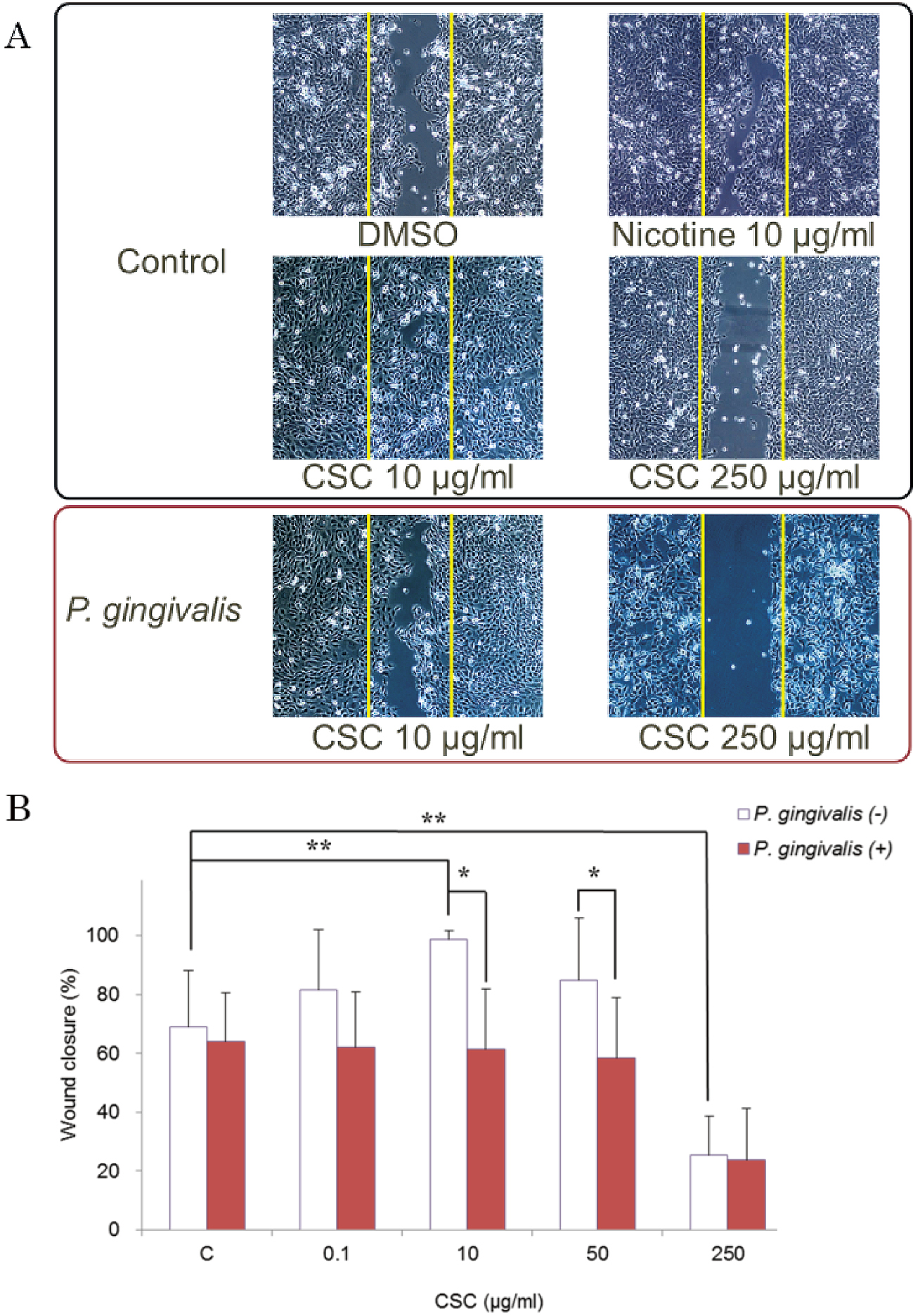
我々は,まずCSCがヒト歯肉上皮細胞の増殖能に及ぼす影響について検討した26)。各種濃度CSC添加培地にてヒト歯肉上皮細胞株(Ca9-22)を24時間培養し,細胞増殖能をWST-1にて測定した結果,CSC 250 μg/mlまでの濃度範囲において,有意な影響がないことを確認した。さらに,この濃度範囲においてCSC刺激が細胞遊走能にどのような影響を及ぼすかをWound healing assayによって検討した。10 μg/mlのCSC刺激では遊走能の促進が確認された(図1)。この結果は,ヒト歯肉線維芽細胞25)及び気管支上皮細胞18)における検討と一致していた。一方で,250 μg/mlのCSC刺激により遊走能はコントロールと比較して60%減少した(図1)。この濃度のCSCは,ニコチンを約6 μg/ml含んでいるが,1-10 μg/mlのニコチンのみの刺激では,遊走能に影響は認められなかった。よって,250 μg/mlのCSC刺激における遊走能の抑制にはニコチン以外のタバコ煙成分が関与していることが考えられる。
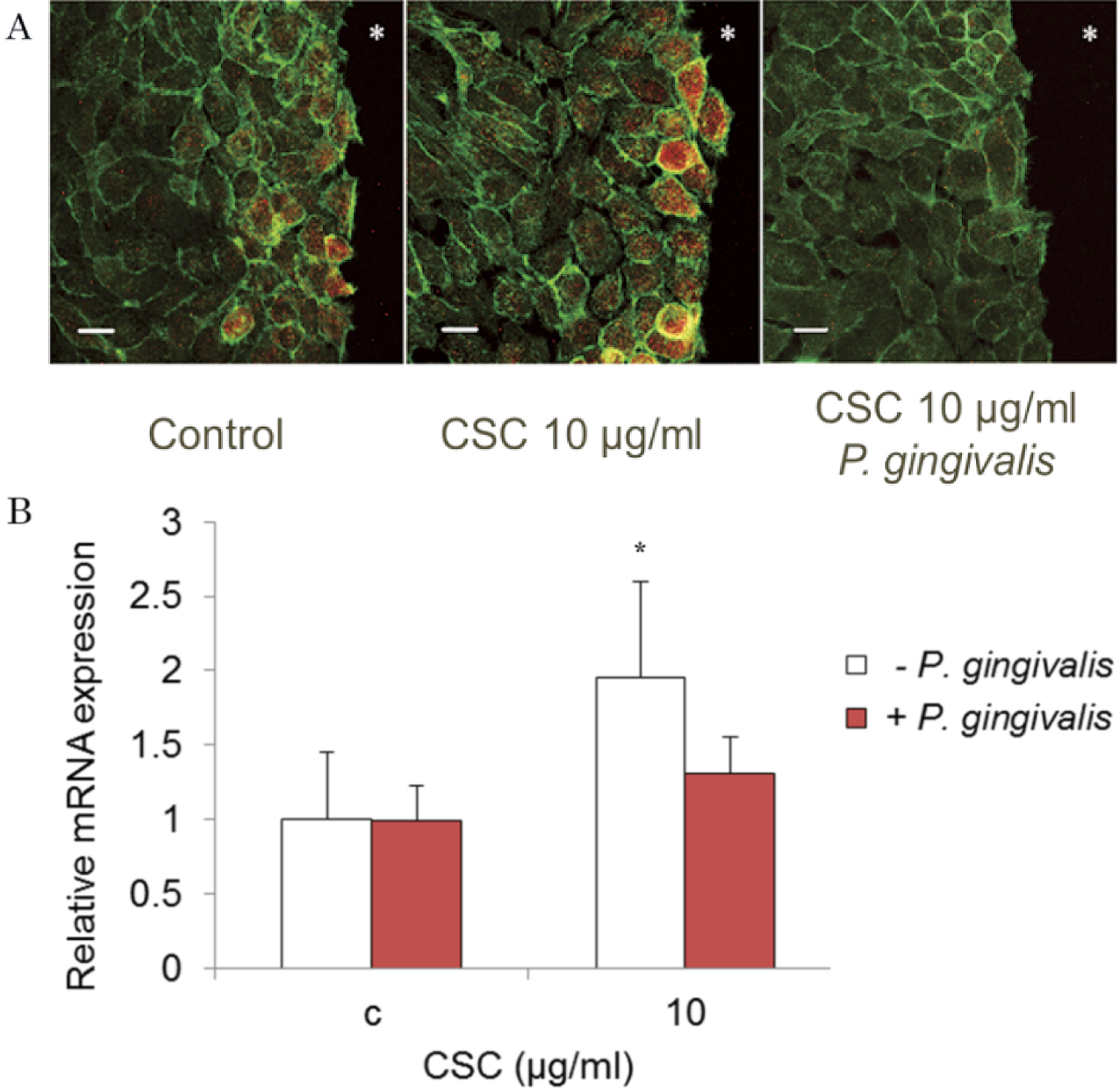
次にCSC刺激による遊走能の調節メカニズムを探るため,インテグリンの発現について検討した。インテグリンは細胞接着,遊走,シグナル伝達および遺伝子発現において重要な役割を果たしている31)。ラット口腔上皮細胞を用いた創傷治癒モデルにおいて,インテグリンα3は細胞の進展側で発現し,細胞遊走に関わっていることが報告されている32)。そこで,ヒト歯肉上皮細胞のwound healingにおける,CSC刺激によるインテグリンα3のタンパク発現局在の変化を共焦点レーザー顕微鏡で観察した。コンフルエントになったCa9-22にscratchを加え,2時間後,免疫染色を行った。10 μg/mlのCSC刺激においてscratchに近接した細胞で,インテグリンα3の発現局在を認め,その発現強度の増加を認めた(図2A)。また,RT-PCRにて解析を行った結果,mRNAレベルでもインテグリンα3の2倍程度の発現増加を確認した(図2B)。CSEがヒト歯根膜線維芽細胞におけるインテグリンの発現を増加させたとする以前の報告24)と考え合わせると,CSC刺激による遊走能の変化には,インテグリンα3発現が関与していることを示唆するものである。
低濃度CSCにおいて確認された歯肉上皮細胞の創傷閉鎖の促進は,有益な効果であるようにみえる。しかし,気管支上皮細胞におけるこのような現象は,肺癌の発症,浸潤に関与しているとされており18),歯肉上皮細胞における促進作用も,創傷治癒以外の影響の視点からも検討する必要があろう。
上記の条件においてP. gingivalis感染を2時間加えたところ,遊走能は全体的に抑制され,低濃度のCSC刺激において認められた促進傾向も抑えられた(図1)。また,インテグリンα3のタンパク発現も抑制された(図2)。Aggregatibacter actinomycetemcomitansの熱ショックタンパク質が,インテグリンα6の発現調節を介して上皮細胞の遊走に影響を及ぼすことが報告されている33)。P. gingivalisを生菌感染させた場合,ジンジパインなどの影響でタンパク発現の測定は,偏った結果となる可能性がある34)ため,mRNAレベルでも検討を行い,インテグリンα3の発現の減少を確認した(図2)。
これらCSCによる歯肉上皮細胞の遊走能への影響は,Mitogen-activated protein kinase(MAPK)の関与が考えられる。一般的にMAPKは,外来刺激を細胞内に伝達し,様々な遺伝子発現を制御する重要な役割を担っており35),MAPKの活性化は細胞増殖,遊走,生存を調節している36)。さらにMAPKの一つであるERKは,インテグリンに依存した細胞の接着や遊走に関与している37)。CSCは,気道上皮細胞株において上皮成長因子受容体(EGFR)のリガンド非依存性の活性を引き起こすことが知られている38)。以上より,CSCは受容体を介さないMAPKの活性により細胞遊走を調節していると仮説をたて,現在CSC刺激によるシグナル伝達系の解析を進めている。
CSE, CSCと歯周病原細菌
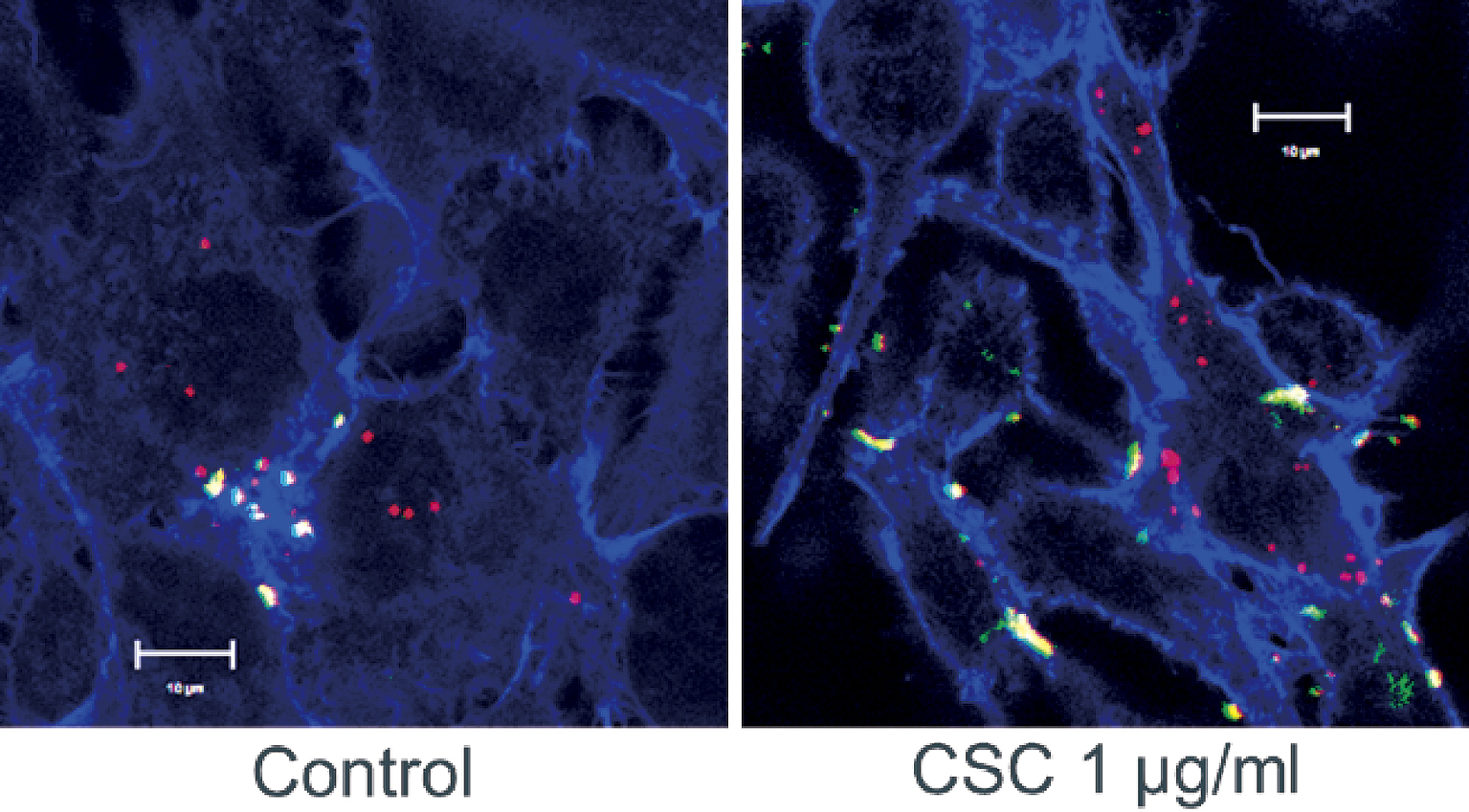
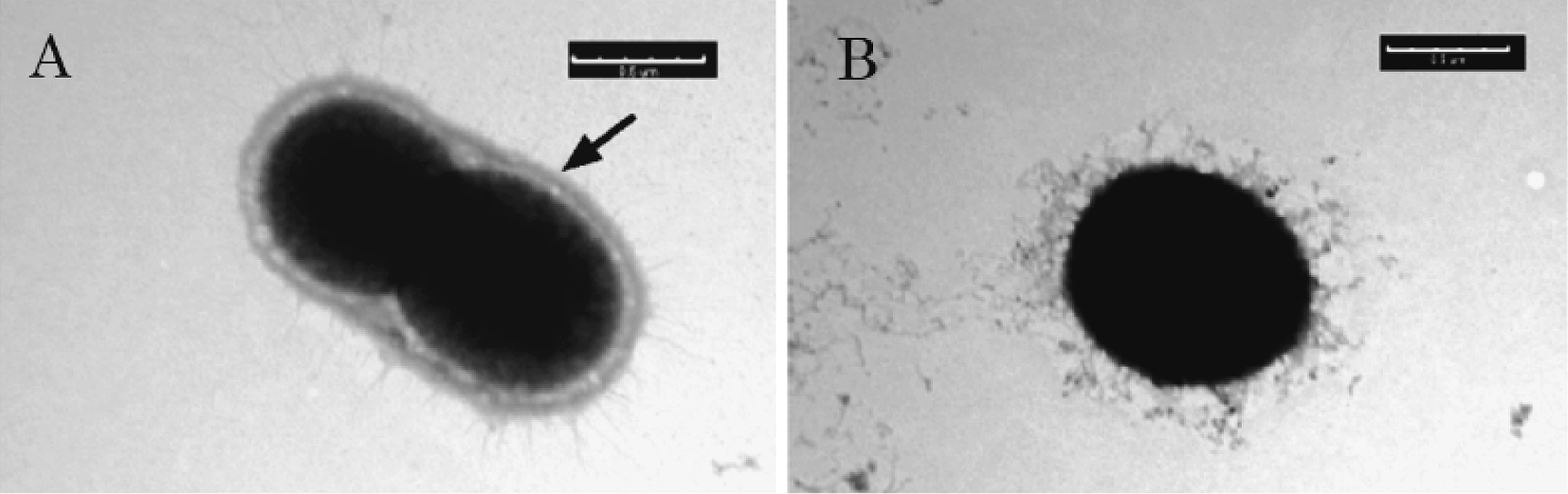
喫煙者の歯周ポケット内は,非喫煙者と比較して酸素分圧が低く,より嫌気的であり39),グラム陰性嫌気性菌であるP. gingivalisの生息に適している環境である。喫煙者の口腔内細菌叢に関する研究は数多く行われており,喫煙歴,サンプルの種類,検出方法によって結果は様々である。たとえば,全ての歯からサンプリングした歯肉縁下プラークをDNA-DNA hybridization法によって検出した研究では,非喫煙者と比較してP. gingivalisの有意な増加を確認している40)。In vitroでも,CSEは上皮細胞の感受性を変化させA. actinomycetemcomitansとP. gingivalisのコロニー形成を増加させたという報告がある41)。とくにP. gingivalisにおいてCSEは,病原性に関与する様々な遺伝子発現の6.8%を変化させたとの報告もみられる42)。CSEはP. gingivalisの線毛の発現を増加させ,このことが本菌の局所への定着や感染を促進していると考えられている43)。また,タバコ煙による細菌の細胞内侵入に関しては,ニコチンが細胞骨格を変化させることで大腸菌のヒト内皮細胞への侵入を増加させ44),コチニンは,P. gingivalisによる上皮細胞への付着と,侵入に影響を与えることが報告されている45)。そこで我々は,CSCがヒト歯肉上皮細胞へのP. gingivalisの侵入に及ぼす影響を共焦点レーザー顕微鏡およびantibiotic protection assayで解析を行った26)。最初に,上皮細胞のみに及ぼす影響を検討する目的で,P. gingivalisにCSCが曝露されない条件で実験を行ったところ,細胞侵入に有意な変化は認められなかった。次に,細胞侵入における宿主細胞とP. gingivalis双方へのCSC曝露の影響を検討する目的で,宿主細胞にCSCを24時間曝露させた後,培地にCSCを添加した条件でP. gingivalisを2時間感染させた。すると,有意に侵入が増加した(図3)。細菌は通常,宿主細胞に付着し,侵入するためにインテグリン,フィブロネクチンおよびラミニンなどの細胞接着分子を標的にする46)。特にP. gingivalisは,線毛と宿主細胞のインテグリンα5β1との接合を介して上皮細胞に付着する47)。CSEはP. gingivalisの線毛タンパク質の産生を増加させるとの報告48)もあり(図4),CSCによる細胞侵入の増加は線毛発現に対する影響も考えられる。
我々の研究結果では,宿主細胞のみに対するCSCの曝露で,P. gingivalisの侵入効率に変化は認められなかったが,P. gingivalisにもCSCを曝露させることで侵入率は変化した。CSCは細胞骨格,特にアクチンフィラメントを変化させることも観察している。P. gingivalisは,歯肉上皮細胞に侵入するために,アクチンのリアレンジメントを利用し8),Prevotalla intermedeiaは上皮細胞の葉状仮足を結合の対象としている49)。CSCは宿主細胞の細胞骨格を変化させることで,細胞侵入を増加させたと考えられる。
おわりに
喫煙による宿主や細菌に対する影響は,タバコの種類,方法,喫煙歴など多くの要因によって異なる50)。さらに,CSC, CSEなどをin vitroの実験系で使用する場合,“液状のタバコ成分”としての作用を検討することになり,実際のタバコ煙による影響と同一ではない点や,実際の喫煙状態を想定し,再現するための適切な濃度や刺激時間を設定することは困難であるなどの点から,実験結果の解釈は複雑となる51)。限界はあるものの,CSCやCSEを用いた研究は,これまで示してきた通り数多くの有用な情報を提供している。タバコ煙には7000以上の異なる化学成分が含まれており,主要な毒性物質として,ニコチン以外にもフェノール,ニトロソアミン,重金属,化学発がん物質などが知られている21)。それぞれが複雑に影響し合い,様々な疾患の原因因子や修飾因子として作用している52)。歯周病におけるタバコ煙の影響を考えるうえで,タバコ煙全体としての作用を検討することは非常に重要であり,CSCやCSEの使用は意義があると考えている。
これまでの我々の検討では,CSCがヒト歯肉上皮細胞の機能に濃度により異なる影響を及ぼすことが明らかとなった。そしてその影響は,P. gingivalisとの相互作用によって修飾された。細菌感染を伴ったタバコ煙の細胞機能への影響に関する,さらなるメカニズムの理解は,歯周炎をはじめとする口腔疾患の予防や治療の改善につながる可能性があると考えている。
References
- 1) WHO REPORT on the global TOBACCO epidemic, 2008, http://www.who.int/tobacco/mpower/gtcr_download/en/
- 2) 厚生労働省: 平成24年国民健康・栄養調査結果の概要, 2013.
- 3) 大森 みさき, 両角 俊哉, 稲垣 幸司, 横田 誠, 沼部 幸博, 佐藤 聡, 伊藤 弘, 王 宝禮, 上田 雅俊, 山田 了, 伊藤 公一: 喫煙の歯周組織に対する影響. 日歯周誌, 53: 40-49, 2011.
- 4) Grossi SG, Zambon JJ, Hu AW, Koch G, Dunford RG, Machtei EE, Norderyd OM, Genco RJ: Assessment of risk for periodontal disease (I). Risk indicators for attachment loss. J Periodontol, 65: 260-267, 1994.
- 5) Tomar SL, Asma S: Smoking-attributible periodontitis in the United States. Findings from NHANES III. National Health and Nutritional Examination Survey. J Periodontol 2000, 71: 743-751, 2000.
- 6) Johnson GK, Guthmiller JM: The impact of cigarette smoking on periodontal disease and treatment. Periodontol 2000, 44: 178-194, 2007.
- 7) Socransky SS, Haffajee AD: The bacterial etiology of destructive periodontal disease: current concepts. J Periodontol, 63: 322-331, 1992.
- 8) Lamont RJ, Chan A, Belton CM, Izutsu KT, Vasel D, Weinberg A: Porphyromonas gingivalis invasion of gingival epithelial cells. Infect Immun, 63: 3878-3885, 1995.
- 9) Nakagawa I, Inaba H, Yamamura T, Kato T, Kawai S, Ooshima T, Amano A: Invasion of epithelial cells and proteolysis of cellular focal adhesion components by distinct types of Porphyromonas gingivalis fimbriae. Infect Immun, 74: 3773-3782, 2006.
- 10) Zambon J, Grossi S, Matchei E, Ho A, Dunford R, Genco R: Cigarette smoking increases the risk for subgingival infection with periodontal pathogens. J Periodontol, 67: 1050-1054, 1996.
- 11) van Winkelhoff A, Bosch-Tijhof C, Winkel E, van der Reijden W: Smoking affects the subgingival microflora in periodontitis. J Periodontol, 72: 666-671, 2001.
- 12) Makino A, Yamada S, Okuda K, Kato T: Nicotine involved in periodontal disease through influence on cytokine levels. FEMS Immunol Med Microbiol, 52: 282-286, 2008.
- 13) Ohishi T, Wang L, Akane H, Shiraki A, Itahashi M, Mitsumori K, Shibutani M: Transient suppression of late-stage neuronal progenitor cell differentiation in the hippocampal dentate gyrus of rat offspring after maternal exposure to nicotine. Arch Toxicol, 88: 443-454, 2014.
- 14) Semlali A, Chakir J, Goulet J-P, Chmielewski W, Rouabhia M: Whole cigarette smoke promotes human gingival epithelial cell apoptosis and inhibits cell repair processes. J Periodontal Res, 46: 533-541, 2011.
- 15) El Ahmer OR, Essery SD, Saadi AT, Raza MW, Ogilvie MM, Blackwell C: The effect of cigarette smoke on adherence of respiratory pathogens to buccal epithelial cells. FEMS Immunol Med Microbiol, 23: 27-36, 1999.
- 16) Shin VY, Liu ES, Koo MW, Wang JY, Matsui H, Cho CH: Cigarette smoke extracts delay wound healing in the stomach: involvement of polyamine synthesis. Exp Biol Med, 227: 114-124, 2002.
- 17) Hellermann GR, Nagy SB, Kong X, Lockey RF, Mohapatra SS: Mechanism of cigarette smoke condensate-induced acute inflammatory response in human bronchial epithelial cells. Respir Res, 3: 22, 2002.
- 18) Luppi F, Aarbiou J, van Wetering S, Rahman I, de Boer WI, Rabe KF, Hiemstra PS: Effects of cigarette smoke condensate on proliferation and wound closure of bronchial epithelial cells in vitro: role of glutathione. Respir Res, 6: 140, 2005.
- 19) van Leeuwen DM, Gottschalk RW, van Herwijnen MH, Moonen EJ, Kleinjans JC, van Delft JH: Differential gene expression in human peripheral blood mononuclear cells induced by cigarette smoke and its constituents. Toxicol Sci, 86: 200-210, 2005.
- 20) Mahanonda R, Sa-Ard-Iam N, Eksomtramate M, Rerkyen P, Phairat B, Schaecher KE, Fukuda MM, Pichyangkul S: Cigarette smoke extract modulates human beta-defensin-2 and interleukin-8 expression in human gingival epithelial cells. J Periodontal Res, 44: 557-564, 2009.
- 21) Gonzalez R, Arancibia R, Cáceres M, Martínez J, Smith PC: Cigarette smoke condensate stimulates urokinase production through the generation of reactive oxygen species and activation of the mitogen activated protein kinase pathways in human gingival fibroblasts. J Periodontal Res, 44: 386-394, 2009.
- 22) Zhang W, Fang M, Song F, Windsor LJ: Effects of cigarette smoke condensate and nicotine on human gingival fibroblast-mediated collagen degradation. J Periodontol, 82: 1071-1079, 2011.
- 23) Branski RC, Zhou H, Kraus DH, Sivasankar M: The effects of cigarette smoke condensate on vocal fold transepithelial resistance and inflammatory signaling in vocal fold fibroblasts. Laryngoscope, 121: 601-605, 2011.
- 24) Bulmanski Z, Brady M, Stoute D, Lallier TE: Cigarette smoke extract induces select matrix metalloproteinases and integrin expression in periodontal ligament fibroblasts. J Periodontol, 83: 787-796, 2012.
- 25) Silva D, Cáceres M, Arancibia R, Martínez C, Martínez J, Smith PC: Effects of cigarette smoke and nicotine on cell viability, migration and myofibroblastic differentiation. J Periodontal Res, 47: 599-607, 2012.
- 26) Imamura K, Kokubu E, Kita D, Ota K, Ishihara K, Saito A: Cigarette smoke condensate modulates migration of human gingival epithelial cells and their interactions with Porphyromonas gingivalis. J Periodontal Res, 50: 411-421, 2015.
- 27) Preciado D, Lin J, Wuertz B, Rose M: Cigarette smoke activates NFκB and induces Muc5b expression in mouse middle ear cells. Laryngoscope, 118: 464-471, 2008.
- 28) Grando SA, Horton RM, Pereira EF, Diethelm-Okita BM, George PM, Albuquerque EX, Conti-Fine BM: A nicotinic acetylcholine receptor regulating cell adhesion and motility is expressed in human keratinocytes. J Invest Dermatol, 105: 774-781, 1995.
- 29) Fang Y, Svoboda KK: Nicotine inhibits human gingival fibroblast migration viamodulation of Rac signalling pathways. J Clin Periodontol, 32: 1200-1207, 2005.
- 30) Zhang W, Song F, Windsor LJ: Effects of tobacco and P. gingivalis on gingival fibroblasts. J Dent Res, 89: 527-531, 2010.
- 31) Larjava H, Haapasalmi K, Salo T, Wiebe C, Uitto VJ: Keratinocyte integrins in wound healing and chronic inflammation of the human periodontium. Oral Dis, 2: 77-86, 1996.
- 32) Sugisawa M, Masaoka T, Enokiya Y, Muramatsu T, Hashimoto S, Yamada S, Shimono M: Expression and function of laminin and integrins on adhesion/migration of primary culture cells derived from rat oral epithelium. J Periodontal Res, 45: 284-291, 2010.
- 33) Zhang L, Koivisto L, Heino J, Uitto VJ: Bacterial heat shock protein 60 may increase epithelial cell migration through activation of MAP kinases and inhibition of a6b4 integrin expression. Biochem Biophys Res Comm, 319: 1088-1095, 2004.
- 34) Calkins CC, Platt K, Potempa J, Travis J: Inactivation of tumor necrosis factor alphaby proteinases (gingipains) from the periodontal pathogen, Porphyromonasgingivalis. Implications of immune evasion. J Biol Chem, 273: 6611-6614, 1998.
- 35) Johnson GL, Lapadat R: Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases. Science, 298: 1911-1912, 2002.
- 36) Sharma GD, He J, Bazan HE: p38 and ERK1/2 coordinate cellular migration and proliferation in epithelial wound healing: evidence of cross-talk activation between MAP kinase cascades. J Biol Chem, 278: 21989-21997, 2003.
- 37) Carragher NO, Westhoff MA, Fincham VJ, Schaller MD, Frame MC: A novel role for FAK as a protease-targeting adaptor protein: regulation by p42 ERK and Src. Curr Biol, 13: 1442-1450, 2003.
- 38) Takeyama K, Jung B, Shim JJ, Burgel PR, Dao-Pick T, Ueki IF, Protin U, Kroschel P, Nadel JA: Activation of epidermal growth factor receptors is responsible for mucin synthesis induced by cigarette smoke. Am J Physiol Lung Cell Mol Physiol, 280: L165-172, 2001.
- 39) Hanioka T, Tanaka M, Ojima M, Takaya K, Matsumori Y, Shizukuishi S: Oxygen suffiency in the gingiva of smokers and non-smokers with periodontal disease. J Periodontol, 71: 1846-1851, 2000.
- 40) Haffajee AD, Socransky SS: Relationship of cigarette smoking to the subgingivalmicrobiota. J Clin Periodontol, 28: 377-388, 2001.
- 41) Teughels W, Eldere JV, Steenberghe D, van Cassiman J-J, Fives-Taylor P, Quirynen M: Influence of nicotine and cotinine on epithelial colonization by periodontopathogens. J Periodontol, 76: 1315-1322, 2005.
- 42) Bagaitkar J, Williams LR, Renaud DE, Bemakanakere MR, Martin M, Scott DA, Demuth DR: Tobacco-induced alterations to Porphyromonas gingivalis-host interactions. Environ Microbiol, 11: 1242-1253, 2009.
- 43) Bagaitkar J, Demuth DR, Daep CA, Renaud DE, Pierce DL, Scott DA: Tobacco upregulates P. gingivalis fimbrial proteins which induce TLR2 hyposensitivity. PLoS One, 4: e9323, 2010.
- 44) Chen Y, Chen SH, Jong A, Zhou ZY, Li W, Suzuki K, Huang SH: Enhanced Escherichia coli invasion of human brain microvascular endothelial cells is associated with alterations in cytoskeleton induced by nicotine. Cell Microbiol, 4: 503-514, 2002.
- 45) Cogo K, Calvi BM, Mariano FS, Franco GCN, Gonçalves RB, Groppo FC: The effects of nicotine and cotinine on Porphyromonas gingivalis colonisation of epithelial cells. Arch Oral Biol, 54: 1061-1067, 2009.
- 46) Hauck CR, Agerer F, Muenzner P, Schmitter T: Cellular adhesion molecules as targets for bacterial infection. Eur J Cell Biol, 85: 235-242, 2006.
- 47) Tsuda K, Furuta N, Inaba H, Kawai S, Hanada K, Yoshimori T, Amano A: Functional analysis of α5β1 integrin and lipid rafts in invasion of epithelial cells by Porphyromonas gingivalis using fluorescent beads coated with bacterial membrane vesicles. Cell Struct Funct, 33: 123-132, 2008.
- 48) Bagaitkar J, Daep CA, Patel CK, Renaud DE, Demuth DR, Scott DA: Tobacco smoke augments Porphyromonas gingivalis-Streptococcus gordonii biofilm formation. PLoS ONE, 6: e27386, 2011.
- 49) Gursoy UK, Könönen E, Uitto V-J: Prevotella intermedia ATCC 25611 targets host cell lamellipodia in epithelial cell adhesion and invasion. Oral Microbiol Immunol, 24: 304-309, 2009.
- 50) Liu X, Togo S, Al-Mugotir M, Kim H, Fang Q, Kobayashi T, Wang X, Mao L, Bitterman P, Rennard S: NF-kappa B mediates the survival of human bronchial epithelial cells exposed to cigarette smoke extract. Respir Res, 9: 66, 2008.
- 51) Minematsu N, Blumental-Perry A, Shapiro SD: Cigarette smoke inhibits engulfment of apoptotic cells by macrophages through inhibition of actin rearrangement. Am J Respir Cell Mol Biol, 44: 474-482, 2011.
- 52) Rodgman A, Perfetti TA: The chemical components of tobacco and tobacco smoke, CRC Press, Boca Raton, 2008, 1840.