はじめに
2019年(令和元年)の人口動態統計によると,悪性新生物(がん)が死因の第1位であり,その数が37.6万人である。そのうち約4割にあたる15.6万人が消化器がんによって命を落としており,消化器がん部位別では大腸がんが最も多い。また全国がん登録罹患データによると,2018年に新たにがんと診断された約98万例のうち,消化器がんの代表である大腸がんと胃がんが罹患数の第1位と第2位である。疫学研究によって,歯周病が全身の様々ながんの発生およびがん死のリスクを上げることが報告されており1),41年にわたり15,000人以上を対象とした海外の大規模コホート研究から,歯周病が大腸がん発生の独立したリスク因子であることも報告されている2)。近年では,次世代シークエンサーを用いたバイオインフォマティクス解析や,特定の菌のみを植菌したノトバイオートを用いた動物実験技術により,消化管に異所性に定着することで病原性を発揮する口腔細菌の発見や3),菌株レベルで口腔―腸管に共通する細菌が同定されており4),消化器がんにおける歯周病原細菌の関与とその分子メカニズムも明らかになりつつある。本稿においては歯周病と消化器がんの関連について,歯周病原細菌による消化器がん発症・進行メカニズムを中心に,最新の知見とともに概説したい。
消化器がんにおける細菌の関与
消化管は口腔から始まり,食道,胃,小腸,大腸を経て肛門に至るまでの消化・吸収代謝機能を担う管腔臓器である。消化管を構成する各種消化器におけるがんの発生・進行については遺伝的要因に加えて環境要因(食生活の欧米化や飲酒,喫煙)が大きく関与し,近年のゲノム解析をはじめとしたオミクス研究の発展によって細菌もしくはその代謝産物の関与も示唆されている5)。
胃におけるHelicobacter pylori(H. pylori)の発見と胃がんへの関与は,消化器がんにおける細菌の関与を明らかにした一例と言える。H. pyloriが発見されたのは1982年のことであり,その後現在に至るまで多くの疫学的研究,動物実験,さらにヒトを対象とした臨床研究などが実施されているが,中でもその関連を強く支持したのが本邦で実施された2つの報告である。Uemuraらは1526人の日本人を対象に,H. pylori感染者と非感染者に分けて,7.8年間追跡調査を行った結果,感染者の2.9%に胃がんが発生したのに対し,非感染者からは1例も胃がんが発生しなかったこと報告した6)。またFukaseらは,早期胃癌に対して内視鏡的切除を受けた544名の患者において,H. pylori除菌を実施した群(272名)と対照の非除菌群(272名)とし,3年間の胃がんリスクを比較する無作為化試験を行った結果,除菌群からの発がん数が非除菌群に比較して3分の1であることを報告し,H. pylori感染が胃がんの原因であることを示唆した7)。
大腸がんにおける細菌の関与については,大腸がん組織と健常大腸組織における細菌叢を比較解析した臨床研究から,Fusobacterium nucleatum(F. nucleatum)が大腸がん組織において高率に検出されることが2012年に報告されて以来8,9),多くの研究者がその関連に注目し始めた。動物実験においては,口腔内投与されたF. nucleatumが大腸がん発生を促進することが報告されており10),2017年にはF. nucleatumが存在するヒト大腸がん組織をマウスに異種移植した結果,何世代にもわたり大腸がんが発生し,そのがん組織中にはF. nucleatumが検出されることが報告された11)。また同研究においては,抗菌薬メトロニタゾール投与によって異種移植がん組織中のF. nucleatum量の減少とともに,がん細胞数の減少とがん病巣サイズの縮小が確認された。2016年には大腸がん組織内のF. nucleatumの量が多いと抗癌剤の効果が低下すること,大腸がんの再発率が高いことが報告されている12)。これらのことはF. nucleatumの存在が単なる結果や随伴現象ではなく,大腸がんの原因もしくは促進因子である可能性を示すものであろう。F. nucleatumに関しての更なる詳細については2019年の総説を参照されたい13)。
歯周病原細菌の消化器がんへの関与
前述の通り,歯周病原細菌のひとつであるF. nucleatumの大腸がんへの関与については多くの報告がされているが,他の消化器がんにおける関与も知られている。Yamamuraらは食道がん組織ではF. nucleatum DNA量が正常食道上皮組織に比較して有意に高く,F. nucleatum陽性の食道がん患者は陰性患者に比べて予後が悪いことを報告している14)。またF. nucleatumと同様に主要な歯周病原細菌として知られるPorphyromonas gingivalis(P. gingivalis)においても,食道がんとの関連が報告されている。Petersらは,16SリボソームRNAシークエンスを用いた食道がん患者と健常者の食道細菌叢の比較において,食道がんでP. gingivalisが増加することを報告している15)。またGaoらは,食道がん組織100例中31例がP. gingivalis陽性である一方で,対照群の健全食道粘膜組織中には陽性例を認めなかったこと,さらにP. gingivalisが食道がんの悪性度と相関することから,食道がんのバイオマーカーとしての可能性を示唆している16)。これらの報告は歯周病原細菌が消化管局所に存在してがんの発症・進行に関与することを示唆するが,それらが真に口腔由来の細菌であるかは不明であった。Komiyaらは14名の大腸がん患者を対象に内視鏡を用いて採取した大腸がん組織および唾液検体を比較した結果,患者8名(57%)において大腸がん組織と唾液の両方からF. nucleatumが検出され,選択培地を用いて分離された計1,351株をAP-PCR法にて菌株レベルで解析したところ,8名中6名の検体において大腸癌組織と唾液の両方から同一菌株が検出されたことを報告した。これは全被験者の43%にあたり,大腸がん組織からF. nucleatumが検出された患者母集団においては75%に相当し,消化がん局所に存在する歯周病原細菌のリソースが口腔内であることを強く示唆するものである17)。また,5カ国470人の唾液および糞便を対象にした,バイオインフォマティクス技術を用いた一塩基変異による菌株レベルでの解析によって,310菌種のうち125菌種が口腔と大腸で共通していることが報告されており,口腔細菌が大腸へ大量に送り込まれていることが明らかとなった4)。我々は人工胃液を用いたin vitro研究にて,強酸性下においても特定の歯周病原細菌が長時間生存することを報告しており18),嚥下された歯周病原細菌が生菌として下部消化管に到達し,がんの発症・進行に影響を与えている可能性が高いと考えている。
歯周病原細菌による消化管がん発症・進行の分子メカニズム
では,どのようなメカニズムで歯周病原細菌が消化器がんに影響するのであろうか。F. nucleatumの関与については数多く報告されており,以下の2つのメカニズムが代表的である。ひとつはF. nucleatumが特徴的に有するビルレンス因子であるフゾバクテリウムアドヘジン A(FadA)を介したβ-カテニン経路の活性化である19)。細胞の分化・増殖に関与するβ-カテニンは細胞膜の裏打ちタンパク質として,細胞質内ではリン酸化されてプロテオソームによって絶えず分解されている。しかしながら,FadAが腸管上皮細胞の接着分子E-カドヘリンに結合すると細胞膜のβ-カテニンが脱リン酸化される結果,プロテオソームで分解されずに細胞内に蓄積し最終的には核内へと移行する。核内移行したβ-カテニンが,がん遺伝子として知られるCyclin D1やc-Mycなどの発現を亢進することで細胞の増殖や分化を引き起こされる結果,大腸がんの発症・進行に関与すると考えられている20,21)。もうひとつはF. nucleatumのFadAやLPSによって惹起される炎症シグナルの関与である22)。慢性炎症が大腸がんの発症や進行,転移に関与することはこれまでも多くのエビデンスが示されている23)。FadAがIL-6, IL-8, IL-10,IL-18などの炎症性サイトカイン産生を促進する結果,大腸におけるがん細胞の増殖が亢進することが報告されている19)。またLPSを認識するTLR4を介したシグナリングが転写因子NF-κBを活性化することで,大腸がん細胞の増殖能および浸潤能を高めることも報告されている24)(図1)。さらに F. nucleatum感染はマクロファージや樹状細胞などの炎症性細胞の局所への遊走・浸潤を促進させ炎症性微小環境が形成されることが,大腸がんの発症や進行に関わることも知られている25)。大腸がんと炎症の関連を検討した臨床研究においては,F. nucleatumはクローン病や潰瘍性腸炎と言った炎症性腸疾患(Inflammatory Bowel Disease:IBD)患者から検出されることが報告されている26,27)。またEadenらはメタ解析で,IBD患者における大腸がん合併率は3.7%で,累積がん発症率は発症後10年で1.6%,20年で8.3%,発症後30年で18%に増加すると報告し,IBD患者は大腸がん発症リスクが高いことを示唆している28)。これらのことは腸管局所における長期にわたる慢性炎症が大腸がんの発症・進行に関与する可能性を示すものである。近年,我々はin vivo研究において,F. nucleatum以外の特定の歯周病原細菌が腸管局所における炎症応答を亢進させることを報告しており,その詳細を次に述べる29)。

P. gingivalisが腸管局所の炎症反応に与える影響
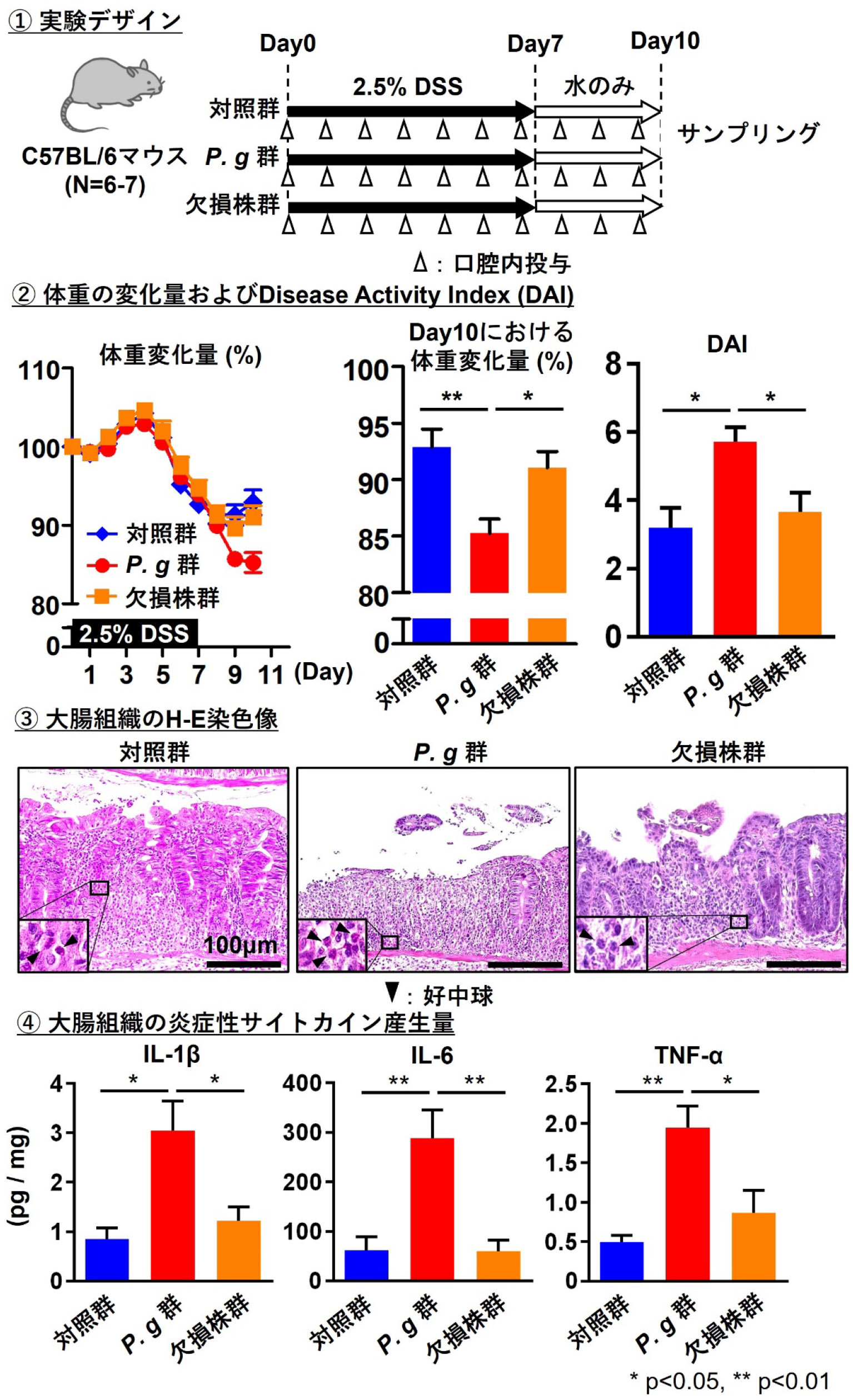
前述の通り,腸管局所の炎症の慢性化が大腸がんに関与することが知られているがF. nucleatum以外の歯周病原細菌の関与については明らかでない。そこで我々は主要な歯周病原細菌のひとつであるP. gingivalisが腸管局所の炎症に与える影響を検討した。8週齢のC57BL/6雄マウスに2.5%デキストラン硫酸ナトリウム(DSS)溶液を7日間飲水投与することで,薬剤誘導性実験的腸炎モデルマウスを確立した。P. gingivalis投与は,2%カルボキシメチルセルロース基材に混和した各細菌を100 μl(1×109 CFU/ml)ずつ,フィーディングニードルを用いて実験期間にわたり毎日経口投与した。DSS飲水投与開始から10日後に安楽死を行い,サンプリングを実施した。体重変化量と便の硬さ,腸管出血の有無をスコア化した疾患重症度Disease Activity Index(DAI)の測定,大腸組織のH-E染色による組織学的観察を行った。また大腸組織中の炎症性サイトカイン産生をELISAにて解析し,群間での比較検討を実施した。その結果,P. gingivalis投与群は対照群と比較して,有意な体重減少やDAI増加および炎症性サイトカイン産生の増加が認められた。また組織学的に顕著な腸管上皮構造の破壊や好中球の浸潤が認められた(図2)。さらに,P. gingivalisによる腸炎悪化の詳細なメカニズムを検討する目的で,P. gingivalisに特徴的なプロテアーゼであるgingipainを欠損させた菌株を用いて同様の解析を行い,欠損株投与群では野生株投与群と比較し,有意な体重減少やDAI増加は認めず,炎症性サイトカインの発現量も有意に低かった(図3)。これらのことからP. gingivalisが腸管局所の炎症応答を亢進させること,そしてその応答にはgingipainが関与することを示唆した。今後は大腸がんモデルマウスにおいて,P. gingivalisおよびgingipainの関与を検討したい。
おわりに
本稿においては,F. nucleatumおよびP. gingivalisを中心に消化管がんへの影響,特に大腸がんへの関与について概説を行った。近年では,これまで聞き馴染みのない口腔細菌Klebsiella菌が,異所性に腸管に定着することで病原性を発揮しIBD発症に関与することが報告されている3)。また,大腸がんの各ステージ(多発ポリープ,粘膜内がん,早期がん,進⾏がん)の計616例の凍結便を用いたメタゲノム解析から,がんのステージにおける特定の細菌種が関与し,F. nucleatum以外の新規の口腔細菌の関与も報告されていることも興味深い5)。既知の歯周病原細菌による消化器がん発症・進行への関与の解明に加え,オミクス解析を駆使した新規消化器がん関連細菌の同定は,口腔―腸管連関を中心としたペリオドンタルメディスンの更なる発展に寄与するであろう。また疫学研究における歯周病と大腸がんの関連が報告されている一方で,それを否定するメタ解析の報告もある30)。より大規模で適切な研究デザインの前向き研究の蓄積によって,両疾患の関連性を引き続き検討する必要がある。歯周病と消化管がんの関連の解明は,細菌リザーバーである口腔内を標的にしたプロバイオティクスもしくは特異的抗菌療法による,新たな消化管がん早期予防・先制医療の可能性があり,新しい付加価値を有した歯科医療体系の創成が期待される。
今回の論文に関連して,開示すべき利益相反状態はありません。
References
- 1) Nwizu N, Wactawski-Wende J, Genco RJ: Periodontal disease and cancer: Epidemiologic studies and possible mechanisms. Periodontol 2000, 83: 213-233, 2020.
- 2) Arora M, Weuve J, Fall K, Pedersen NL, Mucci LA: An exploration of shared genetic risk factors between periodontal disease and cancers: a prospective co-twin study. Am J Epidemiol, 171: 253-259, 2010.
- 3) Atarashi K, Suda W, Luo C, Kawaguchi T, Motoo I, Narushima S, Kiguchi Y, Yasuma K, Watanabe E, Tanoue T, Thaiss CA, Sato M, Toyooka K, Said HS, Yamagami H, Rice SA, Gevers D, Johnson RC, Segre JA, Chen K, Kolls JK, Elinav E, Morita H, Xavier RJ, Hattori M, Honda K: Ectopic colonization of oral bacteria in the intestine drives TH1 cell induction and inflammation. Science, 358: 359-365, 2017.
- 4) Schmidt TS, Hayward MR, Coelho LP, Li SS, Costea PI, Voigt AY, Wirbel J, Maistrenko OM, Alves RJ, Bergsten E, de Beaufort C, Sobhani I, Heintz-Buschart A, Sunagawa S, Zeller G, Wilmes P, Bork P: Extensive transmission of microbes along the gastrointestinal tract. eLife, 8: 2019.
- 5) Yachida S, Mizutani S, Shiroma H, Shiba S, Nakajima T, Sakamoto T, Watanabe H, Masuda K, Nishimoto Y, Kubo M, Hosoda F, Rokutan H, Matsumoto M, Takamaru H, Yamada M, Matsuda T, Iwasaki M, Yamaji T, Yachida T, Soga T, Kurokawa K, Toyoda A, Ogura Y, Hayashi T, Hatakeyama M, Nakagama H, Saito Y, Fukuda S, Shibata T, Yamada T: Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer. Nat Med, 25: 968-976, 2019.
- 6) Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ: Helicobacter pylori infection and the development of gastric cancer. N Engl J Med, 345: 784-789, 2001.
- 7) Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, Amagai K, Hayashi S, Asaka M, Japan Gast Study G: Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial. Lancet, 372: 392-397, 2008.
- 8) Castellarin M, Warren RL, Freeman JD, Dreolini L, Krzywinski M, Strauss J, Barnes R, Watson P, Allen-Vercoe E, Moore RA, Holt RA: Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma. Genome Res, 22: 299-306, 2012.
- 9) Kostic AD, Gevers D, Pedamallu CS, Michaud M, Duke F, Earl AM, Ojesina AI, Jung J, Bass AJ, Tabernero J, Baselga J, Liu C, Shivdasani RA, Ogino S, Birren BW, Huttenhower C, Garrett WS, Meyerson M: Genomic analysis identifies association of Fusobacterium with colorectal carcinoma. Genome Res, 22: 292-298, 2012.
- 10) Wu S, Rhee KJ, Albesiano E, Rabizadeh S, Wu X, Yen HR, Huso DL, Brancati FL, Wick E, McAllister F, Housseau F, Pardoll DM, Sears CL: A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses. Nat Med, 15: 1016-1022, 2009.
- 11) Bullman S, Pedamallu CS, Sicinska E, Clancy TE, Zhang X, Cai D, Neuberg D, Huang K, Guevara F, Nelson T, Chipashvili O, Hagan T, Walker M, Ramachandran A, Diosdado B, Serna G, Mulet N, Landolfi S, Ramon YCS, Fasani R, Aguirre AJ, Ng K, Elez E, Ogino S, Tabernero J, Fuchs CS, Hahn WC, Nuciforo P, Meyerson M: Analysis of Fusobacterium persistence and antibiotic response in colorectal cancer. Science, 358: 1443-1448, 2017.
- 12) Mima K, Nishihara R, Qian ZR, Cao Y, Sukawa Y, Nowak JA, Yang J, Dou R, Masugi Y, Song M, Kostic AD, Giannakis M, Bullman S, Milner DA, Baba H, Giovannucci EL, Garraway LA, Freeman GJ, Dranoff G, Garrett WS, Huttenhower C, Meyerson M, Meyerhardt JA, Chan AT, Fuchs CS, Ogino S: Fusobacterium nucleatum in colorectal carcinoma tissue and patient prognosis. Gut, 65: 1973-1980, 2016.
- 13) Brennan CA, Garrett WS: Fusobacterium nucleatum - symbiont, opportunist and oncobacterium. Nat Rev Microbiol, 17: 156-166, 2019.
- 14) Yamamura K, Baba Y, Nakagawa S, Mima K, Miyake K, Nakamura K, Sawayama H, Kinoshita K, Ishimoto T, Iwatsuki M, Sakamoto Y, Yamashita Y, Yoshida N, Watanabe M, Baba H: Human Microbiome Fusobacterium Nucleatum in Esophageal Cancer Tissue Is Associated with Prognosis. Clin Cancer Res, 22: 5574-5581, 2016.
- 15) Peters BA, Wu J, Pei Z, Yang L, Purdue MP, Freedman ND, Jacobs EJ, Gapstur SM, Hayes RB, Ahn J: Oral Microbiome Composition Reflects Prospective Risk for Esophageal Cancers. Cancer Res, 77: 6777-6787, 2017.
- 16) Gao S, Li S, Ma Z, Liang S, Shan T, Zhang M, Zhu X, Zhang P, Liu G, Zhou F, Yuan X, Jia R, Potempa J, Scott DA, Lamont RJ, Wang H, Feng X: Presence of Porphyromonas gingivalis in esophagus and its association with the clinicopathological characteristics and survival in patients with esophageal cancer. Infect Agent Cancer, 11: 3, 2016.
- 17) Komiya Y, Shimomura Y, Higurashi T, Sugi Y, Arimoto J, Umezawa S, Uchiyama S, Matsumoto M, Nakajima A: Patients with colorectal cancer have identical strains of Fusobacterium nucleatum in their colorectal cancer and oral cavity. Gut, 68: 1335-1337, 2019.
- 18) Sato K, Takahashi N, Kato T, Matsuda Y, Yokoji M, Yamada M, Nakajima T, Kondo N, Endo N, Yamamoto R, Noiri Y, Ohno H, Yamazaki K: Aggravation of collagen-induced arthritis by orally administered Porphyromonas gingivalis through modulation of the gut microbiota and gut immune system. Sci Rep, 7: 6955, 2017.
- 19) Rubinstein MR, Wang X, Liu W, Hao Y, Cai G, Han YW: Fusobacterium nucleatum promotes colorectal carcinogenesis by modulating E-cadherin/beta-catenin signaling via its FadA adhesin. Cell Host Microbe, 14: 195-206, 2013.
- 20) Bartek J, Lukas J: DNA repair: Cyclin D1 multitasks. Nature, 474: 171-172, 2011.
- 21) Lin CY, Loven J, Rahl PB, Paranal RM, Burge CB, Bradner JE, Lee TI, Young RA: Transcriptional amplification in tumor cells with elevated c-Myc. Cell, 151: 56-67, 2012.
- 22) Wu J, Li Q, Fu X: Fusobacterium nucleatum Contributes to the Carcinogenesis of Colorectal Cancer by Inducing Inflammation and Suppressing Host Immunity. Transl Oncol, 12: 846-851, 2019.
- 23) Brennan CA, Garrett WS: Gut Microbiota, Inflammation, and Colorectal Cancer. Annu Rev Microbiol, 70: 395-411, 2016.
- 24) Yang Y, Weng W, Peng J, Hong L, Yang L, Toiyama Y, Gao R, Liu M, Yin M, Pan C, Li H, Guo B, Zhu Q, Wei Q, Moyer MP, Wang P, Cai S, Goel A, Qin H, Ma Y: Fusobacterium nucleatum Increases Proliferation of Colorectal Cancer Cells and Tumor Development in Mice by Activating Toll-Like Receptor 4 Signaling to Nuclear Factor-kappaB, and Up-regulating Expression of MicroRNA-21. Gastroenterology, 152: 851-866 e824, 2017.
- 25) Kostic AD, Chun E, Robertson L, Glickman JN, Gallini CA, Michaud M, Clancy TE, Chung DC, Lochhead P, Hold GL, El-Omar EM, Brenner D, Fuchs CS, Meyerson M, Garrett WS: Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host Microbe, 14: 207-215, 2013.
- 26) Strauss J, Kaplan GG, Beck PL, Rioux K, Panaccione R, Devinney R, Lynch T, Allen-Vercoe E: Invasive potential of gut mucosa-derived Fusobacterium nucleatum positively correlates with IBD status of the host. Inflamm Bowel Dis, 17: 1971-1978, 2011.
- 27) Dharmani P, Strauss J, Ambrose C, Allen-Vercoe E, Chadee K: Fusobacterium nucleatum infection of colonic cells stimulates MUC2 mucin and tumor necrosis factor alpha. Infect Immun, 79: 2597-2607, 2011.
- 28) Eaden JA, Abrams KR, Mayberry JF: The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut, 48: 526-535, 2001.
- 29) Tsuzuno T, Takahashi N, Yamada-Hara M, Yokoji-Takeuchi M, Sulijaya B, Aoki-Nonaka Y, Matsugishi A, Katakura K, Tabeta K, Yamazaki K: Ingestion of Porphyromonas gingivalis exacerbates colitis via intestinal epithelial barrier disruption in mice. J Periodontal Res, 56: 275-288, 2021.
- 30) Michaud DS, Fu Z, Shi J, Chung M: Periodontal Disease, Tooth Loss, and Cancer Risk. Epidemiol Rev, 39: 49-58, 2017.