2021 年 63 巻 3 号 p. 97-104
2021 年 63 巻 3 号 p. 97-104
Developmental endothelial locus-1(DEL-1)は,Chavakis(ドレスデン工科大学)らのグループによって,インテグリン受容体を介し,好中球の遊走を制御する役割をもつ生体内分子であることが報告された1)。その後,Hajishengallis(ペンシルベニア大学)らのグループが,DEL-1が歯周組織で高発現していることを見出し,DEL-1が歯周炎組織の過度な炎症を抑制することで,歯槽骨吸収を制御していることを明らかにした2)。これらDEL-1は組織局在性の細胞(内皮細胞や間葉系幹細胞およびマクロファージサブセット)から分泌される分子である。N末端に3つの上皮成長因子(EGF)様反復配列,C末端に2つのディスコイジン様ドメインをもつ52 kDaのタンパク質であり,EDIL3(EGF-like repeats and discoidin I-like domains)遺伝子にコードされている。DEL-1は,β2インテグリン(例:αLβ2,αMβ2)やαvβ3などのαvインテグリン,さらにはリン脂質と相互作用することで,炎症や免疫系に重要な役割を果たしていることを明らかにしてきた3,4)。その後,筆者らは両グループとの共同研究において,DEL-1が好中球制御のみではなく,骨髄中の造血系幹細胞における幹細胞ニッチへの誘導作用や破骨細胞と骨芽細胞の調節,エフィロサートーシスの促進,および間葉系幹細胞調節による骨再生にまで影響している可能性があることを示してきた。さらに,これらDEL-1が,生体内でどのように発現制御されているのか,また歯周病や関連疾患治療へ応用できるのかを探索している。近年,歯周炎と肺炎の2つの粘膜疾患を対象とした研究により,DEL-1が老化や炎症に伴い減少することや,DEL-1による骨代謝関連細胞や間葉系幹細胞への作用機序およびDEL-1の発現制御機構が明らかになりつつある。そこで本稿では,DEL-1が持つこれらの多彩な機能とDEL-1の臨床応用への展開を免疫および骨代謝の視点から概説する。
口腔は,消化管の最前線に位置し,様々な外的因子や口腔細菌叢からの刺激に対して高い適応能力を有しているが,その分子基盤は不明である。私たちはこれまでに,歯周組織と口腔細菌の恒常性破綻が歯周炎を引き起こすことを明らかにしてきた5)。DEL-1は,口腔,特に歯周組織に多く発現しており,組織への過度な好中球遊走や骨の代謝を制御することで,恒常性維持に寄与していると考えられる。歯周炎は多種の炎症性細胞がトリガーとなり歯周結合組織の破壊および骨吸収をひき起こすが,初期段階で大きな役割をもつのが好中球である。Hajishengallisらのグループは,マウスに実験的に引き起こした歯周炎組織で,DEL-1発現低下に伴う好中球集積と骨吸収が認められることを報告した2)。当該部位にDEL-1を投与すると,好中球制御による炎症抑制のみならず大幅な骨吸収抑制が認められた。
(本実験および本稿で参照している論文において,マウス歯周炎モデルは非常に重要なモデルである5-8)。マウスの臼歯に絹糸を結紮した歯牙結紮による実験的歯周炎モデルマウスでは,およそ7日~10日間の結紮により(求める炎症や骨吸収の程度によって結紮する期間を調整)炎症および歯槽骨の吸収が確認できる。当該モデルは,口腔内感染モデルと比較し,短期間での歯槽骨吸収が認められるため,骨代謝疾患のモデルとしても使用可能である。詳細な手技および必要な器具(カタログ番号も提示)や薬品等は,参照論文を参考にしていただきたい(図1)。)
しかしながら,マウス歯周炎組織に好中球を抑制するLFA878(LFA-1阻害剤)とDEL-1を接種し,骨吸収に与える影響をそれぞれ比較すると,DEL-1による骨吸収抑制作用がLFA878よりも数倍大きいことが明らかになった9)。すなわち,DEL-1には骨代謝に直接作用する可能性があるのではないかと考え,DEL-1と破骨細胞の関連性を解析することとした。好中球と骨芽細胞は,それぞれが造血系幹細胞と間葉系幹細胞に由来しており,複雑に絡みあいながら骨髄中で場の環境を形成している。筆者らは,骨髄中の造血幹細胞が骨髄幹細胞ニッチへ誘導される際にDEL-1が重要な役割を果たしている知見を得たため,DEL-1が好中球のみならず骨芽細胞や破骨細胞にも何らかの作用を示すのではないかと考えた10)。そこで,破骨細胞におけるDEL-1の発現を解析したところ,破骨前駆細胞と比較し,強いDEL-1発現が認められた。さらにDEL-1の破骨細胞に対する詳細な作用機序を解析したところ,DEL-1は破骨細胞の表面受容体であるMacrophage-1 antigen(Mac-1)およびインテグリンαVβ3受容体を介して,破骨細胞分化と吸収活性の抑制効果を発揮していることが明らかとなった9)。つまりDEL-1は,好中球遊走阻止による炎症抑制作用と破骨細胞に直接的な制御作用を合わせもつ(図2)。
次に,カニクイザルを用いたDEL-1による骨吸収抑制効果を検討する橋渡し研究をおこなった。2~3歳程度(ヒトではおよそ10歳に相当)のサルを使用していた。マウスの実験的歯周炎モデルと同様に,歯牙に絹糸を結紮し歯周炎を実験的に誘導したカニクイザルにDEL-1を直接投与すると,歯周組織の炎症は抑制され,骨吸収の有意な抑制効果が認められた9)。すなわち,DEL-1による骨代謝制御,特に破骨細胞の分化と抑制を介した治療法の可能性を示すことができた。その後,DEL-1とは異なるがフィリピンのサル大規模繁殖施設(SICONBREK, Inc.)を利用し,自然発症した歯周炎をもつサル(10歳齢,ヒトだと歯周炎の好発時期にあたる壮年期)を使用した橋渡し研究を行った。ヒトとサルの口腔細菌叢は相同性が高く,よりヒトに近い結果を得ることができた11,12)。現在,DEL-1による同様な自然発症型歯周炎サルを用いた実験および臨床治験を計画している。しかしながらここで問題となるのが投与方法である。炎症組織へのDEL-1投与では痛みを伴う。そこで筆者らは,DEL-1の発現機構を明らかにすることで,DEL-1を生体に誘導できないか検討することとした。

実験的マウス歯周炎モデルの作成法と解析方法
A.マウス臼歯部を使用する。B.極小ピンセットを用いて5-0絹糸を第一臼歯と第二臼歯の歯間部に挿入する。C.同様に絹糸を第二臼歯と第三臼歯を歯間部に通す。D.結目はできるだけ小さくする。E.オートクレーブ処理後,大きな組織を取り除く。F.オキシドールに浸漬し,15分間の超音波洗浄機で洗浄する。G.5%トリパンブルーに1分間浸漬し,蒸留水にて洗浄する。H.ブラシ等で細かい軟組織や汚れを除去する。
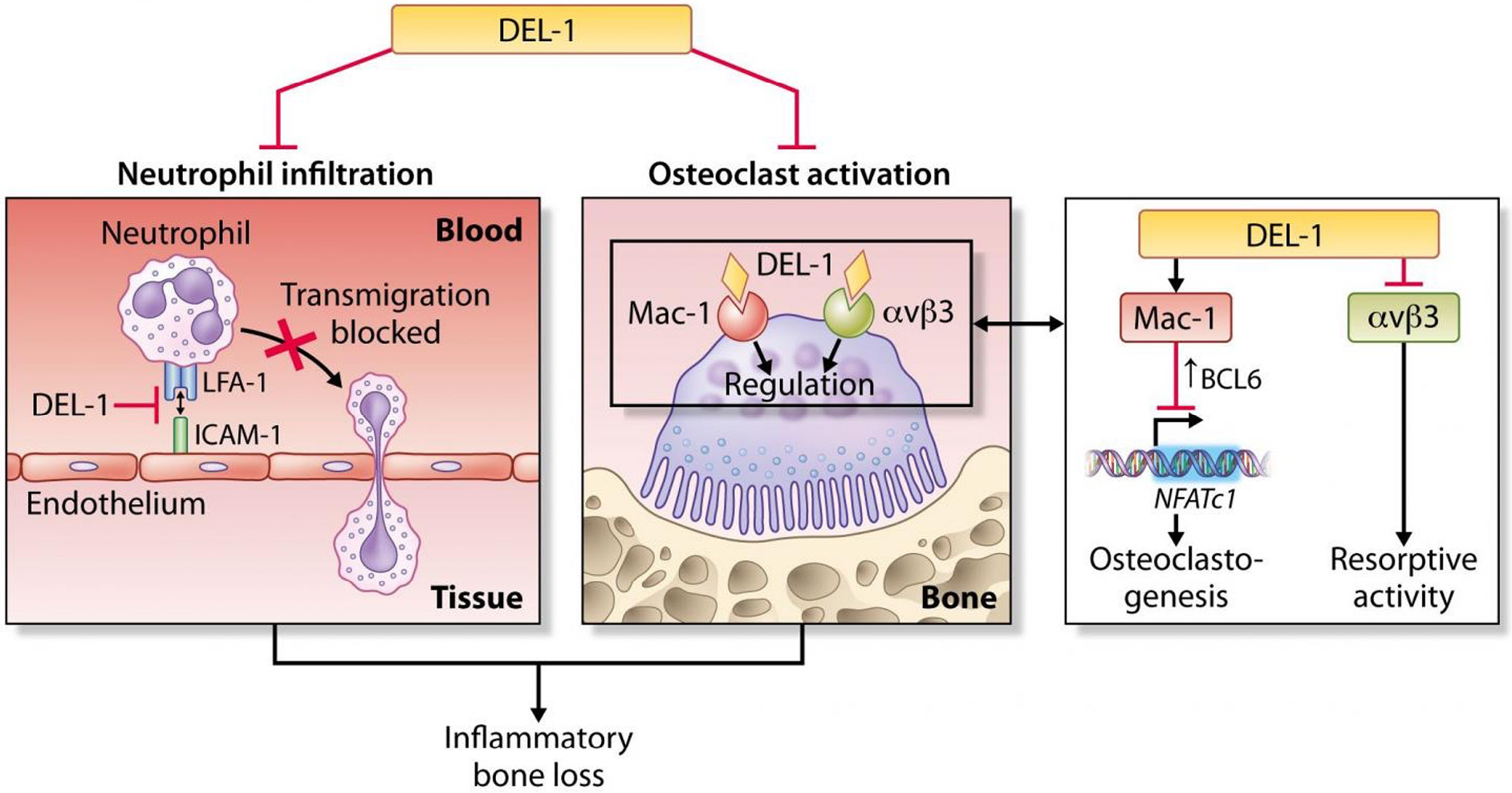
DEL-1は好中球による炎症と破骨細胞分化および活性を同時に抑制する
DEL-1は,好中球の血管から組織中へ接着および遊走を阻害することで,過度な炎症を抑制する。さらにDEL-1は破骨細胞のMac-1受容体を介し,破骨細胞分化のマスター遺伝子であるnuclear factor of activated T cells c1(NFATc1)を抑制することで破骨細胞分化を制御している。さらに,インテグリンαVβ3受容体を介し,骨吸収活性も同時に抑制している。
歯周炎組織では,炎症および加齢に伴いDEL-1の減少が認められる13,14)。そこで,歯周炎局所に発現が上昇し,骨吸収に重要とされる炎症性サイトカインのInterleukin-17A(IL-17A)に着目した。IL-17Aを,DEL-1の主要な産生細胞である血管内皮細胞に添加すると,DEL-1発現が遺伝子・タンパクレベルで抑制されることが認められた。減少したDEL-1発現は,抗炎症作用をもつオメガ3脂肪酸であるResolvin-D1(RvD1)を作用させることで,定常状態まで回復させることができた。DEL-1の主な産生細胞である血管内皮細胞を用いた実験をおこなったところ,RvD1はIL-17AとGlycogen synthase kinase 3(GSK-3β)のリン酸化を競合的に取り合うことで,DEL-1の発現を定常状態にまで引き戻すことを可能にしていることが明らかとなった。続いて,RvD1を実験的歯周炎モデルマウスの歯周炎組織局所に少量接種したところ,DEL-1の発現減少を抑制するとともに,歯槽骨の吸収を制御していた。同様な効果は,DEL-1欠損マウスを使用した実験で認められなかったところから,RvD1の歯周炎による炎症と骨吸収抑制効果はDEL-1依存的であることが明らかになった13)。さらにRvD1は,炎症組織におけるアポトーシスした好中球表面にDEL-1を誘導することで,Eat Meシグナルを呈し,マクロファージによるエフィロサイトーシスを促進し,炎症の寛解に寄与していることも明らかになった15,16)。続いて,男性ホルモンの1種であるDehydroepiandrosterone(DHEA)に着目した。DHEAは欧米にて若返り効果を持つとして購入可能なサプリメントである。LPS誘導性の肺微小血管における炎症に伴う好中球遊走や集積に対し,DHEAを投与することで,炎症の抑制効果が認められた17)。すなわち,DHEAによるDEL-1の全身的な再誘導が,血管炎や肺炎を抑制することが明らかになった。RvD1およびDHEAを使用した研究成果から,歯周炎と同様な粘膜疾患である肺炎や炎症性骨破壊を伴う疾患(歯周炎やリウマチ性関節炎)において,減少したDEL-1をこれらの薬剤で再誘導することにより治療へ応用できる可能性が高いと考えられる。
前述したとおり歯牙を絹糸にて結紮した実験的歯周炎モデルマウスは,結紮から10日程度で炎症と骨吸収が生じるため,炎症性骨破壊研究において有用なモデルである6)。これにさらなる改良を加えて,骨吸収から炎症の寛解,さらに骨再生まで評価できるマウスモデルを作成した。すなわち,結紮10日後に絹糸を除去し,5日の炎症寛解期を経ると,吸収された骨欠損の部位には骨の新生が認められる。このモデルにおけるDEL-1発現量を解析したところ,炎症とともに減少したDEL-1は,5日の炎症寛解期とともに発現上昇がみられた。しかしながら,DEL-1欠損マウスにおいては,正常な骨や歯周組織の修復が認められず,線維化による歯の脱落が生じたことから(図3),炎症除去後に上昇するDEL-1によって,エフィロサイトーシスによる炎症の緩解が促進されることおよび骨再生が誘導されている可能性が考えられる18)。
さらに,これらDEL-1欠損マウスにおける歯周組織の修復機構は,老化野生型マウス(18ヶ月齢)では認められなかった。そこで,DEL-1欠損マウスおよび老化マウスにDEL-1を接種したところ,野生型マウスと同様な骨修復が生じ,さらに骨芽細胞にDEL-1を添加すると,骨形成マーカーであるRUNX2等の遺伝子発現の上昇および骨ノジュール形成がおきる知見が得られている。したがって,DEL-1は破骨細胞に作用するのみならず,骨芽細胞の骨形成を促進する機能をもつ可能性が高い。
続いて,DEL-1による間葉系幹細胞に対する作用を検討した。DEL-1は造血幹細胞の増殖および分化促進作用があることを報告した10)が,間葉系幹細胞に対する作用は明らかになっていない。そこで筆者らは,歯根膜に存在する間葉系幹細胞に着目した。歯根膜に存在する間葉系幹細胞は,上記の骨再生と同様に,結紮除去後5日間を経るとDEL-1の発現上昇とともに間葉系幹細胞と骨芽細胞の増加が認められた。つまり,DEL-1は,間葉系幹細胞の増殖と分化に重要な役割を果たしている可能性が高い。これらDEL-1の骨再生に対する作用は,DEL-1のRGDモチーフに特異的であり,今後はこの構造を利用した,より骨再生に効果的なDEL-1の作製が可能になると考えられる。

DEL-1欠損マウスでは,組織修復機構が破綻している
左図:10日間の結紮と5日間の炎症寛解期と骨再生期を経るモデル
右図:左:野生型マウス,右:DEL-1欠損マウス(DEL-1KO)
NB:新生骨,OB:古い骨,PDL:歯根膜,T:歯
炎症によって減少したDEL-1は,RvD1もしくはDHEAによって定常状態まで回復させることが可能となることを報告したが,次に全身へDEL-1をより強力に誘導する方法はないのかを検討することとした。歯科臨床において,歯周炎治療にマクロライド系抗菌薬の一つであるジスロマックが効果的であることが報告されている。さらに,肺炎においても世界的にマクロライド系抗菌薬の抗炎症作用に期待した投与が行われている19)。感染性の肺炎のみではなく,肺疾患である慢性閉塞性肺疾患20)や嚢胞性線維症21)においても投与されていることから,マクロライドはDEL-1を誘導し,これら2つの代表的な粘膜疾患である歯周炎や肺炎に対して作用していることが考えられる。そこで,マクロライド系抗菌薬の一つであるエリスロマイシンを血管内皮細胞および破骨細胞に直接作用させたところ,それぞれの細胞においてDEL-1の発現上昇が認められた。さらに,エリスロマイシン投与マウスの歯周組織では,ペニシリン投与と比較し,好中球の集積と炎症性サイトカイン産生が低下し,破骨細胞数が減少した。エリスロマイシン投与マウスでは,歯肉組織のみならず肺組織においてもDEL-1の上昇が認められた。また,これらエリスロマイシンによる骨吸収抑制および好中球集積抑制効果は,DEL-1欠損マウスでは認められなかった。つまり,エリスロマイシンの投与は,歯周組織においてDEL-1産生を誘導し,破骨細胞への分化を制御することで,骨吸収を抑制する可能性がある22)(図4)。
続いて破骨細胞および骨芽細胞に対するエリスロマイシンの効果を検討した。破骨細胞にエリスロマイシンを加えると,エリスロマイシンが直接的に破骨細胞に作用していることが確認された23)。骨芽細胞においてもエリスロマイシン投与により骨芽細胞自身がDEL-1発現を誘導されるため,骨ノジュールの形成促進が認められた。では,エリスロマイシンによるDEL-1誘導メカニズムはどうであろうか。
エリスロマイシンによるDEL-1誘導機構を網羅的に解析したところ,エリスロマイシンは血管内皮細胞のGrowth hormone secretagogue receptor(GHSR)に作用し,JAK2-MAPKp38経路を介して,DEL-1の発現を誘導している知見が得られた22)。当該経路は,エリスロマイシンや他のマクロライド系抗菌薬に特異的であり,RvD1やDHEAとは異なる経路を介し,定常状態の2~3倍のDEL-1発現上昇を引き起こす。これまで報告されていたRvD1およびDHEAでは,IL-17AによるDEL-1の発現抑制を打ち消す効果しか認められなかった。しかしながら,エリスロマイシンは,発現抑制効果を打ち消すAkt-GSK3β経路の他に促進に関わるJAK2-MAPKp38経路も同時に活性化することで,強力なDEL-1誘導を発揮していることが明らかとなった22)(図5)。
つまり,エリスロマイシンの全身的な投与とDEL-1の誘導は,歯周炎のみならず,炎症性骨破壊疾患であるリウマチ関節炎や肺炎等にも応用可能である。しかしながら,筆者らは,マクロライド系抗菌薬の頻用による耐性菌の問題点も併せて明らかにしてきた24)。そこで現在,北里大学の砂塚博士研究室との共同研究において,抗菌作用の無いエリスロマイシン誘導体を開発し,DEL-1の誘導による炎症性骨破壊疾患の治療や骨再生への応用を目指している。

A,B.エリスロマイシン(ERM)において大きな歯槽骨吸収の抑制が認められたが,ペニシリン(PC)やジョサマイシン(JSM)では認められなかった。C.DEL-1欠損マウス(DEL-1-/-)では,エリスロマイシンによる骨吸収抑制効果が認められなかった。WT:野生型マウス Ethanol:薬剤の溶媒

左図:エリスロマイシンは血管内皮細胞(HMVEC)にDEL-1発現を強力に誘導し,組織中への好中球遊走を抑制する。右図:RvDはIL-17AによるDEL-1発現抑制効果を打ち消すだけの効果しか認められなかったが,エリスロマイシンはこれに加えて,JAK2-MAPK経路を介したDEL-1発現の上昇効果も併せ持つ。
これまでにPeriodontal MedicineやPeriodontitis-associated comorbidities25)として全身疾患と歯周炎の関連性が着目されてきており,十分なエビデンスが確立されつつある。私たちグループもいくつかの歯周炎と全身疾患の関連性研究を行ってきた26,27)。その中で,DEL-1は口腔と全身において共通して病態に関連する分子であり,肺炎における炎症と再生,そしてリウマチ関節炎における骨吸収抑制と骨再生に対してDEL-1が果たす役割について歯周炎モデルを併用して解明を試みてきた。歯周炎が全身に及ぼす影響が存在するという事実から,歯周炎に近似した病態形成や再生機能が他の臓器にもあるのではないかと考えている。今後のPeriodontal MedicineやPeriodontitis-associated comorbiditiesの展開の一つとして,比較的アクセスしやすいというアドバンテージをもつ口腔を臓器モデルとした研究が,全身疾患の医学研究に活用していけるのではないかと考えている。DEL-1には生体防御を中心とした様々な作用があることが明らかになってきている。DEL-1は,男性に比較的発現が多く,女性に少ないことや,加齢とともに発現減少がみとめられることから,加齢性炎症や加齢性の疾患に強い関わりが予想される。このことから,将来的に,血液中のDEL-1濃度が,炎症性疾患マーカーになる可能性がある。さらに,抗菌作用を持たないエリスロマイシン誘導体によるDEL-1誘導が可能となれば,加齢に伴う骨代謝等の生体恒常性の維持に大きな寄与が期待できる。
DEL-1に関する一連の研究遂行にあたり,共同研究を快く引き受けてくださったペンシルベニア大学のHajishengallis George先生およびドレスデン工科大学のChavakis Triantafyllos先生に心より感謝申し上げます。また,大学院時代から研究をご指導くださいました,新潟大学大学院医歯学総合研究科・歯周診断・再建学分野の多部田康一先生,同研究科・口腔保健学分野の山崎和久先生,同研究科・歯周診断・再建学分野前教授の吉江弘正先生に厚く御礼申し上げます。
今回の論文に関連して,開示すべき利益相反状態はありません。