2021 年 63 巻 4 号 p. 183-189
2021 年 63 巻 4 号 p. 183-189
ヒノキチオールは殺菌効果を有し,歯肉炎及び歯周炎の抑制効果が認められている成分である。本研究では,ヒノキチオールが歯周病原細菌Porphyromonas gingivalis(以下,P.gingivalis)のクオラムセンシングに及ぼす影響について解析した。Vibrio harveyiを用いたオートインデューサー-2(以下,AI-2)バイオアッセイにより,20~300 μMのヒノキチオールにAI-2の阻害活性が認められ,P.gingivalisの培養上清由来のAI-2を阻害する可能性が考えられた。そこで,殺菌力を発揮しない低濃度のヒノキチオールを用いて,P.gingivalisのバイオフィルム形成及びジンジパイン産生に及ぼす影響について解析した。その結果,ヒノキチオールはP.gingivalisのバイオフィルム形成を抑制し,ウェスタンブロット解析により,ヒノキチオールは膜結合型Arg-gingipain,分泌型Arg-gingipain,Lys-gingipainの産生を抑制することが明らかとなった。以上の結果から,ヒノキチオールは,P.gingivalisのAI-2を介したクオラムセンシングの阻害によるバイオフィルム形成やジンジパイン産生の抑制により,歯周病の抑制効果を発揮している可能性が示された。
歯周病とは,細菌の感染によって引き起こされる炎症性疾患であり,歯周組織の炎症や歯槽骨の吸収を引き起こす口腔疾患である。歯周病は,歯肉の炎症によって始まり,歯肉炎が進行すると歯槽骨をはじめ歯周組織に及ぶ歯周炎に発展し,歯周炎の特徴である歯周ポケットが形成され,最終的に歯の喪失を引き起こすことがある1)。
Porphyromonas gingivalis(以下,P.gingivalis)は慢性歯周炎の歯周局所から分離されることが多く,Tannerella forsythia,Treponema denticolaとともに慢性歯周炎の歯周病原細菌と考えられている2)。P.gingivalisは,歯肉縁下のプラーク,すなわちバイオフィルム形成に関与し,歯肉の炎症及び炎症の進行に関与することが知られている3,4)。一般に,バイオフィルムを形成した微生物は薬剤耐性遺伝子の発現を亢進させるとともに,細胞代謝を低下させる4)。加えて,バイオフィルム自体が殺菌剤の透過障壁になることから,バイオフィルム中のP.gingivalisには殺菌剤の効果が低下することが知られている。
またP.gingivalisは,菌体表面及び菌体外に強力なプロテアーゼを産生する。中でもジンジパインは本菌の産生する主要なプロテアーゼであり,ペプチド切断部位特異性の異なるArg-gingipain(以下,Rgp)とLys-gingipain(以下,Kgp)が存在する5)。ジンジパインは生体タンパク質を分解し,宿主細胞に障害を与え,歯周病に関連する種々の病態を生み出すと考えられている5)。以上のことから,P.gingivalisが形成するバイオフィルムや本菌が産生するプロテアーゼであるジンジパインは,歯周病に深く関与すると考えられている。
一方,クオラムセンシングは微生物の生存戦略の一つであり,情報伝達物質であるオートインデューサーを微生物が感知し,密度依存的に遺伝子発現が誘導されることで,自身の生存にとって有利な表現型を発現する。P.gingivalisのバイオフィルム形成やジンジパイン産生には,AI-2を介したクオラムセンシングが関与することが報告されている2-4),6-9)。このことから,P.gingivalisのAI-2を阻害することにより,バイオフィルム形成やジンジパイン産生を抑制できる可能性が考えられる。
ヒノキチオールは,ヒノキやスギに含まれる不飽和七員環化合物である。ヒノキチオールは,殺菌力を有することに加え,Pseudomonas aeruginosa(以下,P.aeruginosa)やCandida albicans(以下,C.albicans)のバイオフィルム形成を抑制することが知られている10-12)。P.aeruginosaやC.albicansのバイオフィルム形成にはクオラムセンシングが関与することから13,14)ヒノキチオールはクオラムセンシングの阻害作用を有する可能性があると考えられる。また,殺菌効果を有するヒノキチオールには歯周病予防の効果が認められている。そこで,歯周病予防のメカニズムとして,ヒノキチオールが歯周病原細菌の1つであるP.gingivalisのクオラムセンシングに関与するAI-2を阻害し,バイオフィルム形成やジンジパイン産生を抑制すると仮説を立て,その可能性について検証を行った。
供試菌株として,Vibrio harveyi(以下,V.harveyi)ATCC BBA-1121,P.gingivalis ATCC 33277を用いた。V.harveyi ATCC BBA-1121は,Kanamycin含有LB寒天培地(以下,Kanamycin-LB培地,30 mg/l Kanamycin,10 g/l NaCl,10 g/l tryptone(BD Bacto™ Tryptone,ベクトン・ディッキンソン,アメリカ),5 g/l yeast extract(Bacto™ Yeast Extract,ベクトン・ディッキンソン,アメリカ),50 mg/ml Kanamycin,15 g/l agar)又は,Kanamycin-LB液体培地(LB液体培地チューブ(+Km),フナコシ,東京)を用いて,30℃,好気条件下で1~2日間培養を行った。P.gingivalis ATCC 33277は,AB-sTSBY液体培地8)(0.15 M NaCl,0.025 M MgSO4,0.1% casamino acids(Bacto™ Casamino Acids,ベクトン・ディッキンソン,アメリカ),5 mM KH2PO4,0.5 mM L-arginine,0.05 mg/ml riboflavin,5 mg/ml thiamine hydrochloride,0.5% glycerol,0.5 mg/ml yeast extract(Bacto™ Yeast Extract,ベクトン・ディッキンソン,アメリカ),0.25 μg/ml hemin,0.5 μg/ml menadione,15 g/l trypticase soy broth(BD™ Trypticase Soy Broth,ベクトン・ディッキンソン,アメリカ))又は,brain heart infusion hemin menadione液体培地(以下,BHIHM液体培地)15)(5 μg/ml hemin,0.5 μg/ml menadione,37 g/l brain heart infusion broth(Bacto™ Brain Heart Infusion Broth,ベクトン・ディッキンソン,アメリカ))又は,sTSBYD液体培地16)(0.25% yeast extract(Bacto™ Yeast Extract,ベクトン・ディッキンソン,アメリカ),0.01% dithiothreitol,2.5 μg/ml hemin,2.5 μg/ml menadione,30 g/l trypticase soy broth(BD™ Trypticase Soy Broth,ベクトン・ディッキンソン,アメリカ))を用いて,37℃,嫌気条件下で16~24時間培養を行った。
2 AI-2バイオアッセイAI-2のコントロールとして,4-hydroxy-5-methyl-3-furanone17)(4-Hydroxy-5-methyl-3-furanone 97%,シグマアルドリッチ,アメリカ)(以下,HMF)を,AI-2阻害剤のコントロールとして,4-bromo-5-(4-methoxyphenyl)-2(5H)-furanone18)(4-Bromo-5-(4-methoxyphenyl)-2(5H)-furanone,シグマアルドリッチ,アメリカ)(以下,BMF)を各々用いた。ヒノキチオールとして,hinokitiol(東京化成工業,東京)を使用した。10%エタノール水溶液を用いて,HMF溶液,BMF溶液,ヒノキチオール溶液を調製し,試験に用いた。P.gingivalisが産生するAI-2を調製するため,P.gingivalisをAB-sTSBY液体培地で24時間,嫌気条件下で培養した。培養上清を,0.22 μM poly vinylidene fluorideフィルター(Millex-GV 0.22 μM PVDF 33 mmガンマ線滅菌済,メルクミリポア,ドイツ)で遠心濾過し,細胞を除去した濾液を試験に用いた。AI-2バイオアッセイはV.harveyi ATCC BBA-1211を用いて行った。V.harveyiをKanamycin-LB培地で培養し,AI bioassay培地(以下,AB培地)19)(0.3 M NaCl,0.05 M MgSO4,0.2% casamino acids,10 mM KH2PO4,1 mM L-arginine,0.1 mg/ml riboflavin,10 mg/ml thiamine hydrochloride,1% glycerol)で2,500倍希釈した。本希釈菌液0.9 mlを200 μM BMF溶液又は400~6,000 μMヒノキチオール溶液0.05 mlと混合した後,30℃,好気条件下で10分間インキュベートした。BMF溶液又はヒノキチオール溶液の代わりに,10%エタノール溶液0.05 mlと混合した溶液をコントロールとした。続いて,2,000 μM HMF溶液又はP.gingivalisの培養濾液0.05 mlを添加して混合し,30℃,好気条件下で4時間インキュベートした。V.harveyiの発光量(Relative Light Unit(以下,RLU))の測定はルミノメーター(SpectraMax Ⓡ iD5,モレキュラーデバイス,アメリカ)を用いて行った。
3 バイオフィルムアッセイP.gingivalisのバイオフィルムアッセイはQiらの報告15)を参考にした。バイオフィルムの調製には96-well plate(CorningⓇ 96-well Clear Flat Bottom Polystyrene Not Treated Microplate,コーニング,アメリカ)を用いた。ヒノキチオールを最終濃度70~100 μMとなるように添加したBHIHM液体培地にて,P.gingivalisを37℃,嫌気条件下で24時間培養した。ヒノキチオール未添加のBHIHM液体培地をコントロールとして用いた。培養後,wellを蒸留水にて洗浄し,well底面に形成されたバイオフィルムを20分間風乾した。0.1%クリスタルバイオレット溶液で15分間バイオフィルムを染色した後,wellを蒸留水にて洗浄し,バイオフィルムに結合していないクリスタルバイオレットを除去した。33%酢酸水溶液を0.2 ml添加し,ピペッティングにて染色液をバイオフィルムから遊離させた。染色液の570 nmの吸光度を測定し,バイオフィルム形成量を評価した。
バイオフィルムの生菌数測定は,20分間風乾したバイオフィルムにリン酸緩衝液(PBS,pH=7.0)を0.2 ml添加し,ピペッティングにてバイオフィルムを剥離,菌体をPBSに懸濁し,寒天培地に播種してCFUを計測した。
4 ウェスタンブロット解析P.gingivalisを,ヒノキチオールを最終濃度30 μMとなるよう添加したsTSBYD培地で16時間培養した。培養後,4,000 rpmで15分間遠心集菌し,上清を除いた。回収した菌体と23 mM AEBSF,100 mM EDTA,2 mM Bestatin,0.3 mM Pepstatin A,0.3 mM E-64を含むプロテアーゼインヒビターカクテル(Protease Inhibitor Cocktail For Bacterial Cells,シグマアルドリッチ,アメリカ)を添加したPBSを1:3の容積比で混合した。タンパク質抽出キット(3-min Bacterial Total Protein Extraction,101 Bio,アメリカ)を用いて,キット添付のプロトコールに従い,タンパク質の精製を行った。タンパク定量キット(BCA Protein Assay Kit,サーモフィッシャーサイエンティフィック,アメリカ)を用いて,キットのプロトコールに従い,Bovine Serum Albuminをスタンダードとしてタンパク定量を行った。濃度調整済タンパク抽出液,4 X NuPAGE LDS Sample buffer(NuPAGE™ LDS Sample Buffer(4X),サーモフィッシャーサイエンティフィック,アメリカ)及び10 X NuPAGE Sample Reducing Agent(NuPAGE™ Sample Reducing Agent(10X),サーモフィッシャーサイエンティフィック,アメリカ)を混合して調製したLoading Sampleを95℃で加熱処理した後,急速冷却した。1レーンあたりタンパク量として5 μgのLoading Sampleを5~20%ポリアクリルアミドゲルで150 V,70分間泳動を行った後,タンパク質を1.0 mA/cm2にて,セミドライブロッティング法によりpoly vinylidene di-fluorideメンブレン(Immun-Blot PVDFメンブレン,BioRad,アメリカ)に60分間転写した。転写したメンブレンは5%スキムミルク(スキムミルク,ナカライ,京都)含有tris buffered saline with tween 20(Tris Buffered Saline with Tween 20(TBS-T)Tablets,pH7.6,Takara,京都)(以下,TBST)で,室温にて60分間ブロッキングを行った後,5%スキムミルク含有0.05% TBSTで10,000倍希釈したウサギ抗ジンジパインポリクローナル抗体(Anti-GP Rabbit Ab,長崎大学門脇知子准教授より分与)20)を加え,4℃で一晩反応させた。メンブレンを0.05% TBSTに浸し,5分間,3回洗浄を行った。5%スキムミルク含有0.05% TBSTで5,000倍希釈したAnti rabbit IgG,HRP-linked antibody(Anti rabbit IgG HRP-linked antibody,セルシグナリングテクノロジー,アメリカ)を加え,室温で60分間反応させた。上記と同様の洗浄を行った後,tris buffered salineでリンスした。Immobilon Western Chemiluminescent Substrate(Immobilon Western Chemiluminescent HRP Substrate,メルクミリポア,ドイツ)にメンブレンを浸漬し室温で5分間反応させた。化学発光スキャナー(C-DiditⓇ,LI-COR,アメリカ)にて,シグナルの検出を行い,画像解析ソフト(Image Studio™ Lite,LI-COR,アメリカ)を用いて検出シグナルの画像解析を行った。
特に記載がない場合,試薬は富士フイルム和光純薬社製(大阪)を用いた。
5 統計解析V.harveyiの発光量,P.gingivalisのバイオフィルム形成量及びジンジパイン発現量を統計学的に解析した。統計解析には,SAS9.4(SAS Institute,アメリカ)を使用した。V.harveyiの発光量,P.gingivalisのバイオフィルム形成量の統計解析にはDunnettによる多重検定を,ジンジパイン発現量の統計解析には対応のないt検定を用い,有意水準は5%とした。
V.harveyiにおいて,ルシフェラーゼを発現するルシフェラーゼオペロン(lux遺伝子)の発現はAI-2によって誘導され,発光することが知られている21)。そこで,ヒノキチオールによるV.harveyiのAI-2の阻害による発光抑制について解析した。ヒノキチオールは数10 mM程度の濃度で静菌及び殺菌効果を有するため22),V.harveyiに対して静菌及び殺菌効果を発揮しない低濃度のヒノキチオールを試験に供した。その結果,AI-2のアナログとして知られているHMF17)により誘導されるV.harveyiの発光が20~300 μMのヒノキチオールを添加した場合に有意に抑制され(P<0.05),その効果はヒノキチオール濃度に依存した(図1)。また,P.gingivalisの培養上清を添加した場合に誘導されるV.harveyiの発光も,100 μMのヒノキチオール存在下で有意に抑制された(P<0.05)(図2)。4時間インキュベート後にV.harveyiの生菌数測定を行い,V.harveyiの生菌数はコントロールと同等であったことから,V.harveyiの発光抑制はヒノキチオールの殺菌効果によるものではないことが示唆された。
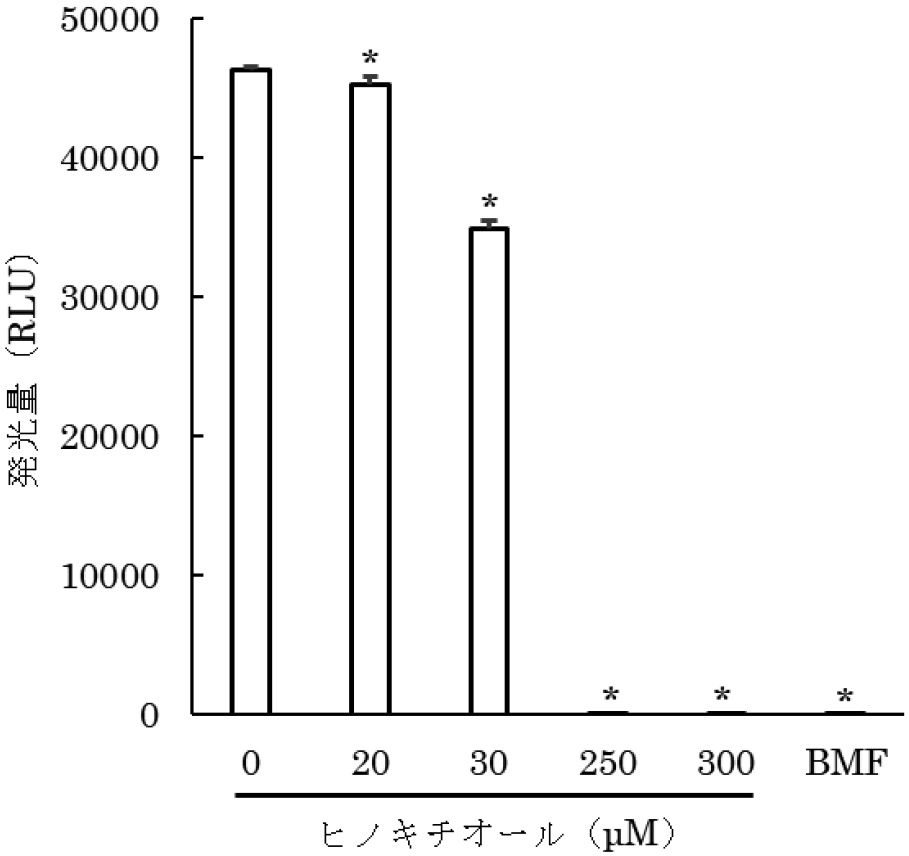
ヒノキチオールによるAI-2阻害効果
ヒノキチオール存在下でのV. harveyiの発光量
(平均値±SD)
*Dunnett法による検定で有意差あり(n=3,P<0.05)
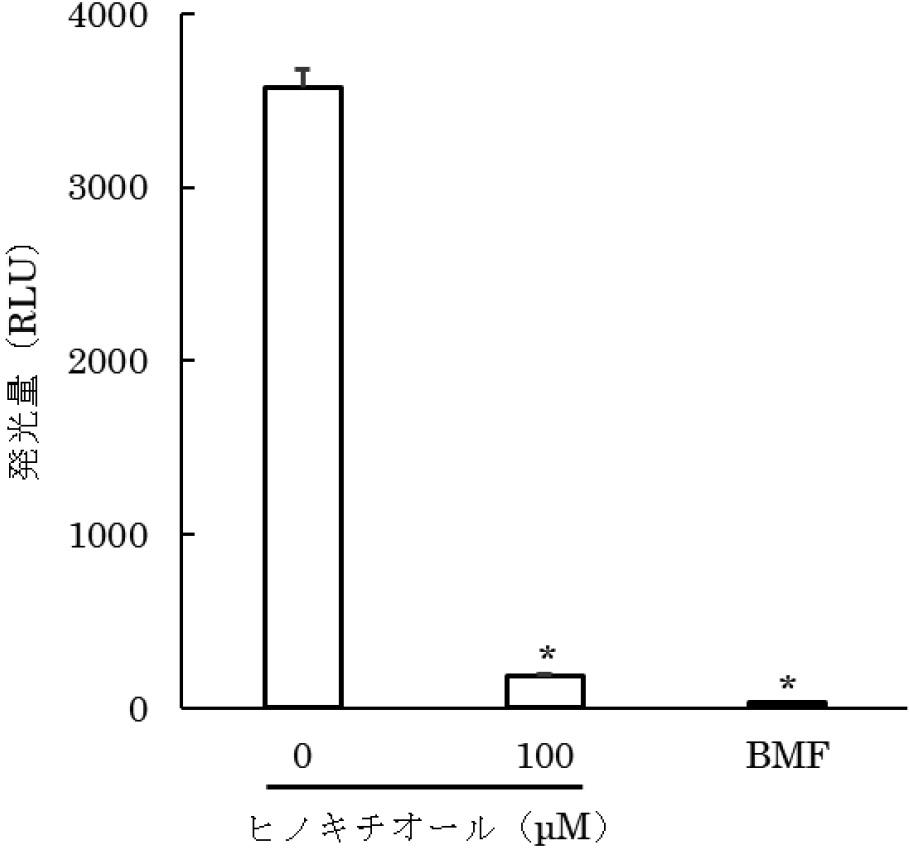
ヒノキチオールによるP. gingivalisのAI-2阻害効果
ヒノキチオール存在下でのV. harveyiの発光量
(平均値±SD)
*Dunnett法による検定で有意差あり(n=3,P<0.05)
ヒノキチオールによるP.gingivalisのバイオフィルム形成の抑制効果について解析を行った。バイオフィルム形成量の測定は,ヒノキチオールがP.gingivalisに対する静菌及び殺菌効果を発揮しない70~100 μMの低濃度で実施した。その結果,P.gingivalisのバイオフィルム形成量はヒノキチオール存在下で濃度依存的に有意に低下することが明らかとなった(P<0.05)(図3)。バイオフィルム形成量測定時にP.gingivalisの生菌数測定を行い,生菌数はコントロールと同等であったことから,P.gingivalisのバイオフィルム形成量の低下はヒノキチオールの殺菌効果によるものではないことが示唆された。

ヒノキチオールによるP. gingivalisのバイオフィルム形成抑制効果
ヒノキチオール存在下でのP. gingivalisのバイオフィルム形成量
(平均値±SD)
*Dunnett法による検定で有意差あり(n=3,P<0.05)
ヒノキチオールとP.gingivalisのジンジパイン産生との関係を明らかにするため,Rgp及びKgpを共通抗原とする抗ジンジパイン抗体を用いてウェスタンブロット解析を行った。ヒノキチオールを添加した培地でP.gingivalisを培養した後,菌体の膜結合型Rgp,分泌型Rgp,Kgpの発現量を解析した。ヒノキチオール存在下において,70~90 kDa,44 kDa及び51 kDa付近に検出される膜結合型Rgp,分泌型Rgp,Kgpのバンドのシグナルは,有意差は認められなかったものの低下する傾向が認められた(図4a,b)。
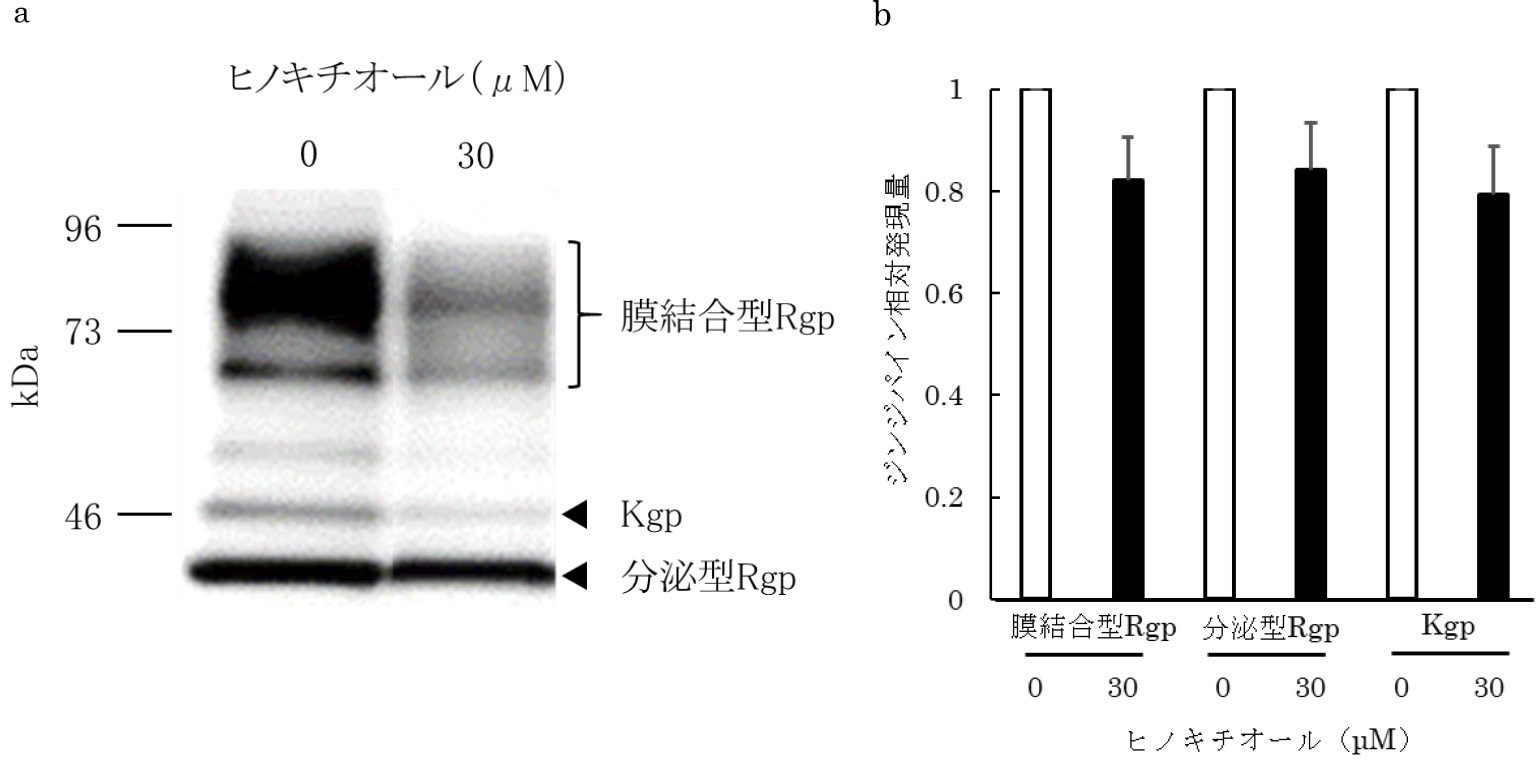
ヒノキチオールによるジンジパイン産生抑制効果
a ウェスタンブロッティング像
b ウェスタンブロッティング検出バンドの画像解析(平均値±SD,n=3)
ヒノキチオールのP.gingivalisのクオラムセンシングへの影響を明らかにするため,V.harveyiを用いたAI-2バイオアッセイを行った。その結果,ヒノキチオールが殺菌効果を発揮しない低濃度で,AI-2を阻害することが明らかとなった(図1)。また,P.gingivalisのAI-2による誘導と考えられるV.harveyiの発光がヒノキチオールにより阻害された(図2)。以上の結果から,ヒノキチオールがP.gingivalisのAI-2を介したクオラムセンシングを阻害することが示唆された。
既報によると,P.gingivalisのバイオフィルム形成はAI-2により促進されると考えられている2-4),6)。そこで,ヒノキチオールがP.gingivalisのAI-2を阻害することによりバイオフィルム形成を抑制すると仮説を立て,検証を行った。その結果,P.gingivalisに対する殺菌効果を発揮しない低濃度のヒノキチオールがバイオフィルム形成を抑制することが明らかとなった(図3)。
P.gingivalisの主な病原因子であるジンジパインの発現には,AI-2を介したクオラムセンシング機構が関与することが,AI-2をコードするluxS遺伝子の欠損株を用いた解析により明らかにされている7-9)。本研究によりヒノキチオールにAI-2阻害活性が認められたことから,ヒノキチオールがP.gingivalisのジンジパインの発現を抑制するという仮説を立て,検証を行った。ウェスタンブロッティングによるタンパク質発現解析により,膜結合型Rgp,分泌型Rgp,Kgpの産生量がヒノキチオール存在下で低下する傾向が認められた(図4a,b)。このことから,ヒノキチオールはAI-2によるクオラムセンシング機構を阻害し,P.gingivalisのジンジパイン産生を抑制することで,P.gingivalisの病原性を低下させる可能性が示された。
本研究により,ヒノキチオールはその殺菌力に加え,P.gingivalisのAI-2を介したクオラムセンシングを阻害し,バイオフィルム形成やジンジパイン産生を抑制することで,歯周炎の抑制効果を発揮している可能性が考えられた。本研究により明らかとなったヒノキチオールの作用は,P.gingivalisに対する殺菌力を発揮しない低濃度で発現することから,ヒノキチオールは他の殺菌剤と比較して,歯周病に対してより高い効果を有することが示唆された。
本研究を進めるに当たり,長崎大学・門脇知子准教授にウサギ抗ジンジパインポリクローナル抗体を分与いただき,解析について有益なご助言をいただいた。この場を借りて,深く謝意を表したい。
今回の論文に関連して,開示すべき利益相反状態はありません。