2023 年 65 巻 4 号 p. 109-116
2023 年 65 巻 4 号 p. 109-116
Periodontal disease is a chronic inflammatory disorder characterized by progressive destruction of periodontal tissues, including alveolar bone resorption, primarily caused by dental biofilm accumulation. The progression of periodontal disease involves factors derived from periodontal pathogenic bacteria, coupled with environmental factors, such as smoking and stress. Additionally, host-dependent factors closely linked to the regulation of immune responses and inflammatory reactions play a critical role. Our research focused on elucidating the homeostatic mechanisms in periodontal tissues. We extensively studied the role of adenosine and the response of periodontal tissues to hypoxia. Through the activation of its receptors, adenosine modulates inflammatory reactions in the gingival fibroblasts and gingival epithelial cells. CD73, an enzyme responsible for extracellular production of adenosine, has been shown to play a role in promoting the differentiation of osteoblasts. Gingival epithelial cells cultured under hypoxic conditions showed suppressed IL-6 and IL-8 production induced by IL-1β in a hypoxia inducible factor-1α (HIF-1α) -dependent manner. We also found that in gingival fibroblasts and periodontal ligament cells, the production of extracellular matrices such as collagen and PLAP-1 was enhanced under hypoxia. The first half of this article provides an overview of our findings.
Although the progression of periodontal disease can be suppressed by mechanical removal of the dental biofilm, this alone cannot regenerate the lost periodontal tissue. Treatment involving guided tissue regeneration membranes or using enamel matrix proteins or fibroblast growth factor 2 can be effective for cases of mild-to-moderate periodontal tissue defects. However, there is no well-established regenerative therapy for severe periodontal tissue destruction. We have been working on the development of a therapy for severe periodontal disease involving autologous transplantation of adipose tissue-derived mesenchymal stem cells. In the second part of this article, we provide an overview of our research achievements, including the results from basic research and a clinical study, and introduce our current endeavors.
歯周病は,歯面に付着したデンタルバイオフィルムが原因となり歯槽骨吸収を含む歯周組織の進行性破壊が生じる慢性炎症疾患である1)。歯周病の発症進行には,歯周病原性細菌に由来する因子に加え,喫煙やストレス等の環境因子と,免疫応答や炎症反応の制御等に関わる宿主因子が深く関与している2)。著者の所属する研究室では,歯周組織の恒常性維持機構,さらには歯周組織における炎症反応制御機構を解明することを目的に,プリンヌクレオシドの一つであるアデノシン(Ado)が果たす役割や歯周組織の低酸素応答について研究を重ねてきた。本稿前半では,我々がこれまでに報告した知見について概説する。
一方,歯周病は,原因となるデンタルバイオフィルムを機械的に除去することにより,その進行を抑制することができるものの,それだけでは歯周病で失われた歯周組織の再生は期待できない。原因除去療法の後に行われるGTR膜や,エナメルマトリクスタンパクあるいはfibroblast growth factor(FGF)2製剤等を用いた歯周組織再生療法は,軽度から中等度の歯周組織欠損に対し効果を発揮するものの,重度の歯周組織欠損に十分に対応できる確立された歯周組織再生療法はない。我々は,重度歯周病に対応可能な歯周組織再生療法として間葉系幹細胞の自己移植による治療法の開発に取り組み,基礎研究から臨床研究へと橋渡し研究を展開してきた。本稿後半には,これまでに我々が達成した研究成果について概説するとともに現在の取り組みについて紹介する。
1970年代にBurnstockらは,アデノシン三リン酸(ATP)が細胞内のみならず細胞外にも存在し,細胞間伝達物質の一つとしての役割を担うことを報告した3)。以来現在に至るまで,細胞外に存在するATPを含むnucleotide,さらにその代謝産物であるAdoが細胞膜上に発現する特異的受容体を介して多種多様な生体反応の制御に関与していることが明らかとなってきた。我々は,炎症反応制御や創傷治癒促進効果が報告されているAdoを,歯周病におけるhost modulatorの一つとして着目し,歯周組織におけるAdoの生物学的活性を解析してきた。その結果,ヒト歯肉線維芽細胞(HGF)上のアデノシンレセプター(AdoR)活性化は,IL-1β刺激によって誘導されるIL-6,IL-8の産生,細胞外基質の一つであるヒアルロン酸合成,接着分子ICAM-1の発現を調節すること4),歯肉上皮細胞においてiNOSの発現誘導から一酸化窒素産生を制御すること5)を明らかにした。これらの結果は,AdoR活性化を介した細胞機能制御が歯周組織の恒常性維持や炎症反応制御に重要な役割を担っていることを示唆している。
2) 細胞外アデノシン濃度調節機構Adoは細胞外におけるATP分解産物として,主にCD73分子のもつ5'-nucleotidase活性によって産生されうること,さらにCD26分子の細胞外ドメインに結合したadenosine deaminase(以下,ADA)によって分解されうることなどが示唆されていた。しかしながら細胞外におけるAdo濃度調節機構,さらにそのメカニズムとAdoR活性化制御機構との関与については,十分な解析がなされておらず,歯周組織に関する情報は皆無であった。そこで我々はHGFとリンパ球細胞株を用いた実験系により,細胞外におけるAdoの代謝機構とAdoRの活性化制御機構について解析を行った。はじめにHGF上のCD73分子の発現と,CD73分子を介したAdoの産生を確認し,このAdo産生経路がHGF上のAdoRを活性化するか否かについてAdoRのセカンドメッセンジャーであるcAMPを指標として解析した。その結果,CD73分子によって産生されたAdoがAdoRを活性化しうることが明らかになった6)。さらに,ヒトCD26分子遺伝子導入リンパ球株を用いた実験から,細胞質由来のADAがCD26分子との接着により細胞外にecto-ADAとして存在しうることを確認し,この機構はAdoRの活性化を抑制していることを明らかにした7)。次にこのecto-ADAによるAdoR活性化制御機構がHGFの細胞機能に及ぼす影響について,ヒアルロン酸合成酵素HASの発現を指標として解析を行った。その結果,Adoによって誘導されるHAS1 mRNAの発現はecto-ADAによって抑制され,その抑制効果はADA阻害剤の添加によってほぼ完全に消失した8)。興味深いことに,CD73分子の基質であるアデノシンモノリン酸の添加によってもAdoR活性化に伴うHAS1 mRNAの発現が誘導され,この発現はAdo添加時と同様にecto-ADAにより抑制された。これらの結果はHGFのAdoR活性化がCD73分子とCD26分子に接着したecto-ADAによって調節されていることを示唆している。しかしながら同条件で行った培養上清中のAdo濃度測定においては,ecto-ADAによってAdo濃度が減少する傾向を示したものの,有意な抑制効果は得られなかった。この結果は,ecto-ADAがAdoR近傍のAdo濃度のみを調整することにより,AdoR活性化の制御に関与していることを示唆している。
3) CD73による骨芽細胞分化制御機構細胞外Adoの産生酵素であるCD73の発現は,骨代謝に極めて重要な役割を担うWnt-β-cateninシグナルによって誘導される9)。また,骨再生や骨格の発生に重要な役割を担う低酸素誘導因子(HIF-1α)もCD73の発現制御に重要な役割を担う10)。そこで筆者らはCD73の骨代謝における役割について検討するため,CD73-/-マウスの骨における表現型を解析した。CD73-/-マウスは体長,体重ともに野生型マウスと差を示さないものの,雄性成体における海綿骨量が野生型マウスに比べ有意に減少しており,血清中のオステオカルシン濃度および長管骨に発現する骨芽細胞マーカー遺伝子の発現の有意な低下も認められた。さらに,CD73-/-マウス由来初代培養骨芽細胞をin vitroで分化誘導すると石灰化ノジュールの形成能が野生型マウス由来の骨芽細胞に比べ,有意に低下していることが明らかとなった11)。さらにマウス骨芽細胞株MC3T3-E1細胞にCD73を強発現することによって分化能が顕著に亢進し,同効果はAdoRのサブタイプの一つであるA2B AdoRの選択的拮抗薬存在下にて有意に抑制された。以上の結果から,CD73を介して産生された細胞外AdoがAdoRの活性化を介して骨芽細胞の分化を促進することが明らかとなった。
4) 歯周病治療薬としての期待AdoRシグナルの制御を薬理作用とした薬剤の開発が,様々な疾患を対象に進められている。AdoRの活性化による炎症反応制御機能とともに硬組織形成促進作用が明らかになれば,世界発のhost modulating drugとしての歯周病治療薬の開発につながる可能性があると期待される。
局所での炎症反応が長期化すると,血流停滞が生じ,組織のうっ血状態が惹起される。さらに,炎症性サイトカインの産生や炎症細胞浸潤による炎症巣局所での代謝亢進によって,酸素の需要と供給のバランスが崩れ,炎症反応誘導性の低酸素状態が局所に誘導されると考えられている。加えて近年,炎症反応によって惹起された組織の低酸素状態が,各種炎症性疾患の病態を修飾する可能性が示唆されており,その機序の一つとして低酸素誘導因子(HIF-1α)が中心的な役割を担うことが明らかにされている。
2) 歯肉上皮細胞におけるHIF-1αによる炎症性サイトカイン産生制御歯肉上皮は,最初に歯周病原性細菌と対峙する組織であり,外来の病的刺激に対する物理的なバリアーとしてのみならず,微生物の構成成分を認識し,様々なサイトカインを産生することによって,局所免疫応答に関与することが知られている。我々は,Porphyromonas gingivalis(P.g.)を経口感染させることによって人為的に歯槽骨吸収を再現するマウス歯周炎モデルを用いて,歯肉上皮における低酸素状態を解析した。実験では,10 mmHg以下の酸素濃度部位にチオール含有付加物を形成するpimonidazoleをP.g.経口感染マウスの腹腔内に投与し,歯周組織におけるpimonidazoleの集積を検討した。その結果,抗pimonidazole抗体を用いた免疫染色により,P.g.非投与群と比較し投与群で歯肉上皮における染色性の亢進が認められた。このことはP.g.感染が歯肉上皮に低酸素を誘導することを示唆している。さらにヒト歯肉上皮細胞株epi 4あるいは初代培養ヒト歯肉上皮細胞を用いたin vitro解析から,IL-1β誘導性のIL-6およびIL-8の産生は低酸素下で抑制され,その抑制はHIF-1αの発現抑制あるいは機能阻害によって回復することが明らかとなった12)。この結果は,P.g.感染によって酸素濃度の低下が生じた歯肉上皮において,HIF-1α依存性にIL-6およびIL-8の産生が制御されることを示唆しており,歯周病の病態形成過程における低酸素応答の関与を示したといえる。
3) 歯肉線維芽細胞,歯根膜細胞におけるHIF-1αによる細胞外基質産生制御細胞外基質は,生体組織に機械的強度や柔軟性,可塑性を与え,周囲の細胞が接着する際の足場,組織や器官の形成・維持に重要な役割を担っている。さらに,細胞外基質は細胞膜状に発現するインテグリン等の分子を介してシグナル伝達することで,発生,分化,免疫応答,血液凝固,創傷治癒などの多様な生体反応を制御する。近年,低酸素応答の一つとして細胞外基質の産生制御が,生理学的,ときには病態生理学的に重要な役割を果たすことが報告されている。
我々は歯周組織において細胞外基質を産生する主要な細胞であるHGFとヒト歯根膜細胞(HPDL)を用いて,低酸素が両細胞の細胞外基質産生に及ぼす影響について検討した。両細胞を低酸素環境にて培養するとタイプIコラーゲンの産生が亢進することを見出した13)。興味深いことに,低酸素下での培養ではCOL1A1およびCOL1A2 mRNAの発現は影響を受けない一方で,コラーゲンの合成過程に必須の水酸化酵素であるprolyl 4-hydroxylase subunit alpha1(P4HA1)およびprocollagen-lysine,2-oxoglutarate 5-dioxygenase 2(PLOD2)の発現がHIF-1α依存性に上昇することが明らかとなった。さらにP4HA1,PLOD2の各遺伝子をsiRNAの導入により抑制した細胞においては,低酸素によるタイプIコラーゲンの産生や成熟が抑制されたことから,HIF-1αは両水酸化酵素の発現上昇を介してコラーゲン合成を促進させることが明らかとなった。
一方で,著者の所属する研究室では,HPDLを対象に行われたtranscriptome解析の結果を基に,歯根膜に特異的に発現する細胞外基質PLAP-1(Periodontal Ligament Associate Protein-1)を同定している14)。PLAP-1はsmall leucine rich repeat proteoglycan familyに分類され,bone morphogenetic protein(BMP)-2と直接結合することにより,BMP受容体との結合を阻害し,歯根膜細胞の硬組織形成細胞への分化を負に制御すること15)や,FGF-2と結合することで歯根膜におけるFGF-2の主な受容体であるFGF受容体1に対する親和性が上昇すること16),また,マウス歯根膜細胞においてtoll like receptor(TLR)2およびTLR4のアンタゴニストとして働くことにより,両TLRの活性化を介した炎症性サイトカインの産生を抑制すること17)を報告してきた。さらに,著者らはHPDLを低酸素にて培養することによりPLAP-1の産生がHIF-1α依存性に活性化することを見出した18)。興味深いことに,PLAP-1発現を抑制したHPDLでは,低酸素によって誘導されるHIF-1αの集積が亢進したことから,PLAP-1がHIF-1αのネガティブフィードバック機構の一つとして機能することが明らかとなった。
4) 歯周組織における低酸素応答の考察と今後の展開ヒトの歯周病病巣の組織切片を免疫染色にて解析した結果から,歯周組織に浸潤したマクロファージにHIF-1αが強発現していることに加え19),炎症歯周組織では,健康な歯周組織に比べ,歯肉上皮細胞や歯肉線維芽細胞におけるHIF-1αの発現が上昇している20)ことが報告されている。これらの報告は歯周病局所における低酸素状態を裏付けるとともにHIF-1αの病態生理学的な役割を示唆している。一方で,HIF-1αはHPDLの硬組織形成細胞への分化においても制御因子としての機能を担う21,22)。また,前述のような炎症反応の制御や細胞外基質産生の促進作用(図1)を考え合わせると,低酸素応答を担うHIF-1αの歯周組織における生体防御的な役割は大きいと思われ,今後のさらなる研究の進展によりHIF-1αを中心とした新たな歯周組織恒常性維持機構が解明されることが期待される。
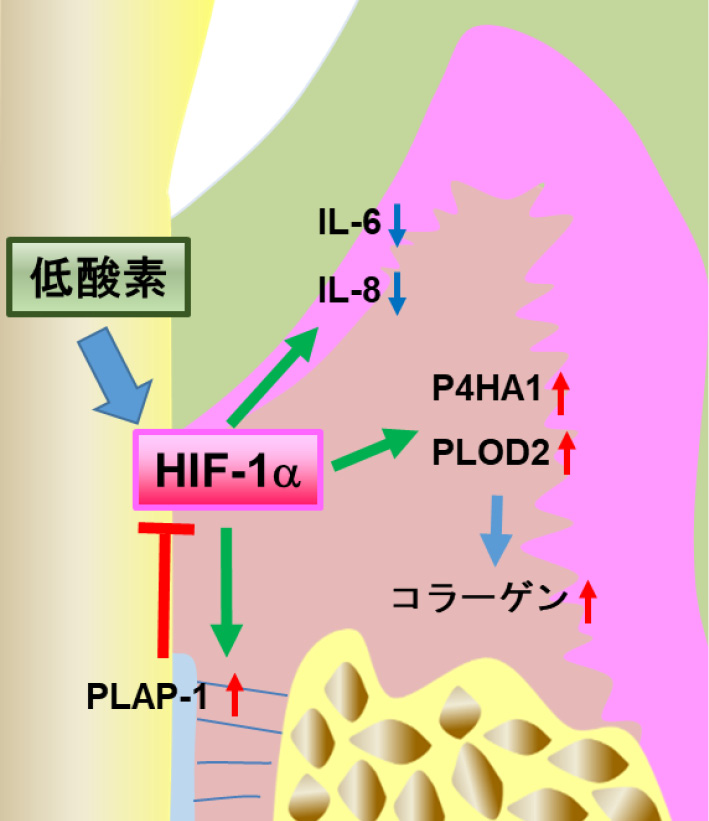
歯周組織におけるHIF-1αの機能
再生医療は「機能不全や機能障害に陥った生体組織や臓器に対し,細胞利用に重点を置き,その機能の再生を目指すもの」と定義されている。「細胞の積極的な利用」に基づく医療は,1970年代に,白血病患者向けの造血幹細胞を含む骨髄移植療法として始まった。現在では,間葉系幹細胞,ES細胞,iPS細胞などの多能性幹細胞を活用した再生医療が,これまで治療が困難とされていた疾患に対して研究開発され,大きな期待を集めている。歯周組織再生の領域でも,既存の歯周組織再生療法では回復が困難な重度歯周組織欠損に対する新たな治療法としての開発を目指し,骨髄,脂肪組織,歯髄,歯根膜に由来する間葉系幹細胞を用いた移植療法の効果が非臨床研究で報告されている23)。我々の研究室では,比較的低侵襲で,かつ安全に採取可能な脂肪組織に注目し,同組織中に内在する未分化間葉系幹細胞に焦点を当て,同幹細胞の自己移植による歯周組織再生誘導効果について検討を重ねてきた。
2) 脂肪組織由来多系統前駆細胞脂肪組織に存在する間葉系幹細胞は,他の組織由来の間葉系幹細胞と比較して,脂肪組織の採取法に関する利点のみならず,自己複製能・増殖能が高く,多くの液性因子を産生する能力を有することが報告されている。脂肪組織由来幹細胞の単離方法は,Zukらの方法24)が一般的に用いられているが,Okuraらは同方法により単離した細胞からエチレンジアミン四酢酸処理により回収される細胞を脂肪組織由来多系統前駆細胞(Adipose tissue-Derived Multi-lineage Progenitor Cells:ADMPCs)と呼び,解析を進めている25)。その結果ADMPCは従来の脂肪組織由来幹細胞に比べ,脂肪細胞,軟骨細胞および骨芽細胞への高い分化能を示す26)ことから,より純度の高い幹細胞であると位置づけられている。
3) ADMPC自己移植による歯周組織再生誘導に関する非臨床研究我々の研究室では,これまでにADMPCの自己移植による歯周組織再生効果を,ビーグル犬実験的歯周病モデルを用いた非臨床研究にて明らかにしてきた。すなわち,ビーグル犬の体網組織よりADMPCを単離・培養する一方で,同ビーグル犬の下顎第三,第四前臼歯の頬側分岐部に頬舌径3 mm,高さ5 mmの分岐部骨欠損を人工的に作製,歯科用シリコン印象材を填入,縫合することにより炎症反応を惹起した。4週後に歯科用シリコン印象材と周囲に形成された肉芽組織を掻把除去した後,同個体より採取したADMPCを自己移植した。足場材には生体内の生理的環境下で適切に吸収されること,近未来の臨床応用を見据え,研究当時,既に生体接着剤として臨床にて使用されていたフィブリン製剤を用いた。移植6週後にマイクロCTにて歯槽骨量を定量的に評価するとともに,組織切片を作製し,アザン染色により新生セメント質の形成を解析した。その結果,足場材のみを埋植した対照側と比較し,ADMPC移植側において有意な歯槽骨再生が認められた。さらに,組織学的解析からADMPC移植による骨量の増加が確認されるとともに,新生セメント質の有意な形成が認められた。また,骨性癒着や歯根吸収等の異常治癒所見は一切認められなかった27)。
一方で,ADMPC移植による歯周組織再生の分子機序の一端を解明するために,ADMPC由来液性因子に焦点をあて,HPDLへのTrophic効果に関して解析を行った。すなわち,ADMPCの培養上清をHPDLの培養液中に添加し,HPDLの増殖および硬組織形成細胞への分化に及ぼす影響について検討した。その結果,ADMPCの培養上清添加はHPDLの増殖に影響を及ぼさない一方で,石灰化誘導培地によって誘導されるアルカリホスファターゼ活性は有意に上昇し,石灰化ノジュール形成が亢進することが明らかとなった。また,同分化促進効果にInsulin-like growth factor binding protein 6が関与していることが明らかとなった28)。
4) ADMPC自己移植による歯周組織再生療法の安全性と有効性に関する臨床評価我々は,上記非臨床研究にて得られた成果を踏まえて,ADMPC自己移植による歯周組織再生療法の安全性と有効性を評価するための臨床研究を大阪大学歯学部附属病院近未来歯科医療センターにて実施した(図2)。同センターは歯周外科手術やインプラント治療などの歯科における外来手術を安全に実施するための施設が完備された手術室と,閉鎖系培養装置(セルプロセッシングアイソレーター)が設置された細胞培養加工施設を備えており,歯科における橋渡し研究の遂行を目的に2010年に設立された。
上記臨床研究の試験デザインは単施設実施単群非盲検試験とし,歯周基本治療を受けたのち,歯周外科の適応と判断された12名の重度歯周病患者を対象と設定した。研究参加の同意を取得後,局所麻酔下にて10-30 mLの腹部皮下脂肪組織を吸引採取し,上記センター内にて医薬品の製造管理及び品質管理の基準(GMP)に準拠した細胞製剤調整システムを活用してADMPCを単離,培養した。1-2か月程度の培養を行い,その間に細胞数,生存率,純度,ならびに感染症検査(無菌試験,エンドトキシン試験,マイコプラズマ否定試験)を実施し,試験物が事前に設定した規格を満たしていることを確認した後,移植当日にフィブリン製剤との複合体を作製した。ADMPCの移植手術は,通常の歯周外科手術と同様に,局所麻酔下にて被移植部位の歯肉骨膜弁を形成後,肉芽組織を掻把し,歯槽骨欠損部にADMPC・フィブリンゲル複合体を移植した後,歯肉骨膜弁を復位,縫合した。本臨床研究の主要評価項目は当該治療法の安全性とし,移植36週後までの自覚所見や他覚所見に加え,血液検査,尿検査等の臨床検査を実施し,有害事象の有無,種類,重症度,発生頻度を評価した。また副次評価項目は当該治療の有効性とし,移植36週後における規格X線写真をもとに新生歯槽骨の増加率を算出するとともに,歯周組織検査にて歯周ポケット深さと臨床的アタッチメントの獲得を評価した。
2015年1月にFirst-in-manとなるADMPC移植を実施した。同症例は,歯周基本治療後に下顎左側犬歯の遠心に残存した垂直性骨欠損に対し,ADMPC移植を実施したが,移植36週後のX線写真では,移植前に認められた骨欠損はほぼ全て新生骨で満たされ,歯周ポケット深さは3 mmの減少,臨床的アタッチメントは2 mmの獲得であった。移植から8年が経過した現在においても再生した歯槽骨は良好に維持されており,歯周ポケットの再発は認められていない。2018年2月に予定された症例数12例に対するADMPC移植を完了し,同年10月には全ての症例に対する術後の経過観察を終了した。主要評価項目の安全性については,研究期間中に観察された有害事象はいずれも通常の歯周外科手術後に生じうる程度のものであり,ADMPC移植に関連すると考えられる重篤な有害事象は認められなかった。有効性については,移植36週後の新生歯槽骨増加率が49.13±32.16%,歯周ポケット深さが3.67±1.78 mmの減少,臨床的アタッチメントが3.00±1.76 mmの獲得となり,いずれも移植前と比較し,有意な改善を示した。なお,12例のなかには,通常であれば抜歯適応と診断されうる症例も含まれていたが,ADMPC移植後には歯周組織の再生に伴い十分な機能回復が確認された。これらの結果から,ADMPCの自己移植による歯周組織再生療法は,安全かつ有効であると結論付けられた29)。

ADMPC移植治療の流れ
上記臨床研究を遂行するなかで,当該再生療法を実用化するために解決すべき課題も明らかとなった。12例全ての症例で有効性が見出されたものの,その効果には個人差が認められた。個人差の原因の一つとして挙げられるのが移植したADMPCの細胞特性の個体差であり,これについてはreverse translational researchによって解明する必要がある。また,有効性を向上させるもう一つの観点はADMPCの至適足場材の選定である。フィブリン製剤は十分なスペースメイキング能力がなく,歯槽骨欠損が広範囲に及ぶ症例では,歯肉の退縮や陥凹によって組織再生の場が失われたために組織再生効果が十分に得られない症例が認められた。そこで近年,上市された歯科用骨補填材のなかでも高いスペースメイキング能力を有する炭酸アパタイト製剤に着目し,ADMPCの足場材としての有効性を非臨床研究にて見出した。すなわち,炭酸アパタイトはADMPCの細胞機能に大きな影響を与えないことをin vitroの解析から明らかにするとともに,ビーグル犬への一壁性骨欠損モデルを用いた解析から炭酸アパタイト製剤を足場材としてADMPCを自己移植することにより良好な歯周組織再生が誘導されることを明らかにした。これらの非臨床研究の結果を踏まえ,有効性を主要評価項目と設定した臨床研究を現在実施しており,実用化への礎にしたいと考えている。
稿を終えるにあたり,全ての研究の遂行に際しご指導頂きました大阪大学大学院歯学研究科村上伸也教授に心より感謝申し上げます。また,研究遂行にご協力頂きました大阪大学大学院歯学研究科口腔治療学講座の先生方,Oklahoma Medical Research FoundationのLinda Thompson博士,ならびにADMPCの自己移植治療の開発に際しご指導ご協力頂きました共同研究者の先生方に厚く御礼申し上げます。 本稿に記載した研究の一部はAMED(課題番号JP22bk0104105h0003,23bk0104163h0001)の支援を受けました。
今回の論文に関連して,開示すべき利益相反状態はありません。