脳科学研究は過去25年間に非常に進歩した.1990年に米国でThe Decade of the Brainというプログラムが始まり,2013年に開始されたBRAIN InitiativeのひとつとしてHuman Connectome Projectが推進されている.ヨーロッパでは2005年にBlue Brain Projectが始まり,現在はHuman Brain Projectが進行中である.わが国でも2008年から脳科学研究戦略推進プログラムが開始された(表1).現在ではInternational Brain Initiativeが始まり,世界中の研究者とWeb会議を開いている.
|
国 |
年 |
研究プロジェクト |
|---|---|---|
| 米国 | 1990 | The Decade of the Brain |
| 2013 |
BRAIN Initiative Human Connectome Project |
|
| ヨーロッパ | 2005 | Blue Brain Project |
| 2013 | Human Brain Project | |
| 日本 | 2008 | 脳科学研究戦略推進プログラム |
| 2014 | Brain/MINDS | |
| 2018 | Brain/MINDS beyond |
BRAIN, Brain Research through Advancing Innovative Neurotechnologies
MINDS, Mapping by Integrated Neurotechnologies for Disease Studies
我が国の脳科学研究の枠組みは『脳の世紀(https://www.braincentury.org/)』に記載されている.第一の「脳を知る」では,脳の働きの理解を目指す.第二の「脳を守る」では,精神・神経疾患のメカニズムの理解と制御を目指す.第三の「脳を創る」では,脳型の情報システムを理解し,たとえばAIのようなシステムの構築を目指す.第四の「脳を育む」では,脳科学に根ざした教育の推進を目指す.私は「脳を知る」と「脳を守る」の枠組みのなかで,脳イメージングを用いて脳の働きを理解することと,それを使ってどのように精神・神経疾患を理解し,どのように治療するかという立場で研究をすすめてきた.本稿では,脳は情報を処理する臓器であること,神経イメージングを使った研究,最近になって成果がでてきたbrain-machine interface,最後に,神経画像コホート研究と機械学習やAIとを組み合わせた新しい診断技術について紹介したい.
脳は他の臓器と比較して複雑である.捉えどころがないといってもよい.脳も人の臓器の一つであるので,ゲノム情報は他の臓器と同一であるが,脳特異的な蛋白質が脳特異的な機能を持ち神経細胞を作り出している.神経細胞は約1,000億個あり,それぞれに個性がある.さらに1個の神経細胞当たり1万個のシナプスを介して他の神経細胞と繋がり,神経回路網全体には約100兆個のシナプスがある.この膨大な数のシナプスの特性が一人一人の特性または個性をかたちづくっている.従って,もとのゲノム情報は他の臓器と同一であるが,脳は極めて複雑に組み立てられていることが理解できるであろう.しかし,蛋白質,細胞,神経回路などの「物質」がどのようにして人のこころ,例えば,ハムレットがいだいた「生きるべきか死ぬべきか,それが問題だ」の気持ち,天理教であれば「陽気ぐらし」,を生み出しているのかはわかっていない.我々の研究はこの大きなギャップを埋めることにあるといっても過言ではない.
脳は何のために発達した臓器か?脳は複雑であるが,脳の機能を,入力,情報処理,出力の観点からみることはそれほど難しいことではない(図1).第一の役割である入力では,味や匂いは化学物質,光,音,熱や力は物理エネルギーであるので,これらが伝える環境情報や身体情報を,鼻,耳,目や皮膚などの身体上のセンサーで「感覚」として受容する.第二の情報処理では,遺伝子的に決められているような生得的な,あるいは生後の経験から学習した,“感覚–事象”や“感覚–行動”の連関の情報を「記憶」として蓄積し,第一の「感覚」と「記憶」を参照しながら適切な戦略を決定する.第三の出力では,第二の戦略にもとづいて行動計画を立案し,情報として一旦保持するか,直ちに実行するために情報を効果器官,たとえば筋肉に送る.つまり,環境の情報をできるだけ正しく取得し,その情報と自身の記憶とを出来るだけ上手く組み合わせ,生き残るために一番よいように行動する,このような一連の流れが脳の機能であろう.第一の感覚として受容することと,第三の情報を一旦保持するか直ちに効果器官に送る能力は多くの動物が持っているが,連関の情報を記憶として蓄積し,記憶を参照しながら適切な戦略を決定する能力は人で非常に発達している.我々が,入力や出力とは無関係に,事実と違うことを思い悩んだり,妄想したりするのは,このような能力がとりわけ発達した人ならではということであろう.
脳は,重量は全身の2%程度であるが,酸素は25%,ブドウ糖は20%消費することはよく知られている.ところが,何もしていない状態でもこれらのエネルギーの95%を消費していることは意外に知られていない 1 .すなわち,非常に高いコストを払って脳を維持しているのである.そのために,脳血流が低下したり低血糖に至ったりすると容易に障害を受けるとういう脳の脆弱性につながっている.一方,感覚処理や運動などによって脳活動が上昇してもエネルギー消費量は5%程度しか増加しないが,脳血流は30%増加する 1 .この現象は,次に述べる我々の研究の基盤になっている.
神経機能・構造の計測法は過去20年の間に急速に進歩した.光遺伝学(optogenetics)や,私が専門としている機能的MRI(functional magnetic resonance imaging; fMRI)は30年前にはなかった技術である 2 .fMRIの基本原理は神経血管カップリング(neurovascular coupling)と呼ばれる現象である(図2).ヘモグロビンは,酸素と結合(オキシヘモグロビン)して組織に運搬され,酸素を放出するとデオキシヘモグロビンに変化する.神経組織が活動すると,非活動状態と比べて血流が増加し,ヘモグロビンと酸素との結合状態も変化する.fMRIは,このようなBOLD (blood-oxygenation level-dependent)信号をもとに脳神経活動の変化を推定し,多様な刺激や課題に関連した脳領域を明らかにするMRI技術である.
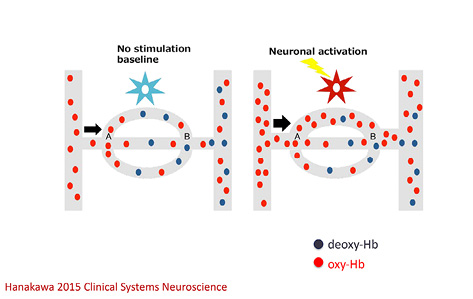
図3は「指タッピング」という課題を与えた後の脳血流と脳代謝の状態から課題を与える前の状態を統計学的な手法で引き算したものを画像化し,通常の構造MRI画像と重ねたものである.このイメージングによって「指タッピング」をしているときの脳の活動がみえることになる.図4は,私が大学院生時代の研究であるが,トレッドミル歩行中の脳還流から臥床中の脳還流を引き算することによって歩行による脳活動の変化をみたものである.この研究結果から,歩行によって脚や体幹に相当する運動野だけでなく,小脳・脳幹も活動していることが見えるようになった 3 .

略語:SMA, supplementary motor area; CMA, cingulate motor area; M1, primary motor area; S1, primary somatosensory area; PM, premotor cortex.
パーキンソン病は,James Parkinsonが初めて記載したモノアミン(ドパミン,ノルアドレナリン)神経細胞の進行性の変性疾患である(図5).病理学的には,中脳の黒質にあるドパミン細胞が消失し,α-シヌクレインからなるレビー小体が認められる.この疾患の症候は,寡動,筋強剛,振戦,姿勢・歩行障害などのスペクトラムとして理解されるが,歩行障害は特徴的である.たとえば「すくみ足」とよばれる現象では,ドアを通り抜けようとしても下肢がすくんで前に出ないが,いったん広い場所に出るとスムーズに歩行することができるようになるのが観察される.一方,パーキンソン病患者はトレッドミル歩行が困難であるが,ベルトコンベア上に縦方向の補助線を引いても歩行は改善しないのに対し,横方向の補助線を引くと歩幅が有意に広くなる 4 .脳神経内科病棟の廊下にしばしば補助線が引いてある理由の一つは,このような歩行障害を手助けすることである.
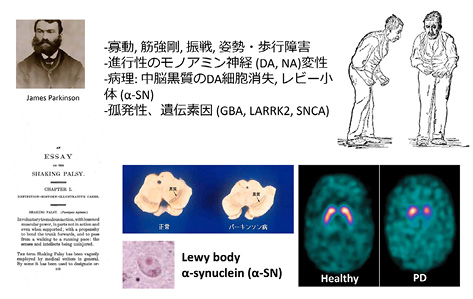
GBA,LARRK2,SNCA遺伝子の変異はパーキンソン病の発症に関連する遺伝素因.右下はドパミントランスポーターSPECT.
略語:DA, dopamineドパミン;NA, noradrenalineノルアドレナリン.
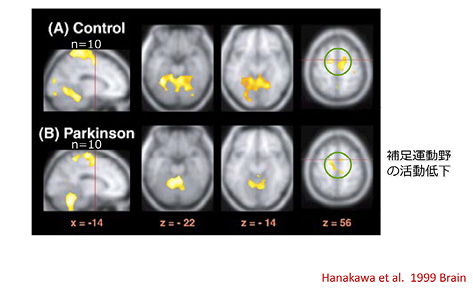
さて,パーキンソン病患者が歩行するとどのような脳活動が観察されるだろうか.図6は歩行によって賦活化される領域をSPECTで画像化し,構造MRI画像と重ねたものである.健常者と比較すると,パーキンソン病患者では補足運動野とよばれる前頭葉内側の活動が低下している.その他にも,楔前部や小脳半球の活動も低下するが,逆に,側頭葉皮質,島,帯状皮質や小脳虫部で活動が上昇する3.次に,ベルトコンベアに横方向の補助線を引いて歩行を改善させると,パーキンソン病患者では右運動前野の背側部が活性化する.これらのデータをあわせると,パーキンソン病患者では,自分で歩幅を決める「内発的運動」の制御にかかわる補足運動野の機能が低下し,歩幅は線の幅で決まる「外発的運動」の制御にかかわる運動前野が機能を代替しているとみなすことができる.
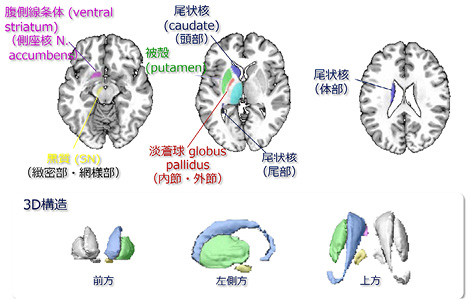
ここまで話をすすめると,そもそもパーキンソン病は大脳基底核病といわれるのに,なぜ大脳皮質の活動が低下するのか不思議に思うであろう.その理由を知るためには大脳基底核皮質回路を理解する必要がある.大脳基底核は,大脳皮質と視床を結びつけている神経核の集まりで,被殻と尾状核からなる線条体,側座核を含む腹側線条体,淡蒼球,視床下核,黒質などの核群から構成される.さらに,尾状核は頭部,体部と尾部に,淡蒼球は外節と内節に,黒質は緻密部と網様部に分けられる(図7).
これらの大脳基底核と大脳皮質,視床の間には大脳皮質→大脳基底核→視床→大脳皮質の回路が形成されている。運動野(一次運動野と上述の補足運動野と運動前野)から始まって運動野に戻る回路は運動回路(motor circuit)とよばれ,四肢の運動をコントロールしている.運動回路は,大脳皮質から直接視床下核に至るハイパー直接路,大脳皮質から線条体・被殻のドパミンD1受容体を有する中型有棘細胞(medium-sized spiny neuron; MSN)に伝達され,淡蒼球内節・黒質網様部→視床を経て大脳皮質にもどる直接路,大脳皮質から線条体・被殻のドパミンD2受容体を有するMSNに伝達され,淡蒼球外節→視床下核→淡蒼球内節・黒質網様部→視床を経て大脳皮質にもどる間接路の3つが代表的である(図8)5.これらの経路は時間差で作動する.すなわち,最初にハイパー直接路が作動して抑制的に作用し,次いで直接路が作動して運動が開始されるが,もう一度間接路から抑制的な信号が入る.つまり,運動を開始しようとするだけでも,最初に一旦待てという信号が入り,次いで開始しようとなるが,さらにもう一度待てという信号が入るという複雑な過程が生じるのである。
パーキンソン病患者では,ドパミン細胞の機能が低下するために,運動を促す直接路の信号が低下し,さらに間接路の抑制的な信号が亢進するという現象が生じる.その結果,淡蒼球内節・黒質網様部の抑制信号が非常に強くなり(図8),最終的には大脳皮質の機能が低下すると解釈されている 5 .つまり,上述の機能イメージングでは大脳皮質の機能低下が際立つ結果であったが,その背後には大脳基底核の機能異常が関わっているのである.わかりやすく言うと,大脳皮質レベルで「このように動こう」としても大脳基底核の機能異常のためにうまくいかない,例えば「すくみ足」のように運動を開始することができない,といった現象が生じることがパーキンソン病の最も中心的な病態であろうと考えている.

白抜きの回路は興奮性に,黒塗りの回路は抑制性に働く.上向きの赤矢印はパーキンソン病で活動が亢進する回路を,下向きの青矢印は低下する回路を示している.
略語:SMA, supplementary motor area補足運動野;PMC, premotor cortex運動前野;MC, motor cortex運動野;Putamen被殻;GPe, external segment of globus pallidus淡蒼球外節;GPi, internal segment of globus pallidus淡蒼球内節;STN, subthalamic nucleus視床下核;SNr, substantia nigra pars reticulata黒質網様部;VLo, VApc/mc, CMは視床の核;DA, dopamineドパミン.
上述のfMRIは,指タッピングや歩行などの課題を与えたときの脳活動から安静時の脳活動を引き算して得られた課題fMRIとよばれる方法であるが,課題を与えられていない安静時にむしろ脳活動が高まる領域も認められる.安静時機能結合MRI(resting-stage functional connectivity MRI; rsfcMRI)は,安静時に生じる自発的脳活動の時間的な相関を指標として,脳機能結合(functional connectivity)を評価するMRI技術である.本法で明らかにされた安静時機能結合ネットワークの一部は,安静時に脳活動が高まる脳の「デフォルト状態」を表現するデフォルトモードネットワーク(default mode network; DMN)とよばれることがある.
rsfcMRIがとらえるBOLD変化は課題fMRIがとらえるそれよりも小さいため,機械的ノイズや呼吸や心拍による生理学的ノイズの除去が重要である.データの統計解析には,関心領域を用いた一変量解析(図9)や,脳全体を一つのネットワークとしてとらえるグラフ理論解析などの多変量解析が提案されている 6 .0.01–0.1ヘルツの低周波帯域のBOLD信号のゆらぎは機能結合情報のダイナミクスを反映している(図9).

課題fMRI:課題と安静を交互に行うブロックデザイン.
Seed-to-voxel解析:まず関心領域(seed voxel)を設定し,そのBOLD変動を抽出する.そのvoxelとその他のvoxelの相関を算出し,比較する.
rsfcMRIの利点は,被験者はMRIの中で安静にしていることだけが求められ,実験時間も5–10分程度と比較的短いので患者の負担が少ない(患者側からみた臨床向き)こと,課題fMRIに必要な感覚刺激の提示・反応記録・課題設計やプログラミングなどの付加的な装置を必要としない(医療者側からみた臨床向き)こと,認知障害や身体的障害のために課題が遂行できない患者であってもMRIスキャナー内で安静にしていることができれば測定可能であるので,ほぼすべての精神・神経疾患に応用可能であること,神経回路機能を反映する(症候を反映)こと,などである7.rsfcMRIは神経回路の豊富な情報を構造MRIと同等の労力で取得することができるので,数年後には臨床現場でも広がることが期待される.
我々の研究グループでは,rsfcMRIを,正常圧水頭症の三兆候(歩行障害,認知症,尿失禁)の責任回路の解明,水俣病に対する経頭蓋磁気刺激法の治療効果の評価,音楽家ジストニア(局所性ジストニア)の病態の解明などの研究に用いている(図10) 8-10 .

略語:rTMS, repetitive transcranial magnetic stimulation反復経頭蓋磁気刺激法.
大脳基底核皮質回路には,運動回路以外に,背外側前頭前野・眼窩前頭野を起点とする連合回路(associative circuit)や,辺縁系(辺縁・傍辺縁皮質,海馬,扁桃体)を起点とする辺縁系回路(limbic circuit)が形成されている 11 .実は,運動は運動回路だけでなく,言語野と繋がっているところもあれば,意思決定の回路ともつながっており,これらの複数の回路が並列に動いているのである.
パーキンソン病患者と会話すると,返答するまでに長時間を要することがある.この現象は運動の低下だけに起因するのではなく,思考も低下しているのではないかと疑わせる.この問題を明らかにするために,以下の課題fMRI実験を実施した.被検者に,1)右手の指を指定した指から指示した数を順にタップする運動(movement),2)同様の動作を頭の中でイメージする思考(imagery),3)指示した数を足し算する計算(calculation),の3つの課題を与え,最後の指がどれか,あるいは和をボタン押しで回答させた.数の指示速度を次第に速くし,fMRI活動の変化をみた.
健常者では,指示速度を速くするに従って,運動課題では運動野と線条体と視床の活動が上昇し,計算課題では線条体と視床と言語野の活動が上昇した.一方,思考課題では運動前野とそれに繋がる大脳基底核と視床の活動が上昇した.つまり,「速く動け」では運動野とそれにつながる大脳基底核が,「速く考えろ」では前頭前野と周辺の認知機能にかかわる部分と,それに繋がる大脳基底核が,「速くイメージしろ」では運動前野とそれに繋がる大脳基底核が動くことになる.これらの結果から,大脳皮質の各領域と繋がる大脳基底核と視床の領域を明らかにしたtractgraphyを作製した(図11) 12 .
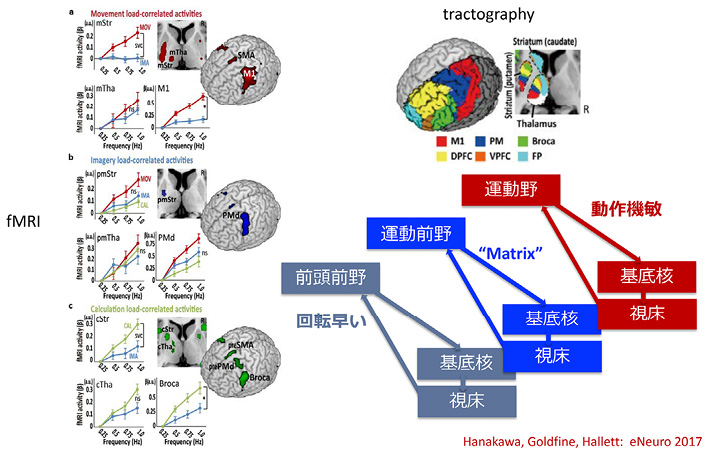
“Matrix”は,コンピューターが作った仮想現実を舞台とした映画“The Matrix”を想起した冗句である.
略語:Str, striatum線条体;Tha, thalamus視床;M1, primary motor area一次運動野;PMd, dorsal premotor cortex背側運動前野;SMA, supplementary motor area補足運動野;Broca, Broca’s areaブローカ野;DPFC, dorsal prefrontal cortex背側前頭前野;VPFC, ventral prefrontal cortex腹側前頭前野;FP, frontopolar cortex.
それではパーキンソン患者ではどうであろうか.各課題の正答率は指示速度を速くするに従って低下し,健常者でも高齢者でより早期に低下するが,パーキンソン患者ではさらに早期に低下する.次に,図12の計算式で得られた正確度(accuracy)を健常者と比較すると,パーキンソン患者では思考課題で有意に低下していた 12 .パーキンソン患者でfMRI活動が低下している領域をみると,運動課題では補足運動野と運動野–線条体,思考課題では背側運動前野と運動前野–線条体,計算課題では下前頭野と下前頭野–線条体であった.つまり,パーキンソン患者では,「運動野→基底核→視床→運動野」ループと,「前頭前野→基底核→視床→前頭前野」ループの両者が低下し,前者は寡・遅動に,後者は寡・遅考に繋がると考えられる(図13) 12 .
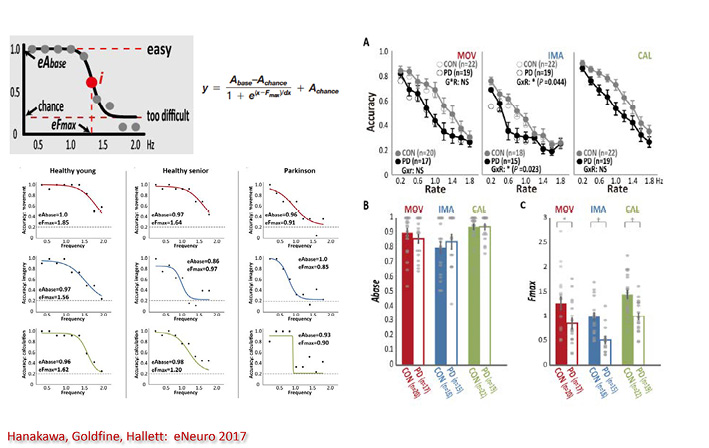
略語:MOV, movement運動;IMA, imagery思考;CAL, calculation計算.
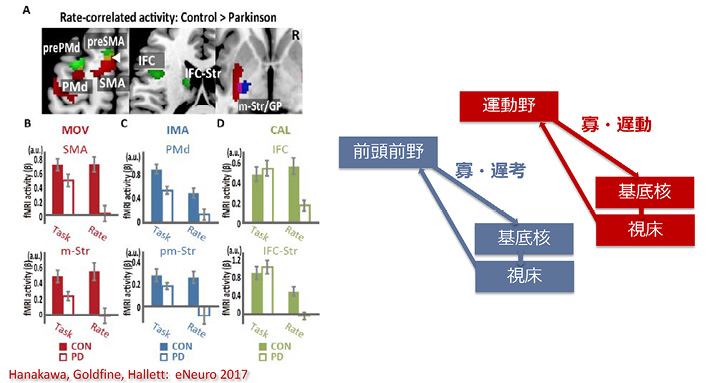
略語:IFC, inferior frontal cortex下前頭野.
BMI研究はアメリカでは早くからすすめられている.2006年の論文では,脊髄損傷後3年経過した四肢麻痺患者の大脳の運動野に96極の剣山型電極を埋め込み,患者が手を動かすことを意図すると,コンピューターモニター上のカーソルを動かしてe-mailを開くことができることが報告された 13 .2012年になるとさらに進歩し,患者が頭のなかでイメージすると,複雑なロボットアームを動かし,ボールをつかむことができるようになった 14 .この方法は電極を半永久的に埋め込む必要があるので直ちに普及するとは思えないが,我が国でも大阪大学の脳外科のグループが筋委縮性側索硬化症の患者に応用しようとしている.
脳波を用いた非侵襲性BMI我々は非侵襲的に脳の情報をとることを目標として,一般臨床で使われている脳波を用いたBMI研究をすすめている.運動をイメージしたり観察したりすると,感覚運動皮質上では9.5–12.5ヘルツのμリズム(sensorimotor rhythm; SMR)が減衰するevent-related desynchronization (ERD)という現象が生じる.図14で示した装置では,ターゲットが左に表示された場合には,被験者に,左手の親指と人差し指から小指までの4本の指を順番に接触させる運動(thumb-finger opposition)をイメージさせる15.すると右半球(C4)のμリズムの強度が左半球(C3)にくらべて減弱する(図14).このBMI装置では,このようなSMRの左右差を検知し,落ちてくるボールを左に曲げて左にあるターゲットに当てるような仕組みになっている.このBMIの難しさは,脳波を計測しながらボールを左右に動かすための情報処理をする必要があるので,すべてをオンライン処理しなければならないことにある.

動画では,左手のthumb-finger oppositionをイメージすると,時間とともに右半球(C4)の緑の曲線のピークが左半球(C3)の赤の曲線のピークに比べて低下することが示されている.このような左右差をERDとよんでいる.
興味あることに,このBMI実験を受けた被験者のなかには,最初からERDの左右差が大きく,ボールをうまく曲げてターゲットに到達させる成功率の高い人と,そうでない人があることが分かった 15 .これらの被験者の補足運動野,補足体性感覚野,背側運動前野の灰白質の容量を測定すると,成功率と正の相関が認められた 15 .つまり,よく「センスがある」とか「センスがない」とかいわれることがあるが,脳には過去にどんなことをやってきたのかという履歴のようなものが詰め込まれていて,最初からうまくやれる人はそのような履歴をうまく使って能力を発揮しているのではないかと考えられる.
我々は脳波とMRIを同時計測し,BMI操作中の脳活動を観察している 16 .いうまでもなく,同時計測にはノイズの除去が必要である.面白いことに,上記のBMI操作が成功した時には大脳基底核,特に被殻の活動レベルが高く,逆に基底核の活動レベルが高い時にBMIの成功率が高いことが分かった.大脳基底核の活動がなぜ脳波に伝わるのか不思議であるが,大脳基底核と大脳皮質は回路を形成しており,回路構造を伝って脳波をつくっている運動野の活動を制御していると考えられる.例えば,大脳基底核と補足運動野がよく相関しているときはBMIの成功率が高い.
一方,パーキンソン病患者では大脳皮質と大脳基底核の回路が低下しているため,ERDの左右差が小さくBMIの成功率が低い.ところが,レボドパを内服するとパフォーマンスが向上する.BMIは非常に複雑で不思議な技術であるが,機械だけではなく,脳側の大脳基底核や皮質の機能によってもうまく制御されていることがわかるであろう.
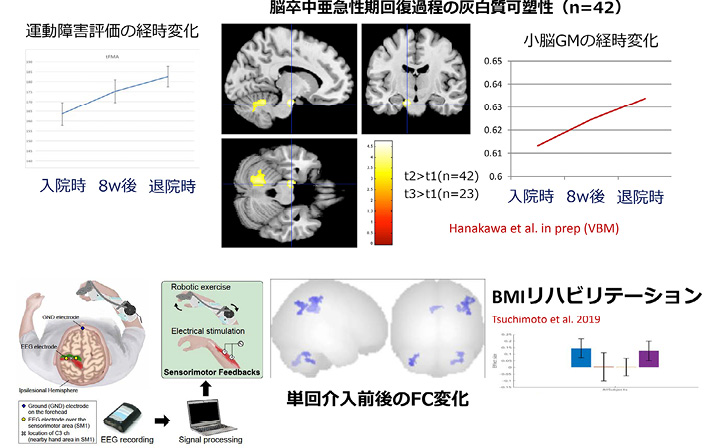
脳卒中リハビリテーションと神経の可塑性BMIは欠損した機能を代替することを目的として進んできたが,慶應義塾大学のリハビリテーション医学のグループはBMI技術をリハビリテーションに応用している.同グループでは,脳卒中患者の患側の感覚運動野の脳波の情報を,ロボットが操作する装具や筋肉の電気刺激装置に送り,患者の意思に従ってモーターがアシストしたり,目的の筋肉を刺激したりするような仕組みを構築した(図15) 17 .この仕組みを使った訓練を繰り返すことによって,元来もっている神経回路を強化し機能回復につなげることを目指している.この訓練の前後では脳波の状態が変化し,rsfcMRIでみると患側の運動野と体性感覚野の結合が強化していることがわかった 17 .この結果は1日の訓練の前後の比較であるが,訓練を繰り返すことによって症状が改善することもわかっている.京都大学にも本年4月から神経リハビリテーションの寄附講座が開設されることが決まったので,近々詳細を案内できると思っている.
脳波に現れた脳活動から被検者の意思を予測するには,デコーディング(decoding)という,広い意味で人工知能(artificial intelligence; AI)とか機械学習(machine learning)とかと呼ばれる技術が使われている.人工知能は非常に古い言葉で,1950年頃からはじまった第一次人工知能ブームがあり,次いで1980年代の第二次人工知能ブームで開発された技術を,今日では機械学習とよぶことが多い.最近は,すでに耳慣れた言葉になっているが,深層学習(deep learning)という技術が,機械学習を進めた形で,しかも実装性のある形で出てきたことから,いわば第三次人工知能ブームが起きている.
深層学習(deep learning)かつて,人工知能の研究者は「機械学習では犬の顔と猫の顔の区別もできないじゃないか」と揶揄されることがあったが,深層学習がそれを可能にした.図16は,多層の神経回路をモデル化し,インターネットからとった何万という犬と猫の写真データを深層学習に入力すると,それが適当に学習して,うまく見分けられるようになったことを示している 18 .なぜこのようなことができるのかという中身は完全にブラックボックスになっているところがこの技術の面白いところである.
ところが,深層学習の技術を我々の研究領域に導入するにはまだ問題がある.なぜなら,データ数が多いと深層学習は非常に性能が良いが,データ数が少ないとむしろ古典的な機械学習のほうが性能は良いのである(図16).一般の構造MRIであれば人間ドックなどで撮像されているので,多数のデータを収集しようとすれば不可能ではないが,我々が取り扱っているfMRIとなると,世界的に見てもまだデータが不足している.
機械学習を応用した精神・神経疾患研究をみると,アルツハイマー型認知症・軽度認知障害が25%を占め,残りは,脳腫瘍,統合失調症,うつ病,パーキンソン病の順に多い(図17) 19 .これらの研究の半分以上ではサポートベクターマシンといわれる「教師あり学習」を用いるパターン認識モデルが応用されることが多い 19 .つまり,データが十分ではないのである.さらに,細かい批判になるが,κ-fold cross validationという検証法が用いられていることも問題である.この方法は,何らかのデータを得たときに、それらを「練習セット」と「試験セット」に分け,前者で得られた結果を後者で検証する方法であるが,この方法には練習問題と試験問題が同じになってしまうというトリックが隠されていることを知っておかなければならない.
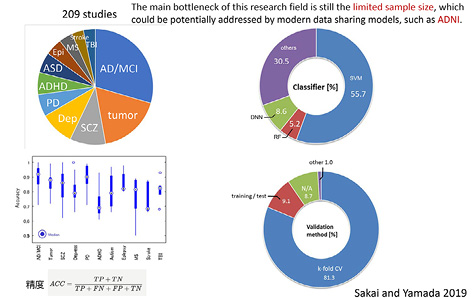
略語:AD, Alzheimer’s disease; MCI, mild cognitive impairment; tumor, brain tumor; SCZ, schizophrenia; Dep, depressive disorders; PD, Parkinson’s disease; ADHD, attention-deficit hyperactivity disorder; ASD, autism spectrum disease; Epi, epilepsy; MS, multiple sclerosis, TBI, traumatic brain injury; SVM, support vector machine; RF, random forest; DNN, deep neural network; CV, cross validation.
上述の音楽家ジストニアでは,運動野や体性感覚野の活動をみても健常者音楽家と区別ができないが,小脳との結合パターンをみると高い確率で診断することができる.まだ症例数が十分ではないが,これも一種の機械学習またはAIの応用といえるだろう.
もう一つの例として,レム睡眠行動異常症(REM sleep behavior disorder; RBD)を挙げよう.レム睡眠時には,脳は覚醒時に近い活動をしており,全身の骨格筋は緊張が低下するatoniaの状態にあるので,夢で見たことを行動に移すことはないが,RBD患者では筋緊張の抑制が障害されるため,夢で見たことをそのまま行動に移してしまう.たとえば喧嘩をする夢をみると,隣に寝ている人を殴ってしまうことがある.なぜこのRBDに注目したかというと,RBDのほぼすべての患者が10年後にはパーキンソン病またはレビー小体病,あるいは多系統萎縮症のようなα-シヌクレイン凝集体の蓄積を特徴とするシヌクレイノパチー(synucleinopathy)を発症するからである.従って,このRBD患者の脳活動の結合パターンを機械学習すれば,パーキンソン病やレビー小体病の発症予測ができるのではないかと考えられる.まだ検討段階ではあるが,60%から70%の確率で予測することができるところまできている.
PADNI研究パーキンソン病患者が認知障害を合併することは明らかであるので,我々は,アルツハイマー病,レビー小体型認知症,パーキンソン病をスペクトラムとして包括的にみていこうと考えている.このコンセプトにもとづいて,我々は「Parkinson病及びAlzheimer病ディメンジョンを対象とした包括的神経画像研究(Parkinson’s and Alzheimer’s disease Dimensional Neuroimaging Initiative; PADNI)」という研究プロジェクトを推進している(図18).

このプロジェクトでは,できるだけたくさんの高齢者や,認知症,パーキンソン病,アルツハイマー病の患者さん,あるいはこれらの病気の初期段階の方々に参加していただき,MRI検査(脳機能・脳構造の計測),血液・髄液検査(血液・髄液採取による神経系由来の異常タンパクの計測),アミロイドPET検査(アルツハイマー病の診断に有用な脳内異常タンパクの計測),ドパミントランスポーターSPECT検査(パーキンソン病関連疾患の診断に有用な脳内ドパミン神経機能の評価),臨床評価(医師の診察による臨床評価),認知・心理評価(問診,質問紙,および課題遂行による認知機能・心理状態評価)を受けていただく.特にMRIはHuman Connectome Projectに準拠した撮影法を用いて詳細なネットワーク情報を取ることを目指している、これらの検査の目的は,機械学習に使用可能な質の高いデータをできるだけ多く集めることである.本研究によって高齢者に発症する二大神経疾患であるパーキンソン病とアルツハイマー病の共通点と相違点を理解し,病初期に起こる脳の変化の手がかりを得たい.将来的には,両疾患の早期発見と早期治療や根治につながる知識を得たいと考えている.
冒頭に述べたとおり,私は,脳は情報を処理する臓器であると考えている.他の臓器をみると,心臓のポンプ機能は物理現象として説明可能であり,肺のガス交換も物理現象や化学現象で理解することができる.それに反して,脳は,我々が知っている物理現象や化学現象では説明できない機能を持っている.脳の機能は捉えどころがなく理解するのが難しいが,そうだからこそ,未知のメカニズムを明らかにすることによって飛躍的に理解が進む可能性を秘めている.一方,BMIやAI・機械学習は,まだ多くの問題点をかかえているが,大変夢のある技術であることを伝えることができたとすれば幸いである.
1991年 3月:京都大学医学部卒業
1991年 6月:京都大学附属病院神経内科研修医
1992年 4月:天理よろづ相談所病院神経内科研修医
1996年 4月:京都大学大学院医学研究科脳統御医科学系大学院博士過程
1999年 4月:同 博士課程を特例早期修了
1999年 :京都大学大学院医学研究科博士研究員
2000年 7月:米国国立保健研究所臨床研究員
2002年10月:京都大学医学研究科附属脳機能総合研究センター助手
2005年11月:国立精神・神経医療研究センター(NCNP)神経研究所疾病研究第七部第一研究室長
2008年10月:科学技術振興機構さきがけ「脳情報の解読と制御」領域研究者併任
2011年 7月:NCNP 脳病態統合イメージングセンター(IBIC) 分子イメージング研究部部長
2013年 6月:同IBIC 先進脳画像研究部長, 神経情報工学研究室長併任
2019年10月:京都大学医学研究科高次脳科学講座脳統合イメージング分野教授
Award2000年 7月:NINDS Intramural Competitive Fellowship Award
2008年 4月:日本神経科学会奨励賞
これは,2021年1月22日天理よろづ相談所学術講演会(座長:天理よろづ相談所病院 脳神経内科 末長敏彦 部長)で,主として非専門家を対象に行われた花川教授の講演を当研究所で編集したものである.