2024 Volume 144 Issue 4 Pages 403-409
2024 Volume 144 Issue 4 Pages 403-409
The moderate restriction of dietary energy intake (dietary restriction: DR) extends the lifespan and health span of various laboratory animals, suggesting that it delays the aging process inherent in many animal species. Attenuated growth hormone and insulin-like growth factor-1 (IGF-1) signaling caused by mutations also increases the lifespan of mice, even those allowed to feed freely. In nematodes, the Daf16, mammalian Forkhead box O (FoxO) transcription factor, was shown to be required for lifespan extension in response to reduced IGF-1 signaling. Because DR also decreases the plasma concentration of IGF-1 in mammals, the IGF-1–FoxO axis may play a central role in the lifespan extension effect of DR and, thus, retardation of aging. Studies using knockout mice under DR conditions revealed the importance of FoxO1 and nuclear factor erythroid-derived 2-like 2 (Nrf2) in tumor suppression, and FoxO3 in lifespan extension. Human genomic studies also identified a strong association between a FOXO3 single nucleotide polymorphism and longevity. The aging mechanism is the most important risk factor for disease and frailty in aging humans. Therefore, further research on the application of DR to humans, the development of compounds and drugs that mimic the effects of DR, and mechanisms underlying FOXO3 polymorphisms for longevity is highly relevant to extending the human health span.
食餌制限(dietary restriction: DR)によるラットの寿命延伸効果が報告されて以来,1)マウスやラットを用いて寿命延伸,疾患抑制効果が複数の研究グループで検証されてきた.2)現在,DRモデルは,老化や関連疾患の制御機構を解明するための標準的なモデルとして用いられている.様々な飼料を用いた研究は,タンパク質や脂質など特定の栄養素の制限ではなく,エネルギー(カロリー)の制限がその効果の本質であることを示してきた.よって,カロリー制限(calorie restriction: CR)と呼ばれることも多い.その寿命延伸効果は,線虫やショウジョウバエからアカゲザルまで確認されたことから,DRは,進化生物学的に共通な老化機構に作用していると予測される.3)よって,DRの老化遅延機構を解明することは,老化の本態を理解するだけではなく,ヒトの老化制御にも応用可能と考えられる.
一方,摂食量を制限しなくても,特定の遺伝子変異によって,野生型に比して,長寿命となる場合がある.4)線虫の長寿命変異種で最初に報告された遺伝子Age-15)は,哺乳類では,インスリンあるいはinsulin-like growth factor-1(IGF-1)シグナル経路にあるPhosphoinositide 3-kinase(PI3K)のサブユニットに相当する.6)引き続く,線虫やマウスを用いた研究は,IGF-1シグナルを抑制する遺伝子変異が,一貫して実験動物の寿命を延伸することを明らかにした.4)マウスやラットでも,DRによって,血中インスリン,IGF-1は低下するので,7)インスリン及びIGF-1系シグナルの制御は,DRの老化遅延機構に関連していると予測された.
本総説では,DRによるほ乳類の老化制御メカニズムについて,IGF-1系シグナルとその下流にあるForkhead box O(FoxO)転写因子の役割を中心として述べる.
哺乳類では,血中IGF-1の3/4は,肝臓で作られる.8)残りは,白色脂肪や筋肉を含む複数の末梢組織において合成され,血中に分泌されるだけではなく,局所においてオートクライン(autocrine)若しくはパラクライン(paracrine)的にも作用する.IGF-1の合成は,その上流にあり,下垂体から分泌される成長ホルモン(growth hormone: GH)によって刺激される.7) GHは更に上流にある視床下部神経細胞から分泌されるGH-releasing hormone(Ghrh)とsomatostatinによって拮抗的に制御されている.
動物では,性成熟後,GH, IGF-1血中濃度は急激に低下する.このアナボリックなホルモンの低下は,筋肉や骨組織の減少,体内脂肪の増加など,高齢期の体組成の変化をもたらし,フレイルの原因となるとも考えられてきた.9)一方,マウスではGH-IGF-1シグナルの減弱による寿命の延長が複数の遺伝子変異モデルを用いて示されてきた.Ghrh及びその受容体(Ghrhr)遺伝子の変異マウス,下垂体の前葉細胞の発達と分化を制御するProp1,Pit-1遺伝子変異マウス,GH受容体/結合タンパク(Ghr)遺伝子のノックアウトマウス,IGF-1受容体(Igf1r)遺伝子のノックアウトヘテロ接合体マウスなどである.7)モデルによっては,寿命延伸効果に性差があるが,これらのモデルは,老化遅延におけるIGF-1シグナルの重要性を示している.
筆者らは,GH遺伝子のアンチセンス遺伝子を過剰発現させることによって,GH-IGF-1系を抑制した矮性ラットを用いて寿命研究を行った.10,11)このWistarラットをバックグラウンドとした過剰発現ラットのヘテロ接合体は,自由摂食環境においても,体重や摂食量が野生型Wistarラットの摂食量を30%カットしたDR群と類似していた.寿命は,野生型ラットのDR群ほど延伸はしなかったが,野生型ad libitum feeding(AL)群に比し,10%程度延伸した.自然発症性腫瘍の抑制効果もあった.血中インスリンやグルコース濃度の低下,ストレス耐性などのDRの特徴もみとめられた.これらの所見は,GH-IGF-1系の抑制がDRの老化遅延メカニズムに関連していることを示唆した.
ヒトでは,マウスと類似した遺伝子変異による小人症,例えばGHR遺伝子変異によるLaron症候群に関する疫学調査がある.12)この集団では,肥満するがインスリン感受性は保たれ,糖尿病や心血管疾患,がんの罹患率が低いことが知られている.長寿者(90歳以上)が確認はされているが,対照群に対して長寿命であるとする統計的データはない.
線虫モデルでは,遺伝子変異種を用いて,DRの寿命延伸効果に必要な遺伝子が探索されてきた.13) DRの方法によって異なるが,aak-2(哺乳類では,AMP-activated protein kinase: AMPK),Daf-16/FoxO,Sir-2.1/Sirtuinなどの遺伝子変異によって寿命延伸効果が消失あるいは減弱する.つまり,線虫のDRによる寿命延伸,よって老化制御には,これらの遺伝子が必要であることが理解される.
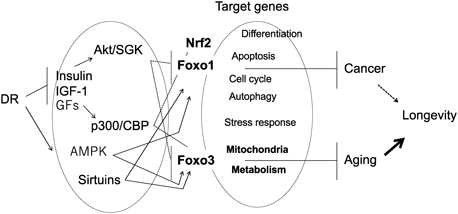
線虫では,Daf-2(哺乳類のIGF-1受容体)遺伝子の変異によって寿命が延伸する際,Daf-16が必要であることが報告されていた.14)つまり,線虫では,Daf-2-Age-1シグナルがDaf-16を抑制的に制御している.哺乳類のFoxO転写因子は,インスリン及びIGF-1シグナルなどの成長因子の下流にあるprotein kinase B/thymoma viral proto-oncogene(PKB/Akt)によってリン酸化され核外へ移行し,分解される.15) IGF-1シグナルが減弱した状態では,FoxO転写因子は,酸化ストレスなどに応答して,細胞回転やDNA修復,アポトーシス,オートファジーなどに関連する遺伝子の発現を制御する.15)さらに,代謝やミトコンドリア機能に関連する遺伝子も制御している.Sirtuinによる脱アセチル化もFoxO転写因子の活性化に重要である.16) DRは,マウスのGH-IGF-1系シグナルを減弱させることが知られていたので,DRの老化遅延にFoxOが深く関与していることが予測された.
筆者らは,この仮説を検証するために,Foxo1, Foxo3遺伝子半欠失(+/−)マウスを用いた寿命研究を行った.17,18)複数の組織において,それぞれのタンパク質あるいはmRNAレベルは,野生型に比して50%程度まで減少していることを確認した.
Foxo1+/−, Foxo3+/−マウスを用いた寿命研究の結果は,対照的であった.Foxo1+/−マウスでは,30%DRによって,野生型マウスと同じ程度の寿命が延伸した.17)しかし,死亡時の病理学的検索では,野生型マウスでよく知られているDRによる悪性腫瘍抑制効果が,Foxo1+/−マウスでは有意に減弱した.一方,Foxo3+/−マウスでは,DRによる寿命延伸効果が消失したが,腫瘍抑制効果は保持されていた.18)
FoxO1はストレス耐性に関連する遺伝子発現を制御している.15)筆者らは,Foxo1+/−マウスに3-nitropropionic acid(呼吸鎖複合体IIの阻害剤)による酸化ストレスを与えた後,肝臓,海馬における遺伝子発現を検索した.17)野生型マウスでは,予測通り,cyclin dependent kinase inhibitor 1A(p21),growth arrest and DNA-damage-inducible 45 alpha(Gadd45a),BCL2 like 11(Bim)などの細胞回転の停止やDNA修復,アポトーシスに関連するmRNA発現レベルがDR群において上昇していた.このDRの効果は,Foxo1+/−マウスで減弱した.よって,DRは,酸化ストレスやDNA損傷応答に対して,FoxO1を介した制御を通して,腫瘍抑制効果を誘導していると推測された.他研究グループからNrf2欠失マウスを用いて,DRは寿命を延伸するが,腫瘍抑制効果は減弱することが報告されている.19)この研究では,皮膚の二段階発がんモデルを用いて,腫瘍抑制効果を評価している.筆者らも,全く同じ発がん実験をFoxo1+/−を用いて行ってみた.結果は,Nrf2欠失マウスと同じく,DRの腫瘍抑制効果が減弱していた.20) Foxo1+/−マウスにおいて,発がんのプロモーターである12-O-teradecanoyl phorbol 13-acetateを皮膚に塗布した後,組織をサンプリングし,Nrf2の標的遺伝子の発現を検索した.Nrf2の標的としてよく調べられているglutamate-cysteine ligase, and catalytic subunit(Gclc)-やheme oxygenase(decycling)1(Hmox-1)-mRNAの発現レベルが,野生型マウスDRグループでは,ALに比べて有意に上昇したが,Foxo1+/−マウスでは,そのDRの効果が消失した.よって,DRの腫瘍抑制効果には,FoxO1とNrf2の両方が必要であることが理解される.線虫では,酸化ストレスに対するhormesis効果にDaf-16/FoxO, Skn-1/Nrf2が重要な転写因子であること,21)更に,DRによる寿命延伸効果にもDaf-16/FoxO, Skn-1/Nrf2それぞれが必要であることが示されている.13)哺乳類では,FoxO1, Nrf2が減弱あるいは消失しても,他のメカニズムがDRの寿命延伸効果を補完するのであろう.
以上の結果は,マウスにおけるDRの腫瘍抑制効果と寿命延伸効果にFoxO転写因子アイソフォーム特異性があることを示唆している(Fig. 1).Daf-2変異による線虫の寿命延伸にも複数のDaf-16のアイソフォームの内,特定のアイソフォームが主要な役割を果たしていることが報告されている.22,23)ヒトの長寿と遺伝子多型の研究でも,FOXO3遺伝子多型と長寿の関係が複数の人種で指摘されている.24,25) FOXO1遺伝子多型と長寿との関係は中国の漢民族に限られているので,25) FoxO3が哺乳類の老化や寿命の制御に重要な役割を果たしていると考えられる.
I.S. modified the figure based on the supplemental Fig. S7 published in Shimokawa I., et al., 14, Aging Cell, 2015.18)
自由摂食環境ALで行われた初期の研究では,FoxO転写因子の個別な役割は明確ではない.Foxo1, 3, 4遺伝子の単独での欠失あるいはダブルノックアウトは,腫瘍の発生や寿命の短縮をもたらさなかった.26) Foxo1, 3, 4のトリプルノックアウトマウスでのみ,悪性リンパ腫や血管系腫瘍が好発し,寿命が有意に短縮した.この研究では,FoxO転写因子のアイソフォームには補完作用があると結論している.筆者らの研究は,FoxO1, FoxO3の特異的な役割が,DR環境によってのみ表面化することを明らかにした.このように栄養環境と遺伝子の機能には相互作用がある.
ヒトのFOXO3遺伝子多型と長寿の遺伝学的研究の対象者は,恐らくDRを行っていた訳ではない.しかしながら,ヨーロッパ人を祖先とする人々を対照とした遺伝学的研究では,FOXO3の長寿遺伝子多型を持つ人は,血中IGF-1濃度が低い.27) FOXO3遺伝子多型と血中IGF-1制御機構は更に研究する必要がある.しかしながら,DRに必要な遺伝子とヒトの長寿との関係が存在することは,今後のヒトの老化制御研究に重要な視点と考えられる.
老化や寿命の制御とエネルギー代謝,ミトコンドリアの機能には密接な関連性がある.DRマウスは,給餌後6時間ほどで1日分の餌を食べ尽くし,次の給餌まで18時間は,餌のない状態に置かれる.給餌後6時間では,炭水化物を主なエネルギー源としつつ,脂肪やタンパク質の合成を行う.28)その後,6時間は,炭水化物から脂肪酸へとエネルギー源を移行させる.次の給餌までの12時間は,脂肪酸と筋肉のアミノ酸がエネルギー源となる.つまり,ミトコンドリアにおけるβ酸化やアミノ酸から代謝産物がtricarboxylic acid(TCA)回路や糖新生経路へと流入する.29)
代謝ケージを用いて,マウスの酸素消費量,二酸化炭素排出量を計測し,呼吸商(respiratory quotient: RQ)を算出すると,AL群では,炭水化物を主なエネルギー源とするので,RQは0.8–1.0の間を緩やかに変動する.DRマウスでは,エネルギー源の変化により,摂食後6時間は,呼吸商は1.0を超えるが,その後,徐々に低下し,12時間後には,0.8付近で一定となる.30)
DR群におけるエネルギー代謝の変化は,ミトコンドリアの呼吸とreactive oxygen species(ROS)産生,Redox制御に密接に関連している.筆者らが行ったラットにおける摂食量をコントロールした隔日給餌では,ミトコンドリアにおけるROSの発生は,給餌後,低下し,絶食時に増加した.31)つまり,グルコースを主なエネルギー源とし,解糖系やペントースリン酸経路が活動しているときには,ROSが低値であるが,絶食時,脂肪酸酸化やアミノ酸代謝からTCA回路へ中間代謝産物が供給される場合,ROSのレベルが高くなった.ただ,AL群よりも高くはならなかった.これに呼応するように,oxidized glutathione(GSSG)が高くなるために,gultathione(GSH) : GSSG比は絶食時に低下した.ミトコンドリアの抗酸化酵素であるsuperoxide dismutase 2(Sod2)や細胞質のSod1,catalase(Cat),GSH peroxidase(Gpx),glutathione S-transferase(Gst)活性は,DRの絶食期で低下する傾向を示した.31)
このように,DR群のミトコンドリアでは,ROSのレベルとRedox状態が摂食状況によって変動しているが,摂食サイクルの中では,AL群よりも上昇することはないと推測された.31)
ROSの過剰な増加は,細胞死や組織の機能障害を引き起こすが,適度な上昇と変動は,酸化ストレスに対する防御能を増強するかも知れない.この仮説は,preconditioning, hormesisあるいはmitohormesisという概念に一致している.32)
Sod2遺伝子半欠失マウスでは,superoxideの産生が増加し,結果としてDNA傷害が上昇し,腫瘍性疾患が増加する.33)しかしながら,寿命は短縮しない.この寿命研究の結果は,老化による死亡を含む非腫瘍性原因,つまり老化を含む原因による死亡率の低下がSod2+/−マウスで起きていることを示唆している.一方,Sod2遺伝子の過剰発現マウスの寿命は延伸しない.34) Ubiquinoneの生合成に必要なhydroxylaseをコードするdemethyl-Q 7(Coq7若しくはclk-1)遺伝子の半欠失マウスは,野生型マウスよりも長生きする.35)この変異マウスでは,ミトコンドリア由来の酸化ストレスが増加するが,細胞質のタンパク質の酸化傷害は減少する.これは,ミトコンドリア由来のROSが抗酸化ストレス機構を誘導した結果であると解釈できる.
DRラットミトコンドリアにおけるROSの一定範囲の変動や,Sod2+/−マウス,Coq7/clk-1+/−マウスモデルの結果は,老化制御におけるミトコンドリアのROS発生によるmitohormesis仮説を支持している.
DRはミトコンドリアのbiogenesisを上昇させることが報告されている.36,37)例えば,ミトコンドリアのbiogenesis,呼吸,糖新生を制御するperoxisome proliferative activated receptor, gamma, coactivator 1 alpha(Ppargc1a若しくはPgc1a)はAL群に比べ発現が有意に上昇する.ミトコンドリアのサイズもALに比べ増加する.ラット肝臓のミトコンドリアのプロテオーム解析では,加齢若しくはDRによって,複数のミトコンドリアタンパク質が有意に変動していることが示された.38)筆者らは,呼吸鎖複合体IV(Complex IV)のassembly factorであるcytochrome c oxidase, subunit 6B1(Cox6b1)に着目した.Cox6b1はDR及び加齢によって,20%程度タンパク量が増加していた.38) Cox6b1は,Complex IVの二量体の形成に関与している.39,40)ヒト新生児の重篤な脳筋症において,COX6B1遺伝子に変異が報告されている.41)これらの結果は,Cox6b1がComplex IVの機能制御に重要な役割を果たしていることを示唆している.
近年,呼吸鎖複合体は,単独でミトコンドリア内膜に存在しているだけではなく,I, III, IVがスーパー複合体を形成していることが示されている.例えば1個の複合体I,2個の複合体IIIと1, 2若しくは4個の複合体IVからなるスーパー複合体(supercomplexes: SCs)である(I1III2IVn).42)このSCsの形成は,呼吸鎖活性の制御,電子伝達とATP産生の効率化,ROSの産生の抑制,各呼吸鎖複合体の構築や安定化,ミトコンドリア内膜内のタンパク質の凝集の抑制などに寄与することが報告されてきた.43)筆者らは,SCsの形成がDRによって促進していることを生後12ヵ月マウスから分離されたミトコンドリアをblue-native(BN)ゲル電気泳動法を用いて確認した.44)
Cox6b1はComplex IVの二量体の形成を促進するので,39,40)呼吸鎖のスーパー複合体形成に関与していると推測された.筆者らは,Cox6b1遺伝子を培養細胞系で過剰発現させると呼吸鎖SCsの形成が促進していることを確認した.このときに,呼吸機能(酸素消費量)を計測すると,Cox6b1過剰発現細胞では,酸素消費量が増加し,Complex IVの活性が上昇し,ATP量も有意に増加していることが示された.同時にROSのレベルが上昇した.ところが,Cox6b1過剰発現細胞では,過酸化水素投与による酸化ストレスに対して,耐性を示した.つまり,酸化ストレス後の細胞の生存率が高かった.Cox6b1のノックダウンは,呼吸機能の低下,Complex IVの活性低下など,逆の結果を示した.この結果は,Cox6b1の発現上昇が,SCsの形成を促進し,呼吸機能を上昇させるとともに,細胞の酸化ストレス耐性を増強していることを示唆した.
引き続く研究は,Cox6b1遺伝子過剰発現細胞では,tBHQによる酸化ストレスに対して,Nrf2が核内に移行し,Hmox-1, Gclcなど抗酸化ストレス機能に関連する標的遺伝子の発現を上昇させることを示した.44)
適度な虚血がその後に起こる心筋梗塞巣のサイズを縮小し,心機能の回復を促進することが知られている.マウスを用いた心臓の虚血preconditioningモデルでは,Cox6b1の発現が上昇し,SCsの形成が促進する.45) SCsの形成は検討されていないが,ラット心筋にCox6b1を過剰発現させたin vitro虚血・再還流モデルでも,Cox6b1による心筋の保護作用,例えば,アポトーシスの抑制やミトコンドリア膜電位の維持が報告されている.46)ラット海馬から調整された神経細胞にCoxo6b1を過剰発現させたin vitro虚血・再還流モデルにおいても,細胞室内のCa2+濃度の上昇を抑え,アポトーシスを抑制し,神経細胞の生存率を上昇させることが報告された.47)
これらのCox6b1過剰発現モデルやin vivoにおける観察は,DRがCox6b1によるComplex IVの二あるいは四量体化と呼吸鎖SCsの形成を促進し,呼吸機能を上昇させ,同時に,酸化ストレス耐性を増強していることを示唆している.この所見は,DRのmitohormesis仮説を支持している.
FoxO3, FoxO1のミトコンドリア呼吸機能への影響を調べるために,筆者らは,最初に,Hepa1-6マウス肝細胞がん細胞,SV40不死化肝細胞を用いてin vitroの実験を行った.それぞれの遺伝子のノックダウン細胞を調整し,Flux analyzerを用いてミトコンドリアの呼吸機能を検討した.Foxo3遺伝子のノックダウンは,Hepa1-6, SV40-hepatocyteいずれでも呼吸機能が低下した.Foxo1遺伝子ノックダウンはHepa1-6の呼吸機能を低下させたが,SV40-hepatocyteには影響はなかった.このように培養細胞系によって異なるが,FoxO3はミトコンドリアの呼吸機能を制御していることが示唆された(Komatsu T., et al.未発表データ).
次に,野生型及びFoxo3+/−マウスの肝臓組織から分離したミトコンドリアを用いて,DRのよるSCsの形成を含むミトコンドリアのbioenergetics制御におけるFoxO3の役割について検討した.結果は,FoxO3がDRによるミトコンドリアSCsの形成に必要であることが示唆された(Komatsu T., et al.未発表データ).これに並行して,ミトコンドリア由来の酸化ストレスに対する耐性にもFoxO3が関与していることが示された.特に,DRは呼吸機能を上昇させるが,ミトコンドリア膜電位の過剰な上昇を抑制した.膜電位は閾値を超えると活性酸素が発生することが知られているので,48)この制御機構は,DRの老化遅延メカニズムとして重要であると推測される.FoxO3のノックダウンは,この制御機構を減弱させた.これらの結果は,DRによるミトコンドリアの機能制御にFoxO3が重要な役割を果たしていることを示唆している.
DRモデルを用いた研究によって,IGF-1系シグナルとその下流にあるFoxO転写因子及びNrf2の腫瘍抑制や老化制御における重要性が明らかとなった.様々な実験動物を用いた老化研究は,動物にはDRに反応する進化生物学的に共通の老化機構があることを示してきた.この老化機構は,高齢期のヒトの疾患やフレイルの最も大きいリスクファクターと考えられるので,DRのヒトへの応用,DRの効果を模倣する化合物や薬剤の開発研究,ヒトにおけるFOXO3の遺伝子多型と長寿の研究が更に進めば,少なくともヒトの健康寿命は更に延伸されることが期待できる.
本研究は日本学術振興会科学研究費JP15H04682, JP19H04033の助成を受けた.本研究に係わった長崎大学医学部・大学院医歯薬学総合研究科・病理学第一教室のスタッフに深謝する.
開示すべき利益相反はない.
本総説は,日本薬学会第143年会シンポジウムS24で発表した内容を中心に記述したものである.