2024 年 64 巻 1 号 p. 25-27
2024 年 64 巻 1 号 p. 25-27
腸内シュウ酸分解菌は,私たちが摂取したシュウ酸を吸収し,代謝分解してギ酸として排出することで,宿主の尿路結石症発症リスクを低減する.この過程の鍵を握るのが,分解菌細胞膜に存在するシュウ酸/ギ酸対向輸送体OxlTである.本稿では,筆者らが解析したOxlTの構造と構造動態から,その分子メカニズムを概説する.
私たちは,腸内に生息している数千種から数万種とも言われる腸内細菌とともに生きている.私たちの健康も,腸内細菌叢により影響を受けている.その1つの例が,シュウ酸代謝と腸内シュウ酸分解菌との関わりである.シュウ酸は,ホウレンソウなどの葉菜類・お茶・ナッツ類などに含まれ,日々の食事を通して私たちの体内に摂取される.このシュウ酸は,消化管あるいは腎臓・尿路系を介して体外に排出されるが,過剰なシュウ酸は,カルシウムイオンと不溶性の塩を形成し,三大激痛の1つとも呼ばれる尿路結石症を引き起こす原因となる.腸内に生息するシュウ酸分解菌Oxalobacter formigenesは,シュウ酸を唯一の炭素源として菌体内に吸収し,代謝分解産物であるギ酸の形で菌体外に排出する.その結果,私たち宿主の腎臓・尿路系側に排出されるシュウ酸量を下げることで,尿路結石症発症リスクの軽減に貢献している1).
この一連の過程において,O. formigenes菌体内へのシュウ酸取り込みと菌体外へのギ酸排出を担うのが,細胞膜に存在するシュウ酸/ギ酸対向輸送体OxlTである2).OxlTによるシュウ酸やギ酸の輸送自体は,他のイオンの電気化学勾配を必要としないが,この間のシュウ酸代謝分解の過程で細胞質側のプロトンを消費し,結果として細胞内外のプロトンの電気化学勾配が形成されることから,OxlTをO. formigenesにおける「仮想プロトンポンプ」と見る向きもある.このように,O. formigenesの生命維持にも私たちのシュウ酸代謝にも重要なOxlTの輸送機能のメカニズムは,これまでOxlTの構造情報が低分解能(6.5 Å)のものにとどまっていた3)こともあり,未解決であった.本稿では,筆者らが最近行ったOxlTの構造研究と,そこからわかった分子メカニズム4)について概説する.
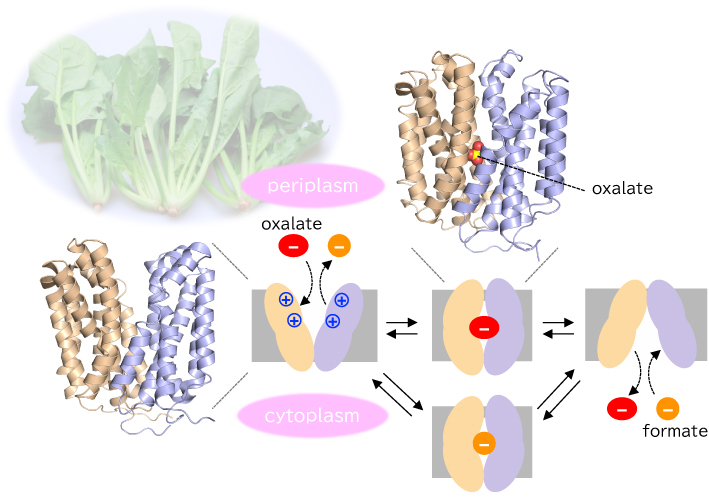
OxlTは,二次輸送体最大のファミリーで,多くのタンパク質構造の報告があるMajor facilitator superfamily(MFS)5)に分類される.実際,約20年前に報告されたOxlTの低分解能電顕構造3)は,N端ドメインとC端ドメインそれぞれ6本ずつ計12本の膜貫通ヘリックスから成るMFSの共通構造を示した,初期のMFS構造研究例の1つでもある.一方OxlTは,MFSの中ではoxalate/formate antiporter(OFA)サブファミリーに属するが,このOFAについては,現時点でも,OxlTを除き構造はもちろん機能研究の報告もない.筆者らは,異なる2種類の構造認識抗体断片を用いて複合体として結晶化することで,OxlTが輸送の過程でとる2種類の異なるコンフォメーションの結晶構造を決定することに成功した4)(図1A, B).

OxlTの結晶構造4).(A)シュウ酸結合状態閉じ構造.(B)基質非結合状態外開き構造.(C)シュウ酸結合部位の拡大図.(D)輸送経路表面と静電ポテンシャル.
明らかになった構造の1つは,OxlTが分子中央部にシュウ酸を結合した状態の構造である(図1A).一般的に輸送体では,輸送経路を細胞外に開き基質を分子内に取り込む「外開き構造」(Outward-facing),基質を結合し輸送経路を閉じた「閉じ構造」(Occluded),輸送経路を細胞内に開き基質を細胞内に解離する「内開き構造」(Inward-facing)をとることで,膜を介した基質輸送を行うとする「交互アクセスモデル」が提唱されている6).今回明らかになったシュウ酸結合状態の構造は,結合部位から細胞内外への輸送経路を完全に閉じた「閉じ構造」をとっていることがわかった.OxlTは構成アミノ酸の約1/8をグリシンが占めており,N端ドメインとC端ドメイン全体の動きに加え,膜貫通ヘリックス中にあり,かつ分子全体にわたって存在するグリシンを起点に柔軟にたわむことで,経路を閉じていることがわかった.
OxlTが基質とするシュウ酸は,炭素2原子を持つ最小のジカルボン酸である.このシュウ酸認識には,Arg272,Lys355といった,OxlTの塩基性残基が重要であることが報告されていた.今回の構造から,これらの塩基性残基に加え,Gln34やAsn268などの電荷を持たないアミノ酸や,Tyr35,Trp324などの芳香族アミノ酸も結合に関わることが明らかになり,OxlTは,静電相互作用だけでなくシュウ酸のπ電子系を利用したπ-π相互作用による分子認識を行っていることがわかった(図1C).一方,これらの残基で形成される基質結合ポケットは,シュウ酸が結合するのに適したサイズとなっており,同じジカルボン酸でも,例えば炭素4原子から成るオキサロ酢酸やコハク酸などは,大きすぎて結合できないことがわかった.これらのC4ジカルボン酸は,クエン酸回路の中間代謝産物でもあり,私たち動物は腸管内にこれらの物質を吸収する輸送体を備え,エネルギー源として利用している.腸内共生細菌O. formigenesに存在するOxlTは,宿主動物のエネルギー需要との競合を避けるよう,巧妙に設計されたシュウ酸特異的結合部位を備えていることが,構造から見てとれる.
明らかになったもう1つの構造は,シュウ酸を結合しておらず,輸送経路をペリプラズム側(細胞外側)に開いた「外開き構造」である(図1B).この構造では,上述したArg272とLys355が存在する基質結合部位に加え,輸送経路全体にわたって正に荷電した表面を露出しており(図1D),酸性化合物であるシュウ酸が結合しない限り,電荷反発で輸送経路が閉じない仕組みとなっていた.この「基質が結合しなければ,決して輸送経路を閉じない」性質は,対向輸送体として機能するために重要な性質と考えられている7).なぜなら,細胞外から細胞内・細胞内から細胞外,いずれの方向への輸送にも,必ず輸送基質を積んで状態変換する必然性が生じるからである.OxlTの基質結合部位と輸送経路の構造は,O. formigenesによるシュウ酸代謝の出発産物シュウ酸の取り込みと最終産物ギ酸の排出を確実に共役させる仕組みが現れている.興味深いことに,シュウ酸同様π電子系を有する酸性化合物である硝酸と亜硝酸の対向輸送体NarKでも,OxlT同様,塩基性残基と芳香族残基を組み合わせた分子認識と,硝酸や亜硝酸が結合しない限り電荷反発で閉じない輸送経路構造が報告されている8).OxlTとNarKは,輸送体サブファミリーは異なるものの,同じ機能の文脈において同様の構造戦略を選択したものと考えられる.
では,OxlTは,その輸送の過程で,これらの構造間をどのような仕組みで移行するのだろうか? 筆者らは,構造解析によって得られたOxlTの構造をもとにして,全原子分子動力学(MD)シミュレーションにより,その構造変化機構を調べた.
OxlTの閉じ構造を初期構造とするシミュレーションを行い,水分子密度を解析すると,基質結合ポケットの上下に水分子及び基質分子の流入を制御するゲートが存在することがわかった.細胞外側ゲートは,Thr38-Val240間の水素結合及びその周辺の疎水的な構造から成っている(図2A左).細胞内側ゲートは,Met128,Pro332,Tyr348から成る疎水的な構造から成っている(図2A右).同様の疎水性ゲートは,NarK8)でも見られ,これらの輸送体に共通する機構であることがわかった.

MDシミュレーションにより明らかになった,(A)疎水性ゲート,(B)閉じ構造から外開き構造への構造変化機構,(C)探索された構造空間4).
さらに,マイクロ秒スケールのシミュレーションにおいて,OxlTが閉じ構造から外開き構造に構造変化する様子が見られた.全体的な構造変化に先立ち,シュウ酸結合サイトにあるGln34側鎖のフリップと上述のThr38-Val240水素結合の解離という局所的な変化が起こり,その数百ナノ秒後に細胞外側ゲートが開き外開き構造への構造変化が起こっていた(図2B).このような局所的な変化は,シュウ酸の代わりにギ酸を結合させたOxlTにおける構造変化の際にも同様に見られ,構造変化が起こらなかった他のトラジェクトリでは見られなかった.従って,Gln34側鎖とThr38-Val240水素結合は,細胞外側ゲートの「留め金」であると考えられる.実際に,Gln34やThr38は進化的に保存されており,Q34A変異体の輸送活性は野生型と比べて低くなることも実験的に確かめられた.
最後に,MDシミュレーションによって探索された構造を,内外それぞれのゲート距離を軸にとって二次元にプロットした(図2C).すると,OxlT閉じ構造から外開き構造にかけて広く探索できている一方で,内開き構造は全く探索できていないことがわかった.細胞内側ゲートを開かせるような外力をかけたシミュレーションなどによる内開き構造の探索が今後の課題である.
OxlTは,Johns Hopkins大・Peter C. Maloney博士を中心に,90年代より輸送体研究のモデル分子の1つとして,その機能が精力的に研究されてきた分子である.一方,10年前にMaloney博士が逝去して以降,OxlTに関する新たな研究報告は,ほとんど見られない状況にあった.今回,OxlTの立体構造をもとに,計算化学的解析や機能解析もふまえて調べてみると,あらためて気づかされる点も多く,OxlTの構造と機能を探る研究は,先人の肩の上で,今また新たな端緒につくことができたのではないかと感じる.なお,誌面の都合上,本稿では機能解析の詳細は省いたが,本研究では,自前で構築したシュウ酸定量法を用いたプロテオリポソーム取り込みアッセイ,共同研究者とともに新たに開発した大腸菌生菌利用取り込みアッセイ9),近年報告されたGFPサーマルシフトアッセイ10)など,様々な方法論を駆使して行っており,興味のある読者は原論文をご照会いただけると幸いである.
本稿で紹介した研究は,理化学研究所(現科学技術振興機構)・平井照久博士,京都大学・島村達郎博士をはじめ,数多くの共同研究者のご協力により実施しました.この場を借りて心より感謝いたします.