2024 年 64 巻 1 号 p. 32-34
2024 年 64 巻 1 号 p. 32-34
動物オプシンは,三量体Gタンパク質を介するシグナル伝達経路を光で操作するツールとして活用されている.しかし,三量体Gタンパク質が複数のシグナル経路を駆動するために,何を光操作しているのか不明確になる難点があった.この難点を(部分的に)克服できる結果を得られたので,本トピックスで紹介する.
緑藻類から見出された光駆動型陽イオンチャネルのチャネルロドプシンを神経細胞に発現させて,光刺激によって神経興奮を操作する研究1)が報告されて以来,光遺伝学は神経科学分野における基盤研究技術となるまで発展している.また,チャネルロドプシン類を用いずに,細胞内シグナル伝達経路を光で操作するツールを利用した光遺伝学解析も行われている.動物の視覚などの光受容機能を担うオプシンは,光感受性Gタンパク質共役受容体(GPCR)として機能するため,神経伝達やホルモン受容など重要な生理機能に関わる三量体Gタンパク質を介したシグナル伝達経路を光操作するツールとして利用されている2),3).しかし,GPCRによって活性化された三量体Gタンパク質はαサブユニット(Gα)とβγサブユニット(Gβγ)が解離して,それぞれが別々のシグナル伝達経路を駆動する(一例を図1に示す).また,GPCRによってアレスチンも活性化されてシグナル伝達する.そのため,動物オプシンを光操作ツールとして用いると,光によって複雑な細胞応答が生じて,具体的にどの応答を操作しているのか不明確になる難点がある.
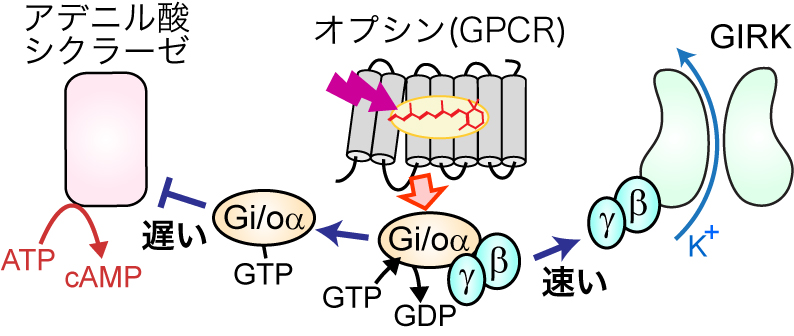
オプシン(GPCR)がGi/oを活性化すると駆動される,主要なシグナル伝達経路.この図は,文献4から改変したものである.
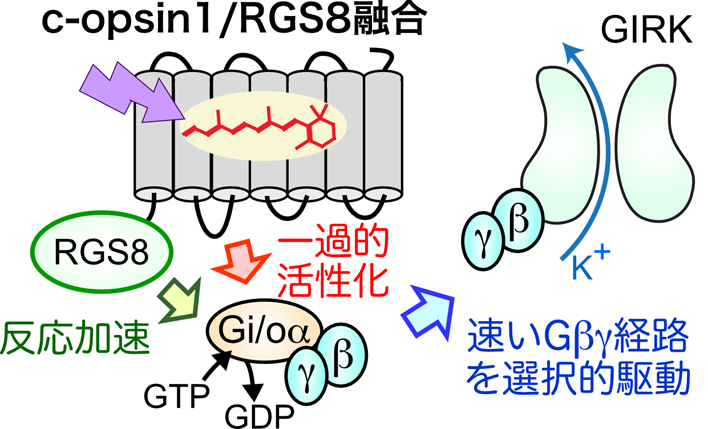
動物オプシンを用いた最も一般的な光遺伝学解析は,Gi/oタイプのGタンパク質と共役するオプシンを抑制性ツールとして用いるものである3).この場合,光によって駆動される主要な細胞応答は,Gi/oαがアデニル酸シクラーゼを抑制することで生じる細胞内cAMPレベルの低下と,GβγがGIRKチャネルを活性化することによるK+電流の増加(過分極)となる(図1).どちらも抑制性の応答であることでは共通しているが,両者の応答を「切り分ける」つまりどちらかの応答のみを操作することが望ましい.しかし,GPCRの作用によって解離した同数のGαとGβγがシグナル伝達経路を駆動することを考えると,どちらかの経路だけを操作することは不可能のように思える.しかし,筆者らは最近,この問題を克服する手法を提案した.本トピックス記事では,Gα経路とGβγ経路のキネティクスの違いを利用して,速いGβγ経路を選択的に駆動する,無脊椎動物オプシンをベースにした新規光操作ツールを開発した研究4)を中心に紹介する.
Gi/o経路を光で操作する用途にはこれまで,ヒトなどの脊椎動物の視細胞ではたらくオプシン(視物質と呼ばれる)が用いられてきた.しかし最近,より優れた光操作ツールとして,無脊椎動物由来のオプシンが注目されている.動物オプシンは,11シス型のレチナール(ビタミンAの誘導体)を発色団として結合して,光受容に伴いレチナールが全トランス型に異性化すると構造変化してGタンパク質を活性化する活性状態を生じる(図2).このメカニズムはオプシン共通であるが,活性状態の生化学的性質は脊椎動物の視物質と無脊椎動物由来のオプシンでは異なる.
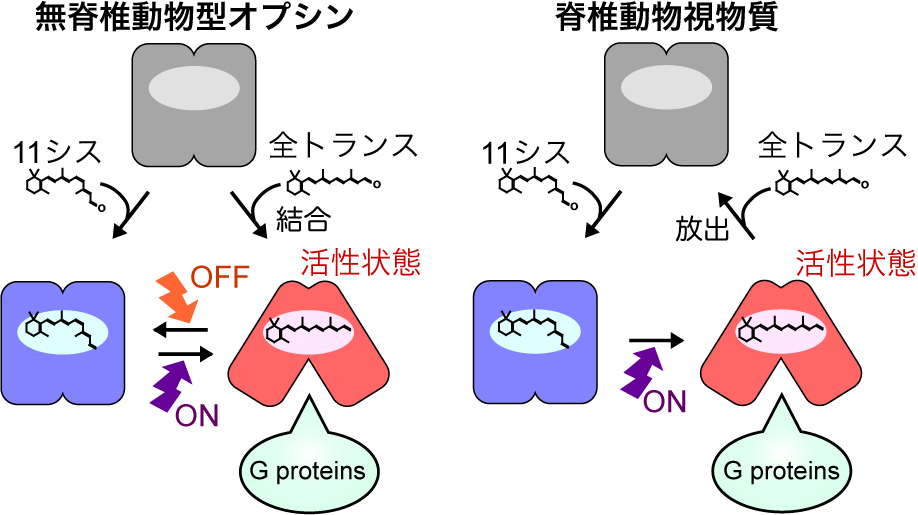
無脊椎動物型オプシンと脊椎動物視物質の活性化・不活性化スキーム.両者を比較すると,活性状態の性質が大きく異なることがわかる.この図は,文献2から改変したものである.
脊椎動物の視物質の場合,活性状態が再び光を受容しても(11シス型を結合した)不活性状態には戻らず,活性状態は自発的に全トランス型レチナールを放出して不活性化する.一方,無脊椎動物のオプシン(の一部)では,活性状態はレチナールを安定的に結合し続けるため,活性状態が維持される.この活性状態が再び光を受容すると,レチナールが11シス型に(再)異性化して不活性化する(図2)2).
すなわち,無脊椎動物由来のオプシンは光刺激によってオン反応だけでなくオフ反応も起こすことができ,光刺激を止めても持続的に細胞応答を引き起こすことができる光操作ツールとなる.このような光反応を起こすオプシンの代表例としてヤツメウナギ由来のパラピノプシン(LamPP)がある5).ヤツメウナギは脊椎動物であるが,LamPPの光応答は無脊椎動物由来のオプシンに類似しており,紫外光を受容すると持続的にGタンパク質を活性化する.このようなオプシンを総称して無脊椎動物「型」オプシンと呼ぶ.
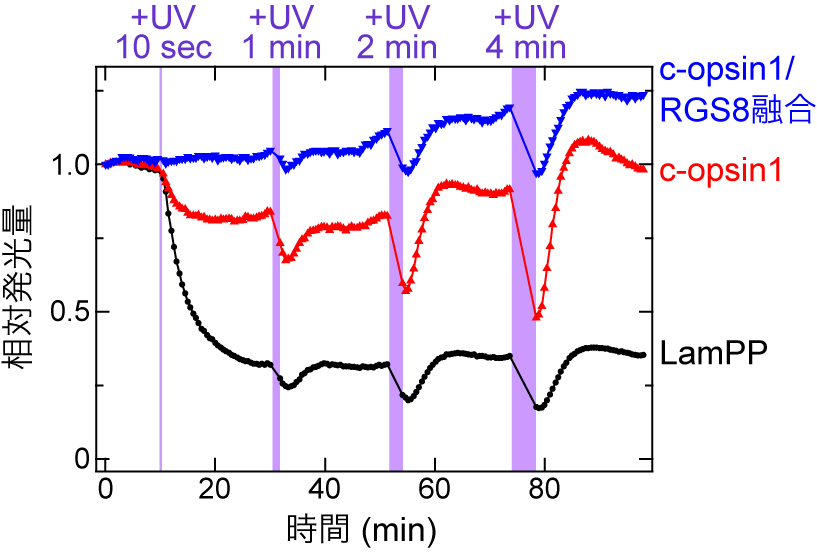
環形動物のゴカイ(Platynereis dumerilii)が持つオプシンc-opsin1は,初めて無脊椎動物から見出されたGi/o共役型オプシンである6).筆者らは,c-opsin1は紫外光を受容するとGi/oを活性化する活性状態を生じ,可視光を受容すると不活性化状態に戻るという,無脊椎動物型オプシンに典型的な光反応をすることを報告していた7).しかし,このオプシンは,紫外光刺激を止めただけで,自発的に(全トランス型レチナールを結合したまま)不活性化することを,Gβγによって活性化されるGIRKの電流応答の解析から見出した(図3).つまりc-opsin1は紫外光刺激に伴い,一過性のGi/o活性化を起こす.
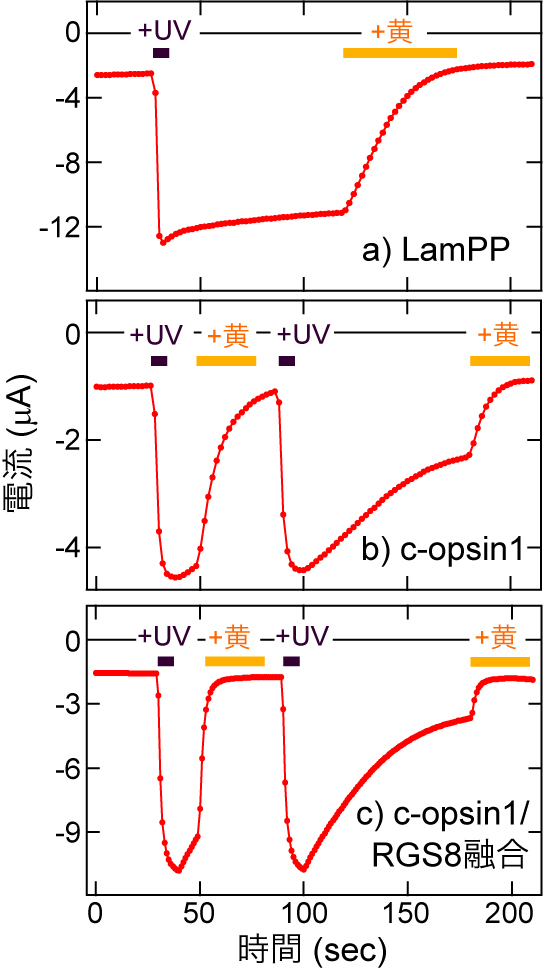
LamPP(a),c-opsin1単体(b),c-opsin1/RGS8融合タンパク質(c)によるGIRKの活性化・不活性化.GIRKを透過するカリウム電流量をプロットした.紫外光(UV)あるいは黄色光で刺激した時間も示している.この図は,文献4から改変したものである.
Gi/oと共役するGPCRが駆動するシグナル経路の中で,Gi/oαによるアデニル酸シクラーゼ(酵素)の抑制(数十秒〜数分)よりも,GβγによるGIRK(イオンチャネル)の活性化(数百ミリ秒〜数秒)は2桁程度速い最速の応答だと考えられている8).このことを考慮すると,一過的にGタンパク質を活性化するc-opsin1は,速いキネティクスのGβγ経路を選択的に駆動すると予想された.実際に,c-opsin1を発現させた哺乳類培養細胞において,細胞内cAMP濃度の紫外光刺激に伴う変化を解析したところ,光依存的なcAMP応答が,持続的なGi/oの活性化を起こすLamPPよりも小さいことが確認できた(図4).この結果は,光受容に伴い一過性のGタンパク質活性化を起こすオプシンを用いると,速いGβγ経路を選択的に駆動すなわちGβγバイアスシグナルが生じることを示している.
LamPP(黒),c-opsin1単体(赤),c-opsin1/RGS8融合タンパク質(青)による,紫外光(UV)依存的なcAMP応答.細胞内cAMP濃度を,ルシフェラーゼ由来の発光cAMPセンサーを用いて測定した.紫外光で刺激した時間も示している.この図は,文献4から改変したものである.
光受容後,ごく短時間だけGタンパク質を活性化するオプシンとしては脊椎動物の錐体視細胞で機能する視物質がある.そこで錐体視物質もc-opsin1と同様にGβγバイアスのシグナル伝達活性を示すかを調べた.データは割愛するが(文献4のFig.4をご参照下さい),錐体視物質もc-opsin1と同様にGβγ経路を選択的に駆動できた.しかし無脊椎動物型オプシンであるc-opsin1は錐体視物質と異なり,様々なレチナール異性体型を非選択的に結合できる.そのため,c-opsin1はカエル卵母細胞に内在する微量のレチナールで充分な光電流を生じるが,錐体視物質はレチナールを添加しないと光電流が生じない.つまり,Gβγバイアスシグナルをレチナール希薄条件下で光駆動するにはc-opsin1が必要となる.このような,レチナール枯渇環境での機能性は,(11シス型より安定な)13シス型のレチナールを結合できるハマダラカのオプシンでも報告されている5).
c-opsin1はGβγバイアス特性を示すことはわかったが,図4に示すようにGi/oα由来のcAMP応答も小さいながらも生じる.この「残存」Gi/oαシグナルを最小化して,さらにGβγバイアス特性を強めることに取り組んだ.具体的には,一過性のGi/oの活性化を起こすことでGβγバイアス特性が生じることに基づき,Gタンパク質の不活性化キネティクスを「加速」すれば,よりGβγバイアス性を高められると考えた.そこで,Gタンパク質の不活性化反応すなわちGαによるGTP加水分解反応を促進する調節タンパク質RGS8をc-opsin1のC末端に融合させたタンパク質を作製し,そのシグナル伝達特性を調べた.
期待通り,c-opsin1/RGS8融合タンパク質は可視光による不活性化と光に依存しない不活性化の両方のキネティクスを4倍程度加速できた(図3).さらにこの融合タンパク質は,c-opsin1単体よりもさらに小さなcAMP応答を示した(図4).すなわち,c-opsin1/RGS8融合タンパク質はこれまで試した光操作ツールのうち,最もGβγバイアスが強いことがわかった.今後,c-opsin1やc-opsin1/RGS8を用いることで,Gβγ経路を狙いうちした光遺伝学解析が実現され,GPCRが駆動する複雑な細胞応答・生理応答の中のどの応答がGβγによって引き起こされているのかをより明確にすることができると期待できる.
本研究は,生理学研究所の久保義弘先生と共同で行いました.久保先生から折に触れて「早く論文としてまとめないと次の発展がないですよ」と叱咤激励を頂いたおかげで論文として発表できました.この場を借りて深く御礼申し上げます.
Gβγ経路を選択的に光操作することや,c-opsin1という(オプシン研究者以外には)あまり知られていないタンパク質をツールに用いる研究には競争はないと思い込んでいたのですが,実際には,異なる分子設計のGβγバイアス光操作ツール9)や,c-opsin1を用いた光遺伝学解析10)が発表されています.どのような研究でも,競争にさらされていることを痛感するとともに,なんとか論文のかたちにできて安堵した次第です.また,これから種々の無脊椎動物型オプシンをツールとして用いた光遺伝学解析が,どんどん発展していくと予想・期待しています.