2025 年 65 巻 5 号 p. 273-275
2025 年 65 巻 5 号 p. 273-275
PTH及びPTHrPは骨粗しょう症患者に対する有効な治療薬及び治療薬候補であり,PTH1受容体を活性化し骨形成を誘導する.その一方で,これらの薬剤は副作用となる骨吸収を併発するため骨吸収を抑えた骨形成薬の開発が期待されている.本項では立体構造に基づく,PTH1受容体の活性化機構と骨吸収/骨形成作用のスイッチについて紹介する.
カルシウムはヒトに必須の金属イオンであり,血管収縮及び血管拡張,筋肉機能,神経伝達,細胞内シグナル伝達を担っている.血中カルシウム濃度の調整は骨を介して行われており,副甲状腺ホルモン(PTH)及び副甲状腺ホルモン関連ホルモン(PTHrP)が副甲状腺ホルモン第1受容体(PTH1受容体)を活性化することによって骨の形成,吸収の双方が制御されている.特に,骨形成作用を誘導可能な物質は極めて少ないため,これらのホルモンの精製産物及びその改変アナログ体は重症骨粗しょう症患者に対する臨床治療薬として応用されている1).しかし,これらのホルモン及びそのアナログはPTH1受容体を活性化することで骨形成のみならず副作用である骨吸収をも誘導するという問題があり,この相反する生理作用の分子基盤の研究が進められてきた.
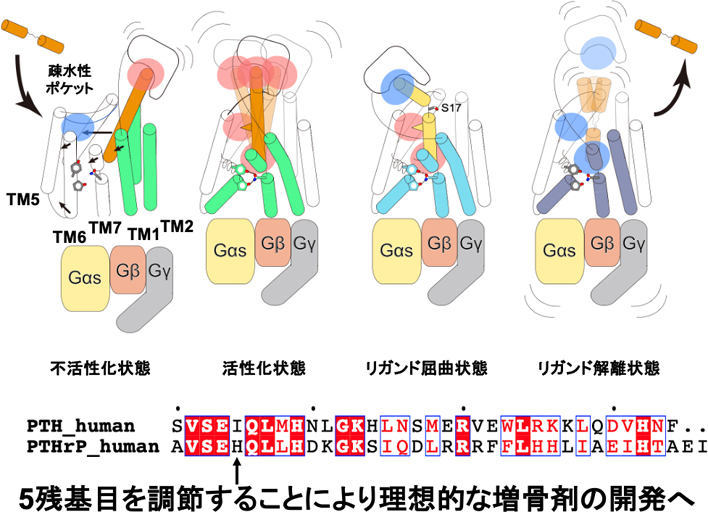
PTH1受容体は細胞外ドメイン(ECD)及び細胞内ドメイン(TMD)からなるGタンパク質共役型受容体であり,PTH及びPTHrPにより活性化する(図1).活性化したPTH1受容体はGsタンパク質を活性化することで骨形成作用及び骨吸収作用の双方を誘導する.特に,PTHは強い骨形成と強い骨破壊を誘導する一方で,PTHrPは弱い骨形成と弱い骨破壊を誘導する2).これまでにこれらのホルモンに対する網羅的なアミノ酸残基の点変異実験が行われ,これらホルモンのN末端領域が受容体活性能を,ホルモンのC末端領域が受容体活性時間を制御することが示された(図1)1).そのため,受容体活性化能の強いPTHのN末端と受容体活性化時間の短いPTHrPのC末端を組み合わせたホルモンは,受容体を強く,そして短く活性化するという薬剤プロファイルを獲得すると期待され,このような薬剤は副作用の少ない理想的な骨形成薬となると期待されてきた.しかしながら,PTHのN末端,PTHrPのC末端をもとにデザインされたLA-PTHと呼ばれるリガンドは,予想に反してPTHよりも長時間Gsタンパク質を活性化し続けることが明らかになった(図1)3).そのため,アミノ酸配列に基づいてPTH製剤の主作用/副作用プロファイルを合理的に制御することは困難であり,PTH1受容体を介した副作用発現機構を解明することはできていなかった.

PTH1受容体を介したGsの活性化時間と薬理効果.
このような問題点に対し,筆者はクライオ電子顕微鏡を用いてPTH及びPTHrPと結合したPTH1受容体とGsタンパク質からなる複合体の立体構造を解明し,その異なるリガンド認識メカニズムを可視化することでその副作用発現機構を解析した.まず,本研究により明らかになった活性化型のPTH1受容体の構造と既知の不活性化状態のPTH1受容体の構造を重ね合わせることで4),これらのホルモンによるPTH1受容体の活性化機構を可視化することに成功した.PTH及びPTHrPはPTH1受容体の細胞外領域に存在するオルソステリックポケットと呼ばれる薬剤ポケットに結合し,受容体の第1膜貫通ヘリックス(TM1)及びTM7と共に受容体中央へと移動する(図2,左上図).この構造変化は受容体の細胞内側へと向かう連続した構造変化を誘起し,最終的にPTH1受容体のTM6を受容体外側へと大きく構造変化させる.これによりPTH1受容体の細胞内領域が大きく開口し,Gsタンパク質が結合可能な活性化状態へと遷移する.これらの構造からは,活性化構造のPTH及びPTHrPがその2番目と5番目のアミノ酸残基を用いて活性化状態のPTH1受容体の疎水性ポケットと結合しており,これにより受容体のTM1及びTM7を活性化型の構造に固定していることが明らかになった(図2,左上図).また,興味深いことに,PTH1受容体を長時間活性化するPTHは5残基目にイソロイシンを採用しており,このイソロイシンにより受容体の疎水性ポケットと密接な結合を形成する一方で,短時間PTH1受容体を活性化するPTHrPはその5残基目にヒスチジンを採用しており,このポケットと不完全な結合を形成することが明らかになった.これらの構造比較から,リガンドはその2及び5残基目を用いて受容体の活性化時間を制御することが示唆された(図2,右上図).
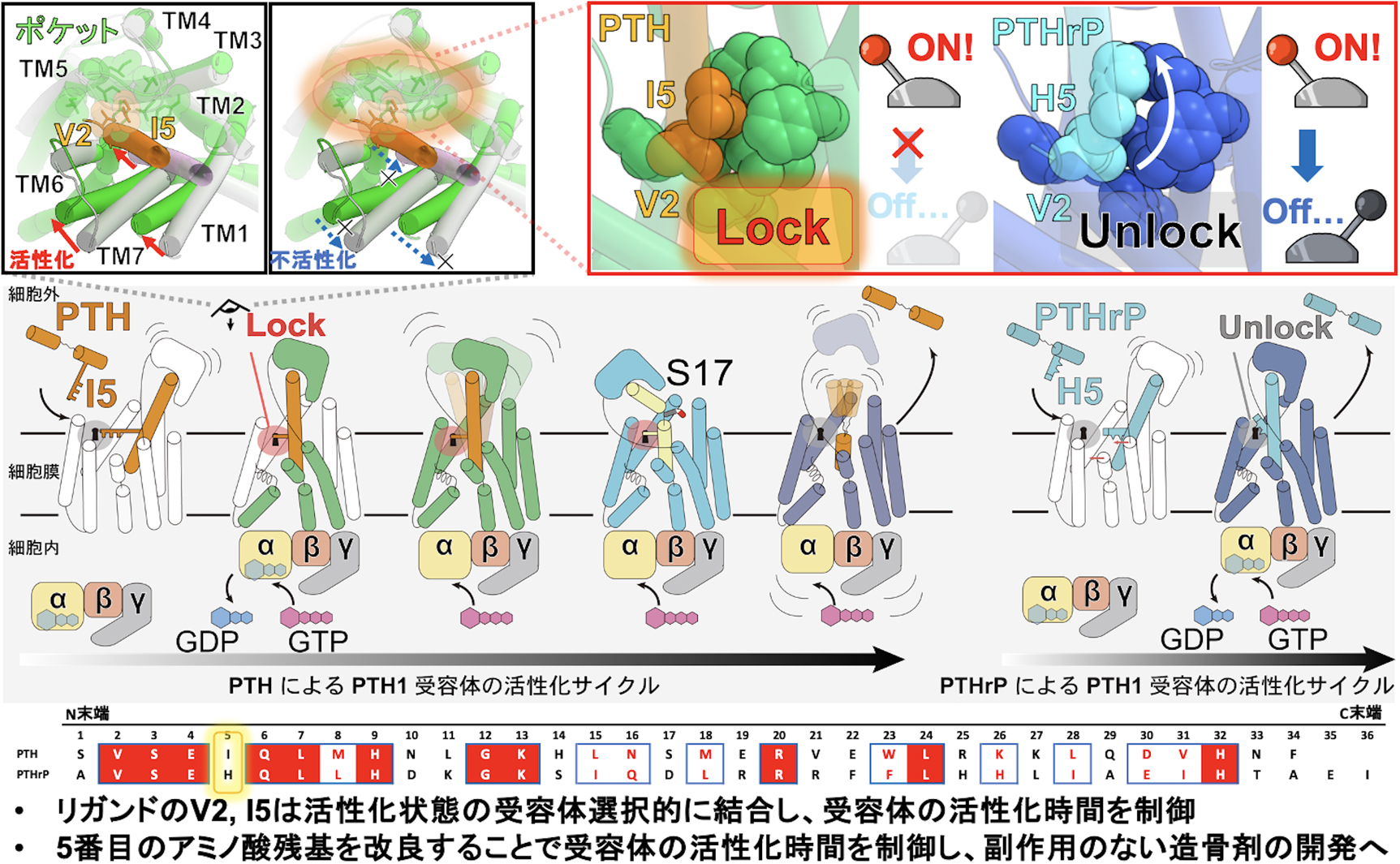
PTHによるPTH1受容体の活性化時間制御機構.
さらに,PTHと結合したPTH1受容体の構造解析からはリガンドが解離する過程の連続した構造変化が明らかになった.これらの構造変化からは,リガンドC末端領域は受容体のECDと結合することでリガンド全体の構造を安定化しており,リガンドの17残基目のセリンから立体構造が崩壊することでリガンドの受容体からの解離が促進されることが明らかになった.そのため,リガンドはそのN末端側に位置する5残基目を用いて受容体の活性化時間を制御しており,リガンドのC末端はリガンドの全体構造を安定化させることで,間接的にこのリガンド5残基目と受容体の相互作用を安定化することが示唆された.次に,得られた構造を計算機上の脂質二重膜に再構成し分子動力学シミュレーションを実施し,これによりホルモンの5残基目と受容体ポケットの結合,そして受容体の活性化状態の関連性を解析した.その結果,ホルモンの5残基目と受容体ポケットの結合が失われると受容体のTM1及びTM7が素早く不活性化構造へと遷移することが明らかになり,リガンドの5番目のアミノ酸残基が受容体の活性化時間を制御することが強く支持された(図2,下図).これらの研究からは先行研究とは異なり,受容体の活性化及び受容体のシグナル伝達時間の双方がリガンドのN末端領域に依存することが明らかになった.これにより,PTHのN末端を採用したLA-PTHが予想に反して長期的なGsシグナルを伝達してしまう理由に加え,PTHの後継薬として期待されているAbaloparatideがパルス状のシグナルを伝達し骨吸収を抑えて骨形成を誘導できるというメカニズムの構造学的な根拠を得ることにも成功した5)-7).本研究は30年来に続き研究されてきたPTH1受容体を介した骨形成/骨吸収を制御する分子メカニズムを解明したものであり,本研究の結果がより理想的な骨粗しょう症治療薬開発の基盤となることを期待したい.