2021 年 61 巻 12 号 p. 825-832
2021 年 61 巻 12 号 p. 825-832
抗IgLON5抗体関連疾患は,2014年に睡眠時随伴症,閉塞性睡眠時無呼吸症候群などの睡眠障害と,タウオパチーを示唆する病理所見を呈する疾患として報告された.これまで八つの臨床病型が報告されている.睡眠時随伴症と閉塞性睡眠時無呼吸症候群を合併する患者,また運動異常症,運動ニューロン病,認知症患者において特徴的な睡眠時随伴症を合併する場合は,血清ないし脳脊髄液の抗IgLON5抗体を測定することが望ましい.一般に予後は不良であるが,免疫療法により改善する症例も報告されており,早期診断による病初期からの免疫療法が,予後を改善する可能性がある.
Anti-IgLON5 diseases were first reported in 2014 as sleep disorders such as parasomnia and obstructive sleep apnea. The pathological findings were suggestive of tauopathies and eight clinical subtypes have been reported so far. Serum and cerebrospinal fluid anti-IgLON5 antibodies should be measured in patients with sleep-related disorders with parasomnia as well as in patients with movement disorders, motor neuron disease or dementia with characteristic parasominia. The prognosis is generally poor, but some patients have been reported to improve with immunotherapy. Early diagnosis and early immunotherapy may improve the prognosis.
抗IgLON5抗体関連疾患は,2014年に睡眠時随伴症,閉塞性睡眠時無呼吸症候群などの睡眠障害と,タウオパチーを示唆する病理所見を呈する疾患として報告された1).その後,きわめて多彩な臨床病型を呈する疾患であることが明らかにされた.いまだ概念が混沌としており,今後,その概念が変遷するかもしれないが,現時点での共通認識として疾患の理解を共有する意義があると思われる.本稿では,本症の発見の経緯から臨床病型,検査所見,病態,および免疫療法と予後について示す.とくにどのような症例で本症を疑い,抗IgLON5抗体を測定するかを提示したい.
2014年,スペインのSabaterらは,睡眠時の異常運動と行動,睡眠時無呼吸,喉頭喘鳴を呈する8名の患者を報告した1).6名は慢性の経過を呈し,発症から死亡または最後の受診までの期間は中央値5年であった.4名は睡眠障害で発症,主徴とし,2名は歩行障害が先行し,その後,球麻痺,運動失調または舞踏運動を呈した.5名では眼球運動異常を認めた.
ビデオ終夜ポリソムノグラフィー(video polysomnography,以下V-PSGと略記)では,閉塞性睡眠時無呼吸を5名,REM睡眠行動障害(REM sleep behavior disorder,以下RBDと略記)を4名で認めた.またノンレム睡眠中に,単純な動作,もしくは生活動作に似た複雑な動作を伴う発声を呈した.睡眠前半において未分化なノンレム睡眠または構造化不良なステージN2を特徴とする異常な睡眠を認めた.また周期性下肢運動症も認めた.調べた4名全例でHLA-DRB1*1001およびHLA-DQB1*0501アレルを有していた.8名とも血清ないし脳脊髄液において抗IgLON5抗体が陽性であった.8名中6名で,覚醒中または睡眠中の突然死が生じた.このうち2名に対し病理学的検討が行われ,主に脳幹と視床下部の神経細胞の喪失と異常リン酸化タウの沈着を認めた.
本症はヨーロッパ,米国,ブラジル,オーストラリア,中国,インド,日本で報告されている.Gaigらによる22名2),およびHonoratらによる20名3)の症例集積研究によれば,通常60歳代(46~83歳)に発症する.臨床経過は年単位で慢性に進行するが,急速な進行が2割弱の症例で生じる2).発症から診断までは中央値2.5年である2).がんの既往や併発,自己免疫疾患の併発は稀に生じうる3).Table 1に示す多彩な神経症候を,特定の組み合わせで呈する.
| Sleep disorders | sleep-related vocalizations, limb movement and behavior during sleep, sleep apneas, snoring, stridor, sleep fragmentation, insomnia, excessive daytime sleepiness |
| Gait instability | ataxic gait, postural instability, tendency to fall |
| Bulbar symptoms | dysphagia, dysarthria, sialorrhea, laryngeal stridor, laryngospasm, central hypoventilation |
| Abnormal eye movements | supranuclear vertical gaze palsy, nystagmus, abnormal saccades, abnormal pursuit |
| Movement disorders | chorea, tremor, myoclonus, oromandibular and limb dystonia, facial spasm, mild parkinsonism, akathisia |
| Dysautonomia | excessive sweating/anhidrosis, constipation, dysuria, sexual dysfunction, orthostatic hypotension, tachycardia/bradycardia |
| Cognitive impairments | attention disorder, episodic memory disorder, executive dysfunction, dysinhibition, apraxia |
| Psychiatric disorders | delirium, apathy, hallucinations, anxiety, depression |
| Peripheral nervous system hyperexcitability | cramp, limb stiffness, exaggerated startle response, fasciculations |
Gaigらは本症を四つの病型,すなわち①睡眠障害型(36%)②球麻痺症候群(27%),③進行性核上性麻痺(progressive supranuclear palsy,以下PSPと略記)様症候群(23%),④認知機能障害型(14%)に分類した2).その後,さらに⑤末梢神経障害型3),⑥小脳症候群3),⑦大脳皮質基底核症候群(corticobasal syndrome,以下CBSと略記)4),⑧球麻痺型運動ニューロン病mimics5)が報告され,現在,少なくとも8病型が報告されている(Table 2).
| Subtype | Differential diagnosis |
|---|---|
| 1. Predominant sleep disorder | Conventional NREM parasomnia, OSAS, iRBD, MSA, CJD |
| 2. Bulbar syndrome | MND, SBMA |
| 3. PSP-like syndrome | PSP, CBD, CJD, hereditary neurodegenerative diseases |
| 4. Cognitive impairment, often with chorea | HD, DRPLA, AD |
| 5. Peripheral nerve system manifestations (reminiscent of motor neuron disease or peripheral nerve hyperexcitability) | MND, stiff-person syndrome, metabolic disease, peripheral neuropathy, muscle disease |
| 6. Cerebellar syndrome with tremor | MSA, SCAs, IDCA, autoimmune cerebellar ataxia |
| 7. CBS | CBD, PSP, AD, FTLD, CJD, hereditary neurodegenerative diseases |
| 8. Bulbar-type MND mimics | MND, SBMA |
NREM, non-rapid eye movement; OSAS, obstructive sleep apnea syndrome; iRBD; idiopathic rapid eye movement disorder; MSA; multiple system atrophy; MND, motor neuron disease; SBMA, spinal bulbar muscular atrophy; PSP, progressive supranuclear palsy; CBD, corticobasal degeneration; CJD, Creutzfeldt-Jakob disease; HD, Huntington’s disease; DRPLA, dentatorubural pallidoluysian atrophy, AD, Alzheimer’s disease; SCAs, spinocerebellar ataxias, IDCA, idiopathic cerebellar ataxia; CBS, corticobasal syndrome; FTLD, frontotemporal lobar degeneration.
以下に示す症候から疑い,血清ないし脳脊髄液を検体とするcell-based assay法にて抗IgLON5抗体を検出する.またV-PSG所見は診断的価値が高い.
1. 睡眠障害①睡眠障害型で主徴となるほか,他の病型にも合併する.睡眠時随伴症(パラソムニア)と睡眠関連呼吸障害が主体で,不眠や日中の過眠を伴う1)~3).睡眠時随伴症は睡眠覚醒そのものやその過程の異常ではなく,睡眠中に起こる望ましくない身体現象を総称したものである.本症ではノンレム期およびレム期の双方に生じうる.ノンレム関連睡眠時随伴症(ノンレム・パラソムニア)は発声と運動を呈する.発声は単純なもの(つぶやき声,ささやき声,うめき声)と複雑なもの(話す,叫ぶ,笑う,泣くなど)がある.運動も単純なもの(明確な目的のない動作,例えば頭を上げたり,回したり,腕や足を上げたりすること)と複雑なもの(日常生活で見られる,目的を持つ動作,例えば飲食をしたり,物を掴んだりすること)がある6).殴ったり叫んだりするような攻撃的な行動はほとんど見られない.またレム関連睡眠時随伴症,すなわちRBDを呈することもある.
一部の患者は睡眠関連呼吸障害のみ呈する3)7).大きないびきや喉頭喘鳴がめだつため,発声や異常運動は軽視されて睡眠時無呼吸症候群と誤診される.頻回の覚醒がみられる.最大60%の患者は日中の眠気を訴える2).持続性陽圧呼吸療法にて睡眠時無呼吸と日中の過眠は改善するが,睡眠時随伴症は持続する.これらの睡眠障害は発症時に認めなくても,経過中に出現することがある2).
2. 運動異常症・運動失調症③PSP様症候群,⑥小脳症候群,⑦CBSで,主徴として認められる.核上性眼筋麻痺,姿勢保持障害,歩行障害,易転倒性,小脳性運動失調,自律神経障害,吸気性喘鳴といった症状を呈することから,組み合わせによってはPSPや多系統萎縮症(multiple system atrophy,以下MSAと略記)と類似する臨床像を示す2)3)8).しかしPSP様症候群のうち,PSPの古典的診断基準を満たす典型例は20%と多くはない2).また自律神経障害の頻度は高いものの,MSAと比較すると軽症で,起立性低血圧に限れば9%程度である2).
また我々は臨床的にCBSを呈し,血清抗IgLON5抗体が陽性で,免疫療法により改善した症例を経験した(Fig. 1)4).本例は大脳皮質基底核変性症(corticobasal degeneration,以下CBDと略記)の臨床診断基準を満たし9),本症を疑わせる特徴的な睡眠障害は認めなかったものの,上肢より下肢の失行が強いという特徴や脳脊髄液所見にて軽度の蛋白上昇を認めたことから(蛋白54 mg/dl,細胞数2/μl),抗体を測定した.
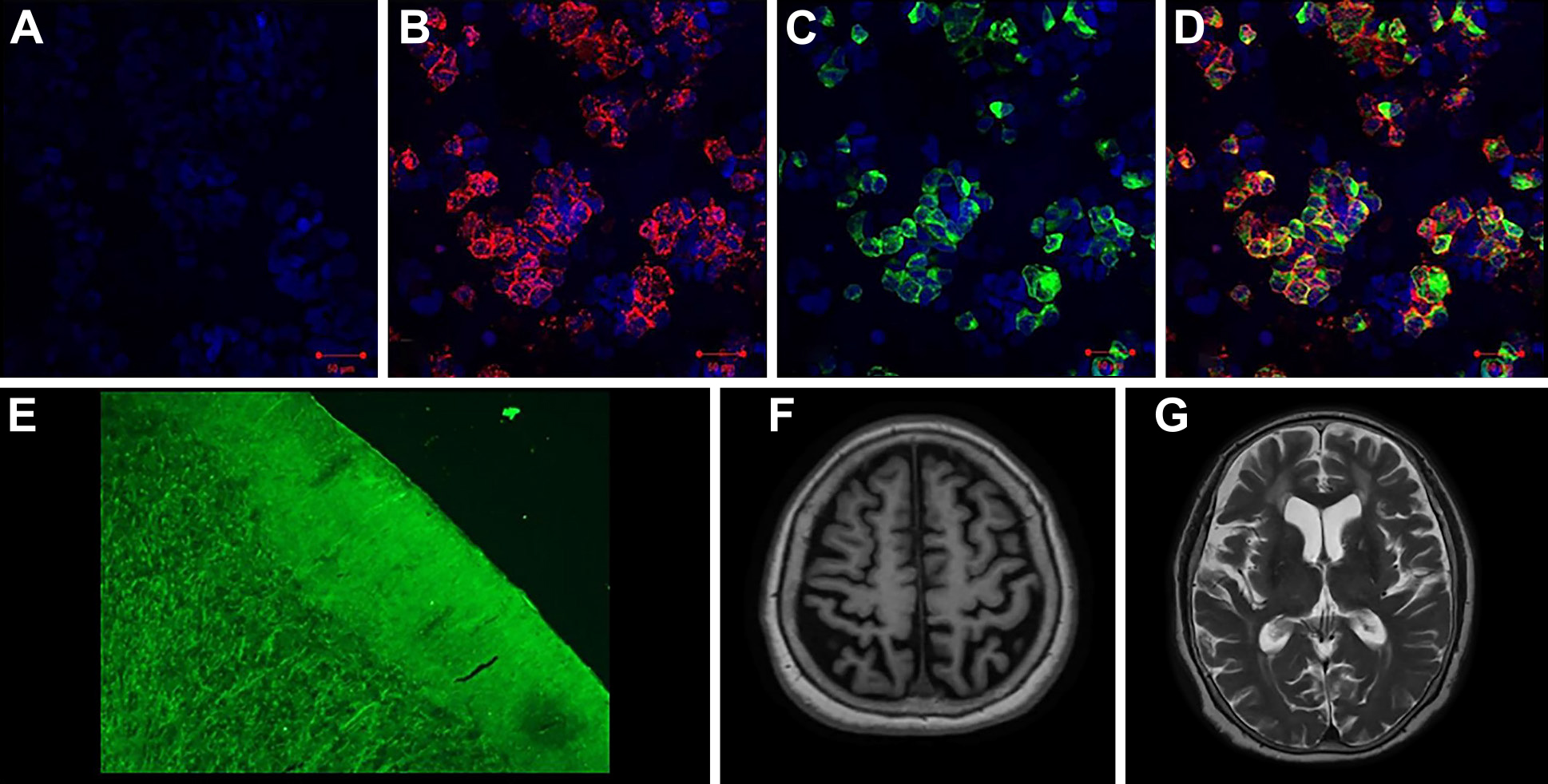
Cell-based assay of full-length IgLON5-transfected HEK293 cells (A–D). The cells stably express green fluorescent protein-tagged IgLON5 (C). Anti-IgLON5 antibodies were detected in the patient’s serum (B), but not in the healthy control’s serum (A). Colocalization of immunoglobulin G and IgLON5 is shown as yellow in the merged image (D). DNA is stained with 4,6-diamidino-2-phenylindole (blue). Tissue-based immunofluorescence assay using frozen rat cerebellar sections (E). Immunoreactivity is particularly robust in the cerebellum for which there is diffuse labeling of the molecular layer and synaptic glomeruli of the granular layer. Brain MRI revealed cortical atrophy predominantly in the right parietal lobe (F), and no abnormal findings in the bilateral striatum (G). Figure reproduced from Reference 4 with permission.
その他の運動異常症状としては,④認知機能障害型で認められる舞踏運動,⑥小脳症候群で認められる運動時振戦,さらにパーキンソニズム,ジストニアが報告されている1)~3)7)10).また⑤末梢神経障害型で,神経過剰興奮に伴う筋痙攣,ミオクローヌス,ミオリズミア,過剰驚愕反応,ニューロミオトニアを認めることがある3)11)12).
3. 球麻痺と運動ニューロン徴候②球麻痺症候群,⑧球麻痺型運動ニューロン病mimicsの主徴として認められる.Gaigらは嚥下・構音障害に加え,喉頭閉塞や中枢性低換気を呈する病型を球麻痺症候群と呼んだ2).その後,病初期に緩徐進行性の嚥下障害のみ呈し,遅れて顔面神経麻痺,声帯麻痺と呼吸不全を呈した症例が報告された13).さらに球麻痺型運動ニューロン病に類似した表現型を呈する5症例が,球麻痺型運動ニューロン病mimicsとして報告された5).初発症状は閉塞型無呼吸3名,嚥下障害1名,嗄声1名であった.球麻痺と呼吸筋麻痺が重篤で,睡眠関連呼吸障害と睡眠時随伴症を合併した.診断後の罹患期間は3~19ヶ月に及んだ.運動ニューロン病の臨床・電気生理学的徴候を示すものの,他の部位への典型的な進行性の広がりが見られなかったため,Awaji基準14)を満たさなかった.5名のうち2名で免疫療法により改善を示したが,喉頭機能障害は持続し,長期の気管切開による管理が必要であった.
4. 認知機能障害④認知機能障害型は稀であるが,急速に進行する注意障害,エピソード記憶障害,遂行機能障害,脱抑制を認め,舞踏運動を伴うことがある2)3).
一部の症例で軽度の細胞数増多や蛋白上昇を認めることがある2).オリゴクローナルバンドは陰性である.
2. 画像所見頭部MRI所見では特異的所見に乏しいが,Gaigらの検討で,軽度の脳幹萎縮を3名(13.7%),両側海馬の萎縮を1名(4.5%)で認めている2).脳炎を示唆する所見は認めないが2)3),一側の中脳被蓋に拡散強調像で高信号を呈した1例や15),夜間の呼吸困難,頭痛,発熱,痙攣重積発作を亜急性に発症した症例で,拡散強調像における中脳背側と小脳深部白質の対称的高信号が,上小脳脚を経由して上小脳交叉,腹外側視床まで及び,最終的に突然死した1例も報告されている16).
脳血流シンチグラフィーでは線条体領域の低下を呈しうる8).CBS例では,左右差を伴う大脳皮質の萎縮,血流低下,およびDATシンチグラフィーの異常所見を認めた(Fig. 1F, G)4).また中国から64歳女性例の18F-FDG PET所見が報告され,一次感覚・運動皮質,大脳基底核で相対的な代謝亢進を認めたが,免疫療法後には症状改善とともに軽減を認めた17).タウイメージングについての報告は渉猟した範囲ではない.
3. 電気生理検査脳波では特異的所見は呈さない.筋電図では線維束性収縮やneuromyotonic dischargeを認めることがある.
4. V-PSG睡眠前半の未分化なノンレム睡眠(瘤波,K複合,睡眠紡錘波,delta slowingを伴わない,びまん性の不規則なシータ波活動と,連続的で広範囲の筋電図活動を認める),または頻繁な発声,単純ないし目的を伴うような手足の動きを伴う,構造の乏しいN2ノンレム睡眠(時々であるが識別可能なK複合や睡眠紡錘波によって定義される)を認める.また睡眠後半では,正常なステージN2/N3が出現する.いびき,喉頭喘鳴を伴う睡眠関連呼吸障害が,とくに正常なノンレム睡眠期に顕著となる1)18).REM without atoniaや,レム期の消失を認める.総睡眠時間および睡眠効率の低下,正常なステージN1/N2の量の減少,周期性四肢運動症が認められる.
5. HLA原著にてHLA-DRB1*10:01およびHLA-DQB1*05:01アレルとの関連が見出された1).Gaigらの検討では,15名中13名(86.6%)がHLA-DRB1*10:01およびHLA-DQB1*05:01アレルを有していた2).DRB1*10:01と本症の関連は,一般集団と比較して最大36倍に増加した1).Gaigらが再検討したデータでは,HLA-DRB1*10:01-DQB1*05:01ハプロタイプは20/35名(57.1%)に認め,主にヨーロッパ人からなる健常集団の2.4%と比較し,オッズ比54.5と多く,タウ蛋白遺伝子MAPT H1/H1ホモ接合型についても20/24名(83.3%)に認め,健常集団の54/116名(46.5%)より有意に関連していた19).以上より本症が自己免疫疾患であること,ならびにその根底に神経変性プロセスが関与している可能性が示唆された.
6. 抗IgLON5抗体測定上述の神経症候から疑い,cell-based assay法にて抗体を検出し診断する(Fig. 1A~D).血清と脳脊髄液の両者で抗体が検出されるが,少数の患者では血清のみに抗体を認める.血清のみで抗体が検出されたPSP様症候群の症例も報告されている2).IgGサブクラスは,21名中20名がIgG1とIgG4抗体を有したが,16名は後者が優位であった2).血清にのみ抗体を認める症例の病態については不明であるが,血中で産生された抗体の一部が中枢神経内に移行し,cell based assayで検出できない低濃度ながらも神経傷害をもたらす可能性がある.
Gelpiらは原著2例を含む6症例の病理学的検討を行い,視床下部や脳幹(中脳水道周囲灰白質,脚橋被蓋核,橋外背側被蓋,延髄巨細胞性網様核)にめだち,頸髄上部まで認められる異常リン酸化された3リピートおよび4リピートタウの神経細胞における沈着と,神経細胞脱落,グリオーシスを示した(Fig. 2)20).アストロサイトにおけるタウ沈着や,βアミロイド,αシヌクレインの沈着,炎症細胞の浸潤は認めなかった.上記の病変部位は,ノンレム睡眠の開始に関わるparafacial zone,レム睡眠時の筋弛緩に関わる延髄巨細胞性網様核,平衡障害を伴う歩行異常に関わる脚橋被蓋核,呼吸や声帯運動に関わる疑核を含み,本症の多彩な症候を説明しうる.Gelpiらはこれらの知見にもとに,3段階に分類する病理学的診断基準を提案した20)(Table 3).上記の病理所見を認めた場合はpossible,これに本症に特徴的な臨床像や特定のHLAアレルを認めた場合にはprobable,脳脊髄液ないし血清の抗IgLON5抗体陽性の場合にdefiniteとなる.生前の診断には用いることはできないため,臨床診断基準の作成が望まれる.
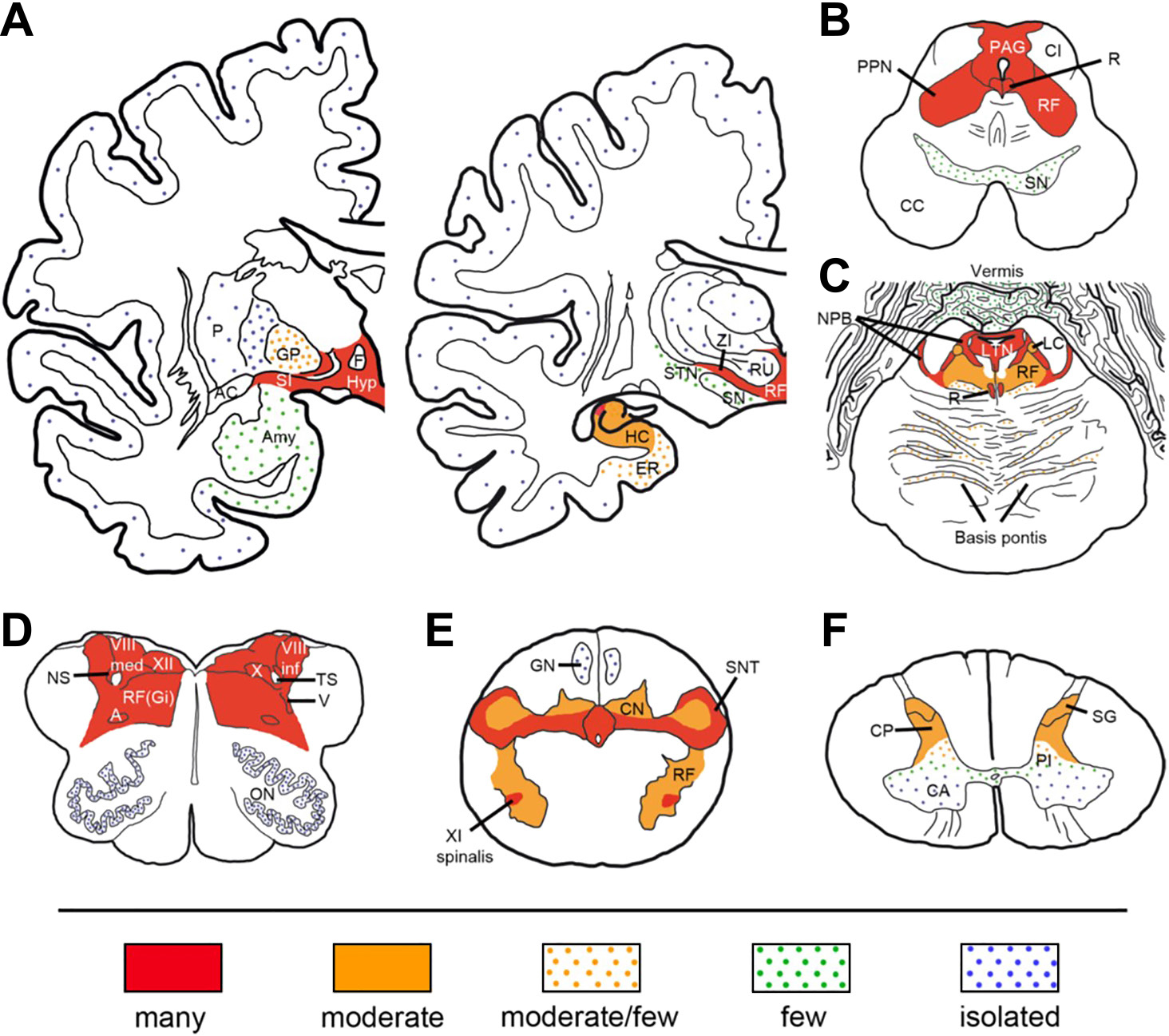
A coronal section of the tonsil and lateral geniculate body (A), the middle brain (B), the pons (C), the medulla oblongata (D), the pyramidal decussation (E), and the cervical cord (F). Figure reproduced from Reference 20 with permission.
| Possible | |
| All of the following requirements | |
| Neurodegenerative features with neuronal loss and gliosis in brain areas showing hyperphosphorylated (p)Tau pathology without the presence of inflammatory infiltrates Selective neuronal involvement by deposition of pTau in the form NFT, pretangles and neuropil threads with both 3R-tau and 4R-tau isoforms contributing to the inclusions The pTau pathology predominantly affects subcortical structuresa, including the hypothalamus, brainstem tegmentum and upper spinal cord | |
| Probable | |
| Criteria of “possible” AND at least one of the following | |
| Clinical history suggestive of a sleep disorder (NREM and REM parasomnia with sleep apnea), or brainstem, mainly bulbar dysfunctionb Presence of HLA-DRB1*1001 and HLA-DQB1*0501 alleles | |
| Definite | |
| Criteria for “possible” AND presence of IgLON5 antibodies in CSF or serumc | |
a. Hippocampus generally involved, except for one patient. b. Includes dysarthria, dysphagia, central hypoventilation, stridor. c. IgLON5 positivity is detected by cell-based assay in serum at 1/40 and in CSF at 1/2. Table reproduced from Reference 20 with permission.
免疫ブロットにて不溶性タウや電顕像の検討は渉猟した限り未報告であるが,免疫染色でtufted astrocyteやcoiled bodyなどのグリア病変を認めないことや,テント上や基底核におけるタウ病理を認めないことから20),他のタウオパチーとは明確に区別ができる.さらにCagninらは,神経細胞におけるタウ沈着を認めるのみでなく,大脳基底核,マイネルト基底核,視床,中脳にミクログリアおよび神経細胞におけるTDP-43沈着が認められ,視床の検体を用いた免疫ブロットでは限定分解を受けたN末断片や不溶化したTDP-43が認められることを報告している21).
①閉塞型無呼吸,喉頭喘鳴に睡眠時随伴症を認める症例で,その他の神経症候や脳脊髄液検査異常(細胞数増多や蛋白上昇)を合併する場合,②上述の特徴的なV-PSG所見を呈する症例,③PSP/CBSや認知症が疑われる症例で,上述の特徴的な睡眠障害や脳脊髄液検査異常を合併する症例,④病初期から喉頭喘鳴,上気道閉塞による急性呼吸困難,重度の嚥下障害に,上述の睡眠障害を認める症例では,本症を疑い,抗IgLON5抗体を測定する.鑑別診断をTable 2に示した.臨床的に遺伝性プリオン病である致死性家族性不眠症と類似しており,MM2視床型孤発性Creutzfeldt–Jakob 病との鑑別に苦慮した報告も報告されている22).本症では周期性四肢運動症や喉頭喘鳴を認めることが多く,プリオン病では高度の不眠,睡眠紡錘波や睡眠徐波の消失などの睡眠脳波異常を認めることが多いことが指摘されている22).
IgLON5は神経細胞接着因子である.免疫グロブリンスーパーファミリーに属し,五つの異なるサブタイプがある23).他のサブタイプについては,脳の発達過程での種々のニューロン経路の発見やシナプス形成における役割が示されているが,IgLON5の生理学的機能は不明である.
抗IgLON5抗体に関しては,ラット海馬の初代培養神経細胞の培養液に患者血清を加えるとIgLON5の内在化が起こり,この作用にはIgG1が重要であることや24),抗IgLON5抗体が細胞骨格とIgLON5の結合を阻害し,異常なタウの沈着と神経細胞脱落につながる可能性が報告されている25).さらにiPS細胞より分化誘導したヒト神経細胞を用いた実験でも,患者IgGがリン酸化タウ陽性神経細胞の増加と神経細胞死を引き起こすことが示されている26).
本症の病態機序については二つの考え方がある.第1は,本態は自己免疫疾患であり,機序は不明ながらタウの異常リン酸化と神経細胞における蓄積が生じるという立場で,自己免疫性タウオパチーと呼ぶものである27).抗IgLON5抗体が神経細胞表面抗原に対する抗体であることや,特定のHLAアレルへの強い関連を有することが,本症が自己免疫疾患であることの根拠として挙げられる.また病理学的に炎症細胞浸潤がないことから,抗IgLON5抗体は単に脳炎を引き起こすのではなく,神経変性を誘発する可能性が推測されている25)26).第2は,本態は変性疾患であるタウオパチーで,2次的な免疫反応が生じて抗IgLON5抗体が産生されるという立場である.免疫療法による臨床的な改善が乏しいことや,大半の患者で慢性的な経過をたどること,病理所見が神経変性疾患に類似することが根拠として挙げられる.しかし通常のPSP/CBDや睡眠時無呼吸症候群患者では抗IgLON5抗体は陰性であり28)29),二次的な免疫反応により抗IgLON5抗体が産生される機序が不明である.
原著の8例では,免疫療法として,ステロイド(7例),免疫グロブリン静注療法(3例),シクロホスファミド(4例),リツキシマブ(2例)が施行され,治療反応性は改善が1例,不変が7例であった.転帰は死亡が6例で,うち3例は就眠中の突然死で,予後不良の疾患と考えられた1).Gaigらによる22名の報告では,20名に対し免疫療法が行われた2).症状が軽度,一過性に改善した患者は2名のみで,死亡例は13名で,死因は6名は睡眠中ないし覚醒時の突然死,6名は誤嚥性肺炎,1名は副腎腫であった.
しかしながら免疫療法後に改善する症例も報告されている4)10)30).Honoratらの20例の報告でも,免疫療法が行われた9例のうち7例で神経症候の改善が認められ,うち6例は最終評価時にも安定していた3).治療反応性の差は臨床像により影響を受ける可能性がある3).また血漿交換療法やリツキシマブを含めた強力な免疫療法の効果が数ヶ月遅れて発現した症例も報告されている31).
Cabezudo-Garcíaらは,既報の46症例を後方視的に検討し,治療反応性に関わる因子を検討した32).この結果,20/46例(43.3%)に治療反応性が認められ,15/46例(32.6%)では最終評価時にも改善が持続していた.薬剤ごとの奏効率としては,ステロイド12/35例(34.2%),免疫グロブリン静注療法9/21例(46%),血液浄化療法7/15例(46%),アザチオプリン5/5例(100%),ミコフェノール酸モフェチル3/4例(75%)であった.治療反応性に関わる因子として,認知機能障害が主徴となる患者,HLA-DQB1*05:01陽性かつHLA-DRB1*10:01陰性,脳脊髄液の炎症反応が同定された.一方,無治療で急速に改善し,再発を認めていない軽症患者も最近,報告されている33).
また重要なこととして,血液浄化療法の選択がある.血漿交換療法や免疫吸着療法が適応と考えられるが,前述のように抗IgLON5抗体はIgG4サブクラスが主体であることから2),免疫吸着療法は無効であり,血漿交換療法を行う必要がある.
本邦においても本症が報告されたことから4),今後,睡眠関連呼吸障害,PSP/CBS,球麻痺型運動ニューロン病において特徴的な睡眠時随伴症を伴う症例では,鑑別診断に加えて検討する必要がある.また自験例4)を提示したように臨床,画像所見とも臨床診断CBSで矛盾しない症例においても,本症を鑑別診断に加える必要がある.また原著1)にあるように喉頭喘鳴,睡眠中の異常行動,突然死を来すことからMSAなどのαシヌクレイノパチーと考えている症例のなかにも本症が含まれる可能性もある.本症に免疫療法が効きにくい理由として,診断の遅れが関与している可能性があることから,早期に診断し,免疫療法の効果を確認することが求められる.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.