2023 年 5 巻 2 号 p. 75-80
2023 年 5 巻 2 号 p. 75-80
【目的】入院中の小児患者における体重増加不良に影響を与える因子の検討を行った.【対象および方法】小児患者111名を対象とし,後ろ向きコホート研究を行った.体格評価には身長体重標準曲線から算出したstandard deviation値を用いた.nutrition support team介入前後での体重ΔSD値をアウトカムに,栄養学的因子を年齢・治療方法などの共変量で補正した重回帰分析(強制投入法)を行った.【結果】介入開始時平均年齢は8.1 ± 4.4歳,疾患の種類は血液悪性腫瘍50名,固形腫瘍30名,脳腫瘍12名,その他19名であった.平均介入日数144.5 ± 87.8日,介入開始時の平均体重SD値–0.6 ± 1.4,介入期間中の平均体重ΔSD値0.03 ± 0.7であった.重回帰分析の結果,造血幹細胞移植の有無が体重ΔSD値を低下させる有意な因子であった.【結論】造血幹細胞移植治療を行う患者には診断後早期から重点的な栄養介入を行う必要性が示唆された.
Aim: The goal of the study was to evaluate factors contributing to poor weight gain in hospitalized pediatric patients.
Patients and methods: A retrospective cohort study was performed in 111 pediatric patients. SD values for body weight calculated from the cross-sectional growth chart were used to evaluate physiques. After nutritional factors were adjusted for covariates such as age and treatment, multiple regression analyses (forced entry) were performed using body weight (ΔSD) before and after a nutrition support team (NST) intervention as an outcome.
Results: The mean age at baseline was 8.1 ± 4.4 years. The disease types were hematological malignant tumors (n = 50), solid tumors (n = 30), brain tumors (n = 12), and other diseases (n = 19). The mean period over which the patients underwent NST interventions was 144.5 ± 87.8 days. The mean body weight at baseline (SD) and the change during the intervention (ΔSD) were –0.6 ± 1.4 and 0.03 ± 0.7 kg, respectively. Multiple regression analyses showed that a history of hematopoietic stem cell transplantation was a significant factor in reducing body weight (ΔSD).
Conclusion: This study suggests that patients who are scheduled to receive hematopoietic stem cell transplantation should undergo intensive nutritional intervention soon after their diagnosis.
小児がんは15歳未満の小児に発症するがんである1).わが国では小児がんの罹患率は13.6(人口10万人あたり)であり,白血病,脳腫瘍,リンパ腫,神経芽腫などがみられる2).小児がん患者の予後は,化学療法と外科療法と放射線療法,また必要に応じて造血幹細胞移植を組み合わせた集学的治療によって飛躍的に改善されてきており,主要な小児がんのサバイバー生存率はおよそ9割になっている2).がん化学療法中やがん周術期ではエネルギー代謝が亢進し,必要栄養量が増加する一方で,味覚障害,粘膜炎,悪心,嘔吐,下痢などのさまざまな有害な消化器系の副作用から著しく経口摂取量が減少するため,蛋白質・エネルギー栄養不良が進行する3,4).小児がん患者における栄養不良の発生率は,腫瘍の種類,病期,部位および治療方法に応じて3~65%程度といわれている5).栄養不良の小児患者では感染率が高く,治療中の栄養不良は小児患者の予後に悪い影響を与える可能性が高い6,7).筆者らは,小児患者に栄養介入を行うにも関わらず,入院中に栄養状態が悪化し,体重増加不良を認める症例を多く経験した.小児は成人とは異なり成長・発育段階にあるため,栄養状態の悪化は治療への影響のみならず,成長・発育への影響も懸念される8).
そこで,本研究では,小児患者の体重増加不良に影響を与える因子を検討するために,広島大学病院小児科病棟に入院中の小児患者を対象に,身体計測値,治療項目,栄養投与量および栄養状態の評価指標について,それらの関連を検討した.
広島大学病院小児科病棟において,2015年4月1日から2021年3月31日に栄養サポートチーム(nutrition support team;以下,NSTと略)が介入した小児患者のうち,介入期間が365日以上,診断時の年齢2歳未満,既知の症候群または明らかな発達障害,死亡退院を除外した患者111名を解析対象とした.
NST介入は,主治医からNSTへ介入依頼があった時点から退院時まで行われた.管理栄養士は「日本人の食事摂取基準」を用いて患者個々の病態に合わせた必要栄養量を算出した.経口摂取量,中心静脈栄養(total parenteral nutrition;以下,TPNと略),末梢静脈栄養(peripheral parenteral nutrition;以下,PPNと略),経腸栄養(enteral nutrition;以下,ENと略)からの投与栄養量を算出し,栄養投与経路の検討および病院食の食種,補助食品,持ち込み食の提案を行った.看護師は病棟担当看護師より患者と患者家族の状況を聞き取り,管理栄養士と共に栄養投与経路や病院食の食種などについて検討を行った.薬剤師は病棟担当薬剤師と連携し,治療による副作用に応じた薬剤調整や排便コントロールなどの提案を行った.理学療法士・作業療法士はリハビリに,言語聴覚士は摂食嚥下状態や食事摂取状況に関わる情報提供と提案を行った.医師はそれらの意見をまとめ,主治医へ栄養処方の提案を行った.回診時には,NSTが患者と患者家族に対して,現在の患者の投与栄養量・必要栄養量とその乖離,栄養状態を説明した.また,患者と患者家族,病棟スタッフに対して,栄養に関することはいつでも相談にのるという姿勢を示した.
患者背景情報として,NST介入時の年齢,性別,NST介入期間における身体計測値[身長,体重],治療項目[腫瘍の種類,手術・放射線療法・抗がん剤治療・造血幹細胞移植の有無],NST介入期間における栄養投与量および栄養状態評価指標[経口摂取量,TPN・PPN・EN栄養投与量(それぞれのエネルギー量および蛋白質量),トランスサイレチン(以下,TTRと略)]をカルテより抽出した.
体格評価には,日本人小児の身長体重標準曲線による各月齢に応じた平均値からの乖離幅である標準偏差(standard deviation;以下,SDと略)値を用いた.SD値は一般社団法人日本小児内分泌学会がホームページ上で公開しているExcelファイル9)を用いて算出した.NST介入前後での体重のSD値の差を体重ΔSD値,身長のSD値の差を身長ΔSD値と定義し,ΔSD値が上昇した群(以下,上昇群と略)とΔSD値が下降した群(以下,下降群と略)の2群に分け,臨床的・栄養学的な差異を検討した.
連続データは平均値±SDで表し,対応のないT検定にて有意差を確認した.カテゴリカルデータの比較は,χ2検定もしくはFisher正確確率検定のいずれかを適切な方法で行い,p < 0.05を有意差ありとした.また,身長体重標準曲線から算出したSD値について,体重ΔSD値をアウトカムに,栄養学的因子を年齢・治療方法などの共変量で補正した重回帰分析(強制投入法)を行った.なお,多重共線性を考慮し,エネルギー量と蛋白質量は別々に投入し2つのモデルを作成した.統計解析ソフトは,IBM SPSS Statistics 24.0(日本アイ・ビー・エム株式会社)を用い,有意水準は5%(両側検定)とした.
広島大学病院が行う倫理的配慮の方法はオプトアウトとし,広島大学病院栄養管理部ホームページおよび掲示板において研究の目的,データの取り扱い,研究協力の任意性等を情報公開し,拒否の機会を提供した.本研究は広島大学疫学研究倫理審査委員会および県立広島大学研究倫理委員会の承認を得て実施した(E-2542および第21HH006号).
NST介入前後での体重ΔSD値のヒストグラムを図1に示す.上昇群の平均ΔSD値は0.5 ± 0.5で,下降群の平均ΔSD値は–0.5 ± 0.4であった.表1に患者背景を示す.解析対象となった小児患者111名(男児48名,女児63名)のNST介入開始時平均年齢は8.1 ± 4.4歳であった.疾患の種類は血液悪性腫瘍50名が最も多かった.治療の方法は全員に抗がん剤治療が行われ,造血幹細胞移植は39名に行われた.
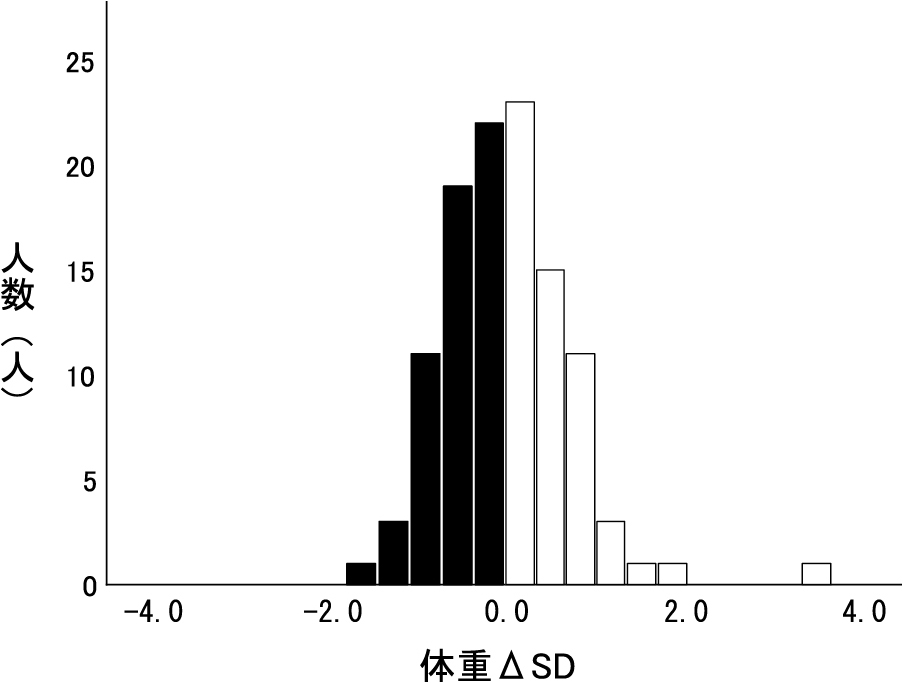
n = 111 ■,下降群;□,上昇群 上昇群の平均ΔSD値は0.5 ± 0.5で,下降群の平均ΔSD値は–0.5 ± 0.4であった.
| 上昇群 | 下降群 | 全体 | p値† | |
|---|---|---|---|---|
| n = 55 | n = 56 | n = 111 | ||
| 年齢 | 8.6 ± 4.6 | 7.6 ± 4.2 | 8.1 ± 4.4 | 0.20 |
| 性別(男/女) | 26/29 | 22/34 | 48/63 | 0.45 |
| 疾患の種類(血液悪性腫瘍/固形腫瘍/脳腫瘍/その他) | 27/13/6/9 | 23/17/6/10 | 50/30/12/19 | 0.87 |
| 手術(あり/なし) | 16/39 | 21/35 | 37/74 | 0.42 |
| 放射線療法(あり/なし) | 24/31 | 31/25 | 55/56 | 0.26 |
| 抗がん剤治療(あり/なし) | 55/0 | 56/0 | 111/0 | ― |
| 造血幹細胞移植(あり/なし) | 15/40 | 24/32 | 39/72 | 0.11 |
| 退院内訳(自宅退院/転院) | 55/0 | 52/4 | 107/4 | 0.06‡ |
NST介入前後での体重ΔSD値から体重ΔSD値が上昇した群(上昇群)とΔSDが下降した群(下降群)の2群間比較を行った.n = 111 † χ2検定 ‡ Fisher正確確率検定 § その他の疾患と人数 :重症先天性好中球減少症8名,慢性肉芽腫症3名,慢性活動性EBウイルス感染症2名,血小板減少症1名,再生不良性貧血1名,先天性補体欠損症1名,メンデル遺伝型マイコバクテリア易感染症1名,CARD9欠損症1名,X連鎖リンパ増殖症候群1名
表2に臨床的・栄養学的因子を示す.入院からNST介入までの平均日数は43.8 ± 38.7日,平均NST介入日数は144.5 ± 87.8 日,NST介入回数は5.0 ± 2.6回であった.身長体重標準曲線から算出したNST介入期間中の平均ΔSD値 は,体重ΔSD値0.03 ± 0.7で,身長ΔSD値–0.2 ± 0.8であった.NST介入期間中の平均ΔTTR値は1.0 ± 7.9mg/dLであった.NST介入前後での経口およびTPNからのエネルギー充足率の差はそれぞれ–1.2 ± 45.1%,4.9 ± 54.6%,蛋白質充足率の差はそれぞれ–5.3 ± 24.3%,3.0 ± 41.2%であった.2群間において有意な差が認められた項目は,介入時体重のSD値(p = 0.01),介入前後での体重ΔSD値(p < 0.001),介入前後でのΔTTR値(p = 0.04)であった.疾患の種類や治療方法,入院日数や入院からNST介入までの日数,投与経路によるエネルギー・蛋白質の充足率には有意な差は認められなかった.
| 上昇群 | 下降群 | 全体 | p値† | |
|---|---|---|---|---|
| n = 55 | n = 56 | n = 111 | ||
| 入院日数 | 218.2 ± 94.1 | 225.2 ± 99.3 | 221.7 ± 96.4 | 0.71 |
| 入院からNST介入までの日数 | 48.3 ± 46.0 | 39.3 ± 29.5 | 43.8 ± 38.7 | 0.22 |
| NST介入日数 | 152.1 ± 92.9 | 137.1 ± 82.7 | 144.5 ± 87.8 | 0.37 |
| NST介入回数 | 5.3 ± 2.7 | 4.7 ± 2.4 | 5.0 ± 2.6 | 0.19 |
| NST介入時体重のSD値 | –0.9 ± 1.4 | –0.3 ± 1.3 | –0.6 ± 1.4 | 0.01 |
| NST介入時身長のSD値 | –0.3 ± 1.4 | –0.6 ± 1.5 | –0.4 ± 1.4 | 0.23 |
| NST介入時のエネルギー充足率(経口) | 63.2 ± 41.8 | 77.1 ± 40.1 | 69.9 ± 41.4 | 0.09 |
| NST介入時のエネルギー充足率(TPN) | 14.3 ± 20.5 | 13.5 ± 19.4 | 13.9 ± 19.9 | 0.83 |
| NST介入時の蛋白質充足率(経口) | 64.9 ± 53.8 | 63.5 ± 50.2 | 64.2 ± 51.8 | 0.89 |
| NST介入時の蛋白質充足率(TPN) | 7.6 ± 22.4 | 3.0 ± 9.7 | 5.4 ± 17.6 | 0.18 |
| NST介入時のTTR値(mg/dL) | 18.3 ± 8.5 | 21.5 ± 7.6 | 19.8 ± 8.2 | 0.07 |
| NST介入前後での体重ΔSD値 | 0.5 ± 0.5 | –0.5 ± 0.4 | 0.03 ± 0.7 | <0.001 |
| NST介入前後での身長ΔSD値 | –0.1 ± 0.6 | –0.2 ± 1.0 | –0.2 ± 0.8 | 0.80 |
| NST介入前後でのΔエネルギー充足率(経口) | 6.9 ± 48.1 | –9.2 ± 40.8 | –1.2 ± 45.1 | 0.08 |
| NST介入前後でのΔエネルギー充足率(TPN) | –7.5 ± 25.2 | –3.2 ± 23.2 | –5.3 ± 24.3 | 0.40 |
| NST介入前後でのΔ蛋白質充足率(経口) | 1.1 ± 59.6 | 8.6 ± 49.6 | 4.9 ± 54.6 | 0.51 |
| NST介入前後でのΔ蛋白質充足率(TPN) | –2.2 ± 36.7 | 8.0 ± 45.0 | 3.0 ± 41.2 | 0.24 |
| NST介入前後でのΔTTR値(mg/dL) | 3.0 ± 7.9 | –0.9 ± 7.6 | 1.0 ± 7.9 | 0.04 |
NST介入前後での体重ΔSD値から体重ΔSD値が上昇した群(上昇群)とΔSDが下降した群(下降群)の2群間比較を行った.NST介入前後での経口およびTPNからのエネルギー・蛋白質の充足率の差,およびTTR値の差をΔで表した.n = 111 † T検定
表3および表4に体重ΔSD値を従属変数とした重回帰分析の結果を示す.エネルギー量に着目したモデル1では,体重ΔSD値と有意な関連を認めた変数は,造血幹細胞移植の有無の1つであった.蛋白質量に着目したモデル2では,体重ΔSD値と有意な関連を認めた変数は,造血幹細胞移植の有無の1つであった.造血幹細胞移植を行った患者39名について,上昇群15名と下降群24名の患者背景および臨床的・栄養学的因子を検討したところ,NST介入前後での体重ΔSD値(p = <0.001)以外に有意差は認められなかった.
| B | 95% CI | β | p値 | ||
|---|---|---|---|---|---|
| 性別 | 0.08 | –0.36 | 0.52 | 0.04 | 0.71 |
| 手術の有無 | –0.13 | –0.63 | 0.37 | –0.07 | 0.60 |
| 放射線療法の有無 | –0.35 | –0.87 | 0.18 | –0.19 | 0.19 |
| 造血幹細胞移植の有無 | –0.77 | –1.29 | –0.26 | –0.41 | 0.004 |
| 介入時体重SD値 | –0.05 | –0.20 | 0.10 | –0.08 | 0.50 |
| 介入時年齢 | –0.02 | –0.07 | 0.03 | –0.09 | 0.42 |
| 介入日数 | 0.000 | –0.003 | 0.002 | –0.05 | 0.68 |
| 介入前後でのΔTTR値(mg/dL) | –0.01 | –0.03 | 0.02 | –0.04 | 0.72 |
| 介入前後でのΔエネルギー充足率(経口) | 0.000 | –0.01 | 0.005 | –0.01 | 0.96 |
| 介入前後でのΔエネルギー充足率(TPN) | 0.003 | –0.01 | 0.01 | 0.09 | 0.41 |
n = 111 B,偏回帰係数;β,標準回帰係数;CI,Confidence interval;R2 = 0.26
| B | 95% CI | β | p値 | ||
|---|---|---|---|---|---|
| 性別 | 0.14 | –0.29 | 0.57 | 0.08 | 0.52 |
| 手術の有無 | –0.20 | –0.69 | 0.28 | –0.11 | 0.40 |
| 放射線療法の有無 | –0.26 | –0.80 | 0.27 | –0.15 | 0.33 |
| 造血幹細胞移植の有無 | –0.76 | –1.27 | –0.25 | –0.41 | 0.004 |
| 介入時体重SD値 | –0.06 | –0.20 | 0.09 | –0.09 | 0.45 |
| 介入時年齢 | –0.02 | –0.07 | 0.03 | –0.09 | 0.43 |
| 介入日数 | –0.001 | –0.003 | 0.002 | –0.06 | 0.58 |
| 介入前後でのΔTTR | –0.01 | –0.03 | 0.02 | –0.05 | 0.69 |
| 介入前後でのΔ蛋白質充足率(経口) | –0.001 | –0.01 | 0.002 | –0.09 | 0.46 |
| 介入前後でのΔ蛋白質充足率(TPN) | –0.002 | –0.01 | 0.003 | –0.08 | 0.50 |
n = 111 B,偏回帰係数;β,標準回帰係数;CI,Confidence interval;R2 = 0.25
本研究では,広島大学病院小児科病棟に入院中の小児患者を対象に,入院中の体重増加不良に影響を与える因子の検討を行った.NST介入前後での体重ΔSD値の上昇群と下降群の2群間比較において有意な差が認められた項目は,NST介入開始時体重の平均SD値,NST介入前後での体重ΔSD値,NST介入前後でのΔTTR値であった.体重ΔSD値を従属変数とした重回帰分析の結果,体重ΔSD値と有意な関連を認めた変数は,造血幹細胞移植の有無の1つであった.
造血幹細胞移植は前処置として大量の抗がん剤を用い,全身放射線照射を行うため,患者は吐き気,嘔吐,口腔粘膜炎,下痢,食欲不振などを経験することが多い.小児における造血幹細胞移植に伴う有害事象に関する報告では,口腔粘膜炎の発生率は約40~80%であり,移植後1週間以内に発生し1週間程度持続する10,11)ことや,下痢の発生率は約90%であり,移植後1週間以内に発生し2週間程度持続すること12)などが報告されている.これらは経口摂取に悪影響をおよぼし,エネルギー摂取量の低下につながる.そのため,症状に応じた食事の工夫が行われる13).広島大学病院では,好中球減少時には普通食から加熱食へ病院食が変更される.病院が独自に設けている加熱食の基準範囲内で持ち込み食も許可している.副作用の症状別に栄養強化された経口補助食品を選択できるおやつメニューを提示し,メニュー選択やその摂取量について個別に提案している.また,年間の行事食に力を入れている.新型コロナウイルス感染症(以下,COVID-19と略)のパンデミック前は,食事バイキングやクッキー作りなどの食品に直接触れることができるイベントを感染予防対策徹底のもと行っていた.COVID-19パンデミック以後は,小児向けの行事食やおやつ提供など目で見て楽しめる食事や幼児食の選択食に力を入れている.長期にわたる入院を余儀なくされ,さまざまなストレスを抱える患者と患者家族にとって,食べたいと思える食事や自分で選ぶことができる食事の提供が重要と考えている.
Evansらは,ENには移植後の移植片対宿主病の発生率の低下や血小板の生着について,非経腸栄養法を超えるメリットがある14)と報告している.造血幹細胞移植を受ける小児の栄養管理に関するガイドラインがない中,Zemraniらは,造血幹細胞移植を受ける原発性免疫不全の小児患者における移植前後の具体的な栄養管理方法をフローチャートにて提案している15).具体的な内容について以下に示す.移植前は体重減少や体重増加不良がある場合,早期に栄養介入し,経口摂取量が必要エネルギー量(estimated energy requirement;以下,EERと略)より低い場合に経口補助食品,EN,PNの順に栄養投与するとともにビタミンや微量元素を補正する.あわせて,移植後の栄養療法について栄養指導し,患者とその家族に理解を促す.移植後は,嘔吐が落ち着き,粘膜炎が始まる前に経鼻胃管を挿入し,栄養状態の悪化もしくは経口摂取量がEERの50~75%未満が3~5日間続いた場合にEN開始,栄養状態の悪化もしくは腸管の使用が困難と予想される場合,および経口摂取量とENがEERの50~75%未満が3~5日間続いた場合にPN開始.PNの適応基準と離脱基準が設けられている.さらに,長期的な栄養学的フォローアップについて言及されている.移植前の栄養介入方法は我々と概ね同様であったが,移植後の段階的かつ体系的な栄養介入方法については,今後の参考とし,栄養学的アプローチの基準を整備する必要がある.造血幹細胞移植を行う患者には,経口摂取量の維持とともに,ENを積極的に検討することが望ましいと考えられる.
小児は成人とは異なり成長・発育段階にあり,治療の初期段階での栄養状態の悪化は治療への影響のみならず,生存率にも影響する7).そのため,体重減少をきたしやすい診断後早期に栄養介入する必要がある15,16).加えて,患者と患者家族の両者に栄養教育を行うことが有効とされている4,15).管理栄養士が,診断後早期から患者と患者家族の両者に関わることで,患者と患者家族の不安軽減にもつながる13).
本研究にはいくつかの限界点がある.第一に,単一施設による後ろ向き研究であるため,対象者が限定的な点である.第二に,栄養介入は主治医の依頼に基づくものであったため,介入時期や介入時の栄養状態にばらつきがあった点である.院内における小児患者の栄養スクリーニング基準の作成が急がれる.第三に,NST介入時と終了時での差を比較している点である.腫瘍の種類により,治療中の体重の増減や体組成の変化の過程が異なることが報告されている3,16).よって,診断後からの栄養状態を縦断的に検討する必要がある.第四に,上腕周囲径や上腕三頭筋皮下脂肪厚などの身体計測,生体電気インピーダンス法を用いた体組成測定を行っていない点である.これらの測定は,筋肉の消耗や脂肪の蓄積を早期に特定することができ,細やかな栄養管理を可能とする16)ため,今後アセスメント項目として導入することが望ましい.
造血幹細胞移植治療を行う患者には診断後早期から重点的な栄養介入を行う必要性が示唆された.栄養不良を認めない早期から,管理栄養士による積極的な栄養介入が小児患者の体重増加不良の抑制につながる可能性があると考えられた.
本論文に関する著者の利益相反なし