2020 年 62 巻 11 号 p. 2980-2988
2020 年 62 巻 11 号 p. 2980-2988
Epstein-Barrウイルス関連胃癌(EBVGC)は,胃癌全体の約9%を占め,リンパ節転移(LNM)頻度が低いことが報告されている.しかしEBV関連の早期胃癌におけるLNM頻度に関するデータは限られており,EBVステータスは内視鏡的粘膜下層剝離術(ESD)の治療適応及び根治性の基準には取り入れられていない.本総説では早期胃癌におけるEBVGCとリンパ球浸潤胃癌(GCLS)のLNM頻度に焦点を当て,ESDの治療適応及び根治性基準の適応拡大の可能性に関する検討を行った.病理学的粘膜下層浸潤EBVGCではLNM頻度は低く(3.3%(6/180),95%信頼区間[CI]:1.2-7.1),特に脈管侵襲陰性例で低い結果であった(0.9%(1/109)).また病理学的粘膜内EBVGCではLNMを有する症例は認められなかった(0%(0/38),95%CI:0-7.6).一方GCLSのLNM頻度は低い結果であったが(5.0-10.6%),EBV陰性のGCLSにおけるLNM頻度は比較的高い結果であった(10.0-20.0%).従ってLNM頻度を考慮する場合,EBVステータスはGCLSよりも重要な要素であると考えられた.EBVGCの臨床病理学的特徴は一般型の胃癌とは異なり,LNM頻度は有意に低い.このグループはESDの有望な治療対象であると考えられ,早期胃癌のESD治療適応及び根治性の基準にEBVステータスを含めた新たな治療ガイドラインの策定が望まれる.
Epstein-Barrウイルス(EBV)は,様々な癌との関連が知られているヘルペスウイルスであり,胃癌の発癌にも強く関与している 1),2).EBV関連胃癌(EBVGC)は腫瘍組織のほぼすべての癌細胞にⅠ型潜伏遺伝子の1つであるEpstein-Barrウイルスencoded RNA(EBER)が高発現しているため 3)~8),組織切片上でEBER-in situ hybridization(ISH)法により検出可能である.EBVGCの頻度は胃癌全体の約9%であり 1),2),9),女性より男性に多く 1),10)~12),発生部位に関しては,噴門部及び胃上部に位置する傾向がある.またEBVGCは癌細胞が小型の腺管構造もしくは腺腔の不明瞭な大小の胞巣を形成し,腫瘍間質及び腫瘍胞巣内に高度なリンパ球浸潤を伴うリンパ球浸潤胃癌(GCLS)と呼ばれる組織像を呈する(Figure 1) 4),13).さらに,EBV陰性胃癌(non-EBVGC)に比較し特に早期胃癌においてリンパ節転移(LNM)頻度が低く予後良好であり 12),14)~16),胃切除後の残胃癌での頻度が高い 1),17),18).一方で有川ら,西川らの報告ではHelicobacter pylori感染に起因する慢性的に炎症を起こした胃粘膜に由来する可能性も示唆されている 19),20).EBVGCの特徴と典型的な内視鏡像をTable 1とFigure 2にお示しする.
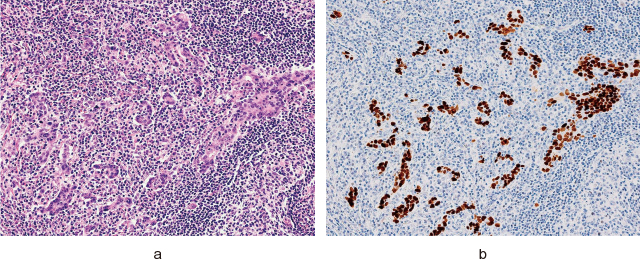
Epstein-Barrウイルス関連胃癌(EBVGC)の組織像(Hematoxylin・Eosin染色)とEBER in situ hybridization像.
a:EBVGCの組織学的特徴である浸潤領域の腫瘍間質及び腫瘍胞巣に高度なリンパ球浸潤を伴うリンパ球浸潤胃癌と呼ばれる組織像を認める.
b:個々の腫瘍細胞にはEBER-ISHで癌細胞の核に強い陽性所見が確認できる.

EBV関連胃癌の主な臨床病理学的特徴.

EBVGCの内視鏡画像の典型例.
a:早期胃癌におけるEBVGCの多くは表面陥凹型の形態をとる.
b:粘膜下層深部浸潤を伴うEBVGCは,浸潤部で著明なリンパ球浸潤により粘膜下腫瘍様の形態を呈する.
2014年に発表されたThe Cancer Genome Atlasプロジェクトによる胃癌ゲノムの網羅的解析で,EBVGCは胃癌の新しい分子サブタイプのグループの1つとして報告された 9).サブタイプは①EBV:CDKN2A遺伝子の抑制,PIK3CA遺伝子変異が特徴,②Microsatellite instability:プロモーター領域のメチル化によりMLH1遺伝子,MSH2遺伝子などのミスマッチ修復遺伝子が不活化され,DNAミスマッチ修復システム障害が生じる特徴,③Genomically stable:組織学的にはdiffuse typeを呈し,E-cadherinの変異/メチル化,RhoA変異が特徴,④Chromosomal instability:組織学的にIntestinal typeを呈し,Human Epidermal Growth Factor Receptor Type2をはじめとした受容体型チロシンキナーゼの部分的な増幅及びTP53遺伝子変異が特徴,の4つに分類されている 9).EBVGCは腫瘍内または腫瘍周囲の免疫細胞浸潤を特徴とし,programmed cell death ligand 1(PD-L1)及びPD-L2をコードする遺伝子を含む染色体のゲノム増幅をしばしば生じ,癌細胞と免疫細胞の双方で強力なPD-L1発現を呈している21).そのため組織及び血中循環DNAで認められるtumor mutation burdenと同様に,免疫チェックポイント阻害剤の有効性の有望なバイオマーカーである可能性が示唆されている 22).
EBVGCは高度のリンパ球浸潤,特に細胞傷害性Tリンパ球を伴う宿主の炎症性免疫反応のため予後が良好であると考えられている 23)~25).また既報では早期胃癌では特にLNM頻度が低いことも報告されている 12),14)~16).早期胃癌の内視鏡的切除適応は,LNM頻度が非常に低く,一括切除に適した腫瘍の場合に考慮される.一方内視鏡的切除術の根治性は,多数の外科切除例の検討から算出されたリンパ節転移の危険性と早期胃癌外科手術の治療成績から設定されている.外科的に切除された病理学的粘膜内癌(pT1a)及び粘膜下層浸潤癌(pT1b)胃癌患者の5年の疾患特異的生存率は,それぞれ99.0%及び96.0%であり 26),27),一方でLNM頻度はそれぞれ3.0%と17.9%と報告されている 27).そのため,pT1a胃癌及びpT1b胃癌の根治性の基準は,LNM頻度の95%CI上限がそれぞれ1%,3%未満である必要がある.早期胃癌に対し内視鏡的切除術が行われた場合,切除された検体の病理学的診断は,根治性の評価のため重要である.内視鏡的切除術後の根治性の基準は,腫瘍径,組織型,浸潤距離,脈管侵襲(LVI),潰瘍形成,切除断端などの病理学的因子で主に構成されている 27).非治癒切除であった場合にはリンパ節郭清を伴う追加外科手術が推奨される 27).現行のガイドラインの基準では,内視鏡的粘膜下層剝離術(ESD)後の追加の外科切除症例のLNM頻度は約10%であると報告されており 28),29),多数の患者は追加外科切除術を必要としない.不必要な追加外科切除術を受ける患者数を減少させ,かつ内視鏡的切除の適応を拡大させるため,治療適応及び根治性の基準のさらなる改善が急務である.本総説では,pT1a EBVGC,pT1b EBVGC及びGCLSに焦点を当て,ESD治療適応及び根治性基準の適応拡大の可能性を検討した.
pT1b EBVGCにおけるLNM頻度を検討した連続症例を用いたコホート研究はわれわれの報告を含め数報のみである.徳永らはEBVGC 170例(9.7%)を含む1,760例の早期胃癌の検討を行った 6).45例がpT1b EBVGCであり,LNMを有する症例は認められなかった一方で,pT1b non-EBVGCではLNM頻度は17.3%(48/278)であった(Table 2) 6).Parkらの同様の対象に行った検討では,pT1b GC 756例のうち,64例(8.5%)がEBVGCであり,LNM頻度は4.7%(3/64)であった 15).LVI陰性例は592例含まれ,うち59例(10.0%)がEBVGCで,そのLNM頻度は1.7%(1/59)であった(Table 2) 15).当院では2016年よりKOSMiC(Knockout SubMucosal invasive gastric Cancer)project:内視鏡的切除適応外の早期胃癌におけるリンパ節転移と関係する臨床病理学的因子に関する研究を行っており,その1プロジェクトとしてpT1b EBVGCのLNM頻度を検討した 12).pT1b GCの898例中,71例(7.9%)がEBVGCであった 12).LNM頻度は,EBVGCはnon-EBVGCよりも有意に低い結果であった(4.2% vs 21.9%,P<0.0001) 12).またLVI陰性EBVGCは,LVI陽性EBVGCよりもLNM頻度が有意に低い結果であった(0/50,0%;vs 3/21,14.3%,P=0.023) 12).多変量解析では,non-EBVGCが独立したLNMリスク因子であることが示された(オッズ比:3.88,P=0.027)(Table 2) 12).これらの結果はpT1b EBVGCにおいても,LVIがLNMリスクの重要な因子である一方でLVI陰性pT1bEBVGCは極めてリンパ節転移頻度が低く,ESDの有望な治療対象であることが示唆された(Figure 3).この結果をさらに多数例で検証するため,LVI陰性pT1b EBVGCのLNM頻度に関する多施設共同観察研究を行った 30).pT1b EBVGCは847例中96例(11.3%)に認められ,LNM頻度は,EBVGCがnon-EBVGCに比較し有意に低い結果であった(1.0%(1/96),95%CI:0-5.7 vs 9.5%(71/751),95%CI:7.5-11.8;P=0.003) 30).しかし現行の治療ガイドラインに沿った場合,pT1b GCの根治性の基準は,LNM頻度の95%CI上限が3%未満である必要がある 31)が,本検討では,LVI陰性pT1b EBVGCのLNM頻度の95%CI上限が5.7%であった 30)ため,ガイドラインの変更の根拠とするには不十分な結果であった.そのため全国規模のさらなる多施設,多数例での検討が必要と考えられる.上記で述べたように研究の限界はあるものの,EBVステータスは,ESDの適応及び根治性の基準の有望な候補となりうる.早期胃癌においてEBVGCが疑われる場合の診断及び治療戦略案をFigure 3にお示しする.

連続症例を用いたpT1bEBV関連胃癌のリンパ節転移頻度に関する文献レビュー.

cT1 N0 EBVGCの診断及び治療戦略.
cT1 N0胃癌の生検診断でGCLSまたはLace patternが認められる場合,EBER-ISHを行う.Non-EBVGCであれば,現在の治療ガイドラインに基づいた治療を行う.EBVGCでは内視鏡的粘膜下層切除術を先行し,病理学的所見が以下の条件(垂直断端が陰性,脈管侵襲陰性,pT1b胃癌で腫瘍サイズ≤30mm)を満たす場合,組織型及び粘膜下浸潤距離を問わず経過観察を推奨する.
pT1a EBVGCにおけるLNM頻度を検討した連続症例を用いた大規模コホート研究はpT1b EBVGCと同様に数報のみである.徳永らはpT1aEBVGCの170例(9.7%)を含む1,760例のpT1aGCのLNM頻度に関する検討を行った 6).このうち30例がpT1a EBVGCであり,LNMを有する症例は認められなかった 6).一方pT1a non-EBVGCのリンパ節転移頻度は1.8%(5/284)であった(Table 3) 6).さらに,Limらは,pT1a EBVGC 32症例においてLNMを有する症例は認められなかったと報告している 25).しかし,これら2つの報告には,LNM頻度が非常に低いESDの根治性の基準を満たす症例が含まれているため解釈に注意が必要である.本邦では村井らはpT1a EBVGCの内視鏡的及び臨床病理学的特徴について検討を行っている(Table 3) 16).pT1a GC 173例中,8例(4.6%)がEBVGCであり,いずれの症例においてもLNMが認められなかった 16).肉眼型は陥凹型が多く,組織型は中分化腺癌と低分化腺癌の組織混合型の症例が多く認められた 16).さらに,粘膜内では不規則な網目状吻合腺菅からなるlace patternや間質・腫瘍胞巣内のリンパ球浸潤が認められた 16).EBVGC症例の8例中5例(62.5%)がESDの現在の根治性の基準を満たさず,現行のガイドラインに基づき追加外科切除術が施行されている 16).併存疾患を有する症例など手術合併症や,手術死亡リスクの比較的高い患者において追加切除術を回避できる可能性があり,頻度は低いがpT1aGCであっても,EBVステータスを確認することは有益である.
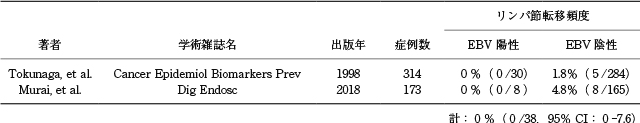
連続症例を用いたpT1aEBV関連胃癌のリンパ節転移頻度に関する文献レビュー.
リンパ球浸潤胃癌(GCLS)は,胃癌取扱規約第14版では「癌細胞が著明なリンパ系浸潤を背景にして,充実性,腺房状あるいは腺腔形成の明らかではない小胞巣状に増生する低分化腺癌」と記載されている.一方で標準化された組織学的診断基準はない.GCLSの発生頻度は全胃癌症例の約1%から4%で,GCLS症例の80%以上がEBV感染に関連している 32)~34).GCLSの臨床病理学的特徴として,LNM頻度が低く予後が良好であるとされている 23),35).腫瘍細胞に対する宿主の免疫応答を反映する腫瘍浸潤リンパ球の増加が,生存率の改善と関連していることが理由の1つとして報告されている 23),36),37).GCLSには2種類の病態,すなわちEBVGCとマクロサテライト不安定性を高頻度に示す(MSI-H)胃癌である 37).GCLSにおけるMSI-H胃癌の占める割合は約7%から39%と報告されている 37).Limらは全病期でEBVステータス別のGCLSのLNM頻度を報告した 35).GCLS 274例中,EBV感染が確認された236例(EBV GCLS)(86.1%)及びEBV陰性の38例(non-EBV GCLS)(13.9%)の検討で,疾患特異的10年生存率は,EBV GCLSで89.1%,non EBV GCLSで66.9%であった(P=0.009) 35).non EBV GCLSでは,一般組織型の胃癌患者と同様の臨床的及び病理学的特徴及び生存期間を有することが明らかとなった 35).さらに,Limらは早期胃癌におけるGCLSのLNM頻度に関して検討を行った 25).GCLSが確認された241例中,33例(13.7%)がpT1a GCLSであり,208例(86.3%)がpT1b GCLSであった 25).GCLSは若年男性,胃上部に病変が多い傾向があり,EBV感染との関連性が高く(89.2%),LNM頻度が低い結果であった 25).GCLS症例の5年間の疾患特異的生存率は98.3%であり,LNMの有無(P<0.001)とEBVステータス(P=0.039)において有意差を持って生存率が異なる結果であった 25).pT1a GCLS及びpT1b GCLSにおけるLNM頻度は,それぞれ0%(95%CI:0-9.1)及び10%(95%CI:6.8-15.2)であった 25).さらにShinらは,早期GCLSの臨床病理学的特徴及びESDの実現可能性に関する検討を行っている 38).全GCLS例の81.4%がEBVGCであり,non-GCLSと比較して,GCLSは隆起型の肉眼型頻度が高く(34.3% vs 18.0%,P=0.003),近位側に位置し(37.1% vs 9.7%,P<0.001)腫瘍径は有意に小さい結果であった(2.1±1.1 vs 3.1±2.0cm,P<0.001) 38).また粘膜下層浸潤割合が高く,浸潤距離も長い結果であった(77.1%対44.4%,P<0.001) 38).外科治療を受けたGCLS症例のうち,2症例(3.4%)のみがLNM陽性であり,non-GCLSよりLNM頻度は低かった(4.0% vs 19.4%,P=0.007) 38).これらの結果により,GCLSにはEBVGCが多く,早期胃癌においてはnon-GCLSよりLNM頻度が低いことが示された.
前述のように,GCLS発生頻度は全GC症例の約1%から4%の間であると報告されており,GCLS症例の80%以上がEBV感染に関連している 25),35),39).またGCLSにおけるMSI-H胃癌の割合は7%から39%の範囲であると報告されている 37).既報では,粘膜下組織のGCLSと粘膜内のLace patternの2つの組織学的特徴がEBV陽性と密接に関連していることが指摘されている 12).これらの2つの特徴の重要性は以前に多くの研究で報告されている 13),32),39)~42)が,それらの感度と特異度は十分に明らかになっていない.われわれの検討では,EBVGCの84.5%(60/71)の症例でGCLS,Lace patternのいずれかないし両方を認め,EBVGCがこれら2つのうち少なくとも1つの特徴を有する感度と特異度は75%と98.7%であった 12).従って内視鏡的に切除された標本におけるこれら2つの特徴に対する組織学的評価は,EBER-ISHを実施すべきかどうかを判断する上で有用である可能性がある.ただし,これらの特徴はEBVGCの約15%には認められず 11),組織学的所見のみからEBVGCを正確に特定することは時に難しい.GCLSとLace patternを認めないEBVGCの組織型は低分化腺癌または中分化腺癌・低分化腺癌の混在癌が多い結果であった.組織型が低分化腺癌または混在癌の場合には,GCLSとLace patternを認めない場合においてもEBER-ISHを行い,EBVステータスを確認することが肝要である.EBVGCとGCLSは大部分がオーバーラップしており,LNM頻度が低いという共通した特徴を有する.しかしnon-EBV GCLSでのLNM頻度は約20.0%と高く 25),EBVステータスはLNM頻度に関してGCLSよりも重要な要素であると考えられた.
EBVGCにはnon-EBVGCとは異なる特徴を有し,特に早期胃癌においてLNM頻度が非常に低い.早期胃癌におけるEBVステータスは,ESDの適応と根治性の基準の1つとなりうる有望な因子と考えられる.
本論文内容に関連する著者の利益相反:著者の河内洋は英文誌Digestive Endoscopyの編集委員です.その他の著者は,この論文に関連し,開示すべきCOIはありません.