日米における内視鏡診療において病理診断や診断の定義に相違があることは知られている.生検法や治療法が日米で異なる理由としては,早期消化管癌を内視鏡で診断し局所治療で制御する概念の本邦と,癌を発癌素地として考えランダム生検後に広範囲へ治療を行う概念のアメリカの相違が一因と思われる.ESDの対象疾患としては日本では食道扁平上皮癌やヘリコバクターピロリ感染を基とした腸上皮化成由来の分化型胃癌の比率が高いのに対し,アメリカではBarrett食道由来の食道腺癌やヘリコバクターピロリ非感染胃の胃癌の比率が高く,また最近sessile serrated polyp(SSP)も多く発見・治療されている.
ESDを取り巻く環境因子としては,本邦での内視鏡医による麻酔に対して,アメリカでは麻酔医や麻酔看護師によるサポートが可能である点が大きく異なっている.その他,健康保険や入院に対する考え方の相違も大きく,アメリカでESDを展開する際の注意すべき点である.
今後グローバル化が進むにつれ,さらにESDを含む本邦の内視鏡診療が世界中に普及することが望まれる.
消化管腫瘍に対する内視鏡的粘膜下層剝離術(endoscopic submucosal dissection:ESD)は2000年代に日本で開発されて以来,その高い治療効果から世界に広く普及してきた.アメリカでは本稿で後述するような様々な理由からアジア・欧米諸国と比較すると導入が遅れ気味であったものの,日本からの報告やハンズオンセミナー開催などから,近年になり一気に普及しつつある.2019年現在,ESDのデバイスはほとんどのものがアメリカでも使用可能であるものの,アメリカは医療システムや疾病構造を含め本邦とは根本的に多くの点が異なるために,未だにESDを取り巻く環境に多くの違いがあるのが現状である.本稿では日米のESDを取り巻く環境の差異について考察する.
日米の内視鏡治療の違いを述べる際に避けて通れないのは消化管における腫瘍性病変に対する病理診断の相違である.日本では病理学的に生検組織や切除標本において細胞異型(cellular atypia)と構造異型(structural atypia)を基に癌の確定診断を行い上皮下への浸潤の有無を問わないのに対し,アメリカでは病理学的に粘膜下層への浸潤を認めるものを癌と診断し,非浸潤性の腫瘍をlow grade dysplasia(LGD)/high grade dysplasia(HGD)と診断してきた.これを解消するためのVienna分類で用語の統一化が定められたものの 1),未だに同じ病変でも日本では粘膜内癌,アメリカではHGDと診断される傾向が強く,病理学的診断の完全な統一には至っていない.このことは両国から発表される癌の内視鏡治療の定義やアウトカムが微妙に異なっていることに繋がっており,徐々に歩み寄りは見られつつあるものの病理学的定義の完全な合意への道筋は明らかではない.
その他の相違で有名なものとして,柵状血管の下端をもって胃食道接合部(esophagogastric junction:EGJ)としEGJより口側へ延伸した円柱上皮が存在する食道をBarrett食道としている本邦に対し 2),アメリカでは生検により特殊円柱上皮(specialized columnar epithelium;SCE)の存在がBarrett食道の確定診断には必須である点も異なる.
消化管癌の深達度診断については国際的な整合性が図られつつあり両国間の差異は少なくなりつつある.しかしわが国の長年のデータの蓄積から例えば食道癌においては日本の食道癌取り扱い規約でT1aはTis,T1a-LPM,T1a-MMとサブタイプに細分類され,T1bもT1b-SM1~SM3まで分けられている点 3)でアメリカにおけるAmerican Joint Committee on Cancer(AJCC)第8版と異なっている 4).
一方胃癌における深達度診断においては,AJCCでは日本にないHGDの用語が存在する.これは上皮内癌を指すTisと同義でありAJCCにも記載されているもののアメリカの病理医はTisではなくHGDという診断名を下すことがほとんどであり,日本でいう粘膜内癌への翻訳が必要である.大腸癌の病理診断においても日本ではTis,T1a,T1bと細分類されているT1はアメリカではTisとT1のみである点など日米で未だに統一されておらず両国からの臨床データの解釈が異なる一因となっており,将来の統一化が待たれる.
内視鏡診断においては,日米で色素内視鏡や拡大内視鏡の違い,また生検方法の違いが挙げられる.日本では胃病変に対するインジゴカルミンや食道病変に対するルゴール,胃の腸上皮化生に対するメチレンブルー,大腸病変に対するクリスタルバイオレットなどが用いられている.これに対しアメリカでは胃の腸上皮化生に対するメチレンブルーや炎症性腸疾患に対するサーベイランス内視鏡でのメチレンブルー・インジゴカルミンは盛んに用いられている 5)ものの,日本と同様の80~100倍の光学拡大内視鏡は普及していないためにクリスタルバイオレットを用いた色素拡大内視鏡はほとんど行われていない(NBIおよびDual focus搭載スコープは利用可能である).そのためにアメリカでは食道学会新分類や胃癌におけるVS classification 6),大腸腫瘍に対する工藤分類,JNET分類は臨床の現場ではほとんど普及しておらず,未だに消化管腫瘍の内視鏡診断学は日本のほうが遥かにリードしている.
このことは生検の違いにも表れている.本邦では通常観察後に色素観察,NBI拡大観察を行って画像診断を行った上で狙撃生検することが一般的であり 7),検体は一つ一つ毎に個別の病理検査用カセットに入れられる.これに対しアメリカではBarrett食道に対する2-3cm毎の4点生検や胃の腸上皮化生に対するランダム生検が広く行われており,一つの鉗子で複数箇所生検することや,複数の検体を一つの容器に入れることが一般的である.この理由として,アメリカではBarrett食道や遺伝性消化管疾患,炎症性腸疾患からの発癌を発癌素地(field defect,field cancerization)として捉えており,そのために治療法もfieldとしての焼灼や全摘を含めた外科治療が治療の考え方の根底であるために 8),9),治療の概念の違いが生検の慣習の違いに繋がっている.
光学内視鏡による診断学を追求するスタンスの日本に対し,近年アメリカではVolumetric Laser Endomicroscopy(VLE)が主にBarrett食道の分野で普及しつつある.VLEはレーザー内視鏡装置の一種で,通常の内視鏡のチャンネルから挿入されたバルーンを通じて消化管(特に下部食道)内から3mmの深さを均一にスキャンするもので,食道を長軸に渡り横断面で長さ10cmに渡ってスキャンすることが可能である 10).後述する日米の疾病構造の違いが診断内視鏡のスタンスの違いに反映されている.
アメリカを構成する人種は多種多様であり,また生活習慣の違いからも日米両国では疾病構造が異なる.一般的に本邦はピロリ関連胃癌が多く,またアメリカは胃癌が少なく大腸疾患が多いと認識されている.Figure 1に当院における1年間のESDの内訳(2018年6月~2019年5月)を示す.Figure 1に示すようにアメリカにおいても胃ESDは2割近くあり,また十二指腸症例も12%と比較的需要が高い傾向であった.当院はがん専門病院であり他国から治療に来る患者や遺伝性疾患患者も数多く扱っているために選択バイアスがあるものの,一定数の上部消化管のESDがあることが示されている.ここでは各臓器における日米の疾病構造の違いとアメリカにおけるESDの実際を述べる.

メモリアルスローンケタリングがんセンターにおける全ESD(2018.6.1~2019.5.31).
本邦の食道癌の9割以上は喫煙やアルコールを危険因子とした扁平上皮癌が主流であり,腺癌は増加しつつあるとはいえ2011年で5.3%の割合とされている 11),12).一方,アメリカを含む欧米諸国では喫煙率の低下や肥満・胃食道逆流症(GERD)の増加などに起因するとされるBarrett食道および食道腺癌が増加しており,ヨーロッパでは1997年から2002年まで65%増加していると報告されている 13).Barrett食道の有病率は全米人口のうち1.8%とされており,Barrett食道のサーベイランス内視鏡およびBarrett食道合併LGD/HGDに対する内視鏡的切除術,ラジオ波焼灼(radiofrequency ablation;RFA)への需要が極めて高い.RFAはその高い治療成績と安全性から,全米総合癌センターネットワーク(National Comprehensive Cancer Network;NCCN)の食道癌ガイドラインにおいては早期(Tis)の腺癌のみならず扁平上皮癌に対しても内視鏡的治療とともにcryotherapyやphotodynamic therapy (PDT)とともに治療手段の一つとして推奨されており 14),粘膜切除術を重視した日本の治療方針とアプローチが異なっている.
胃胃においてはわが国では胃癌の9割以上がH. pylori感染に基づくものとされており,胃癌の発生に大きく寄与していることが明らかになっており 15),実臨床でも萎縮性胃炎を背景とした分化型胃癌のESDの需要が極めて高い.他方,アメリカではH. pylori感染の割合は25.3%とされており 16),胃癌の罹患率も2016年には年間23,695人とされている 17).このように胃癌自体が全癌の第15位とされているために日本のような市町村による胃癌検診が存在せず,早期胃癌で発見されて内視鏡治療に回ってくる症例が極めて少ない.またアメリカではH. pylori感染以外による胃癌の割合も多く,germline mutationであるCDH1やSMAD4変異による胃癌も散見され 8),日本の内視鏡的診断学をそのまま適応できないことも多い.当院はがん専門病院であるためにアメリカの中でも比較的胃癌が多く,日本と同様の早期胃癌症例を経験する.ただ,早期胃がんに対するESDはアメリカにおけるデータが少ないためにESDガイドライン 18)が存在せず,ESD後の追加切除の議論の際には日本のガイドラインを参考にしているのが現状である.今後症例が集積し,アメリカ人を対象としたエビデンスによるガイドラインの策定が待たれる.
十二指腸アメリカにおける十二指腸疾患でESDに関連する重要なものの一つに家族性大腸ポリポーシス(Familial Adenomatous Polyposis:FAP)が挙げられる.FAPはAPC遺伝子の生殖細胞系列変異(germline mutation)を原因とする常染色体優性遺伝性の症候群であり,胃や十二指腸,大腸の多発性腺腫を特徴とし,大腸癌以外では十二指腸癌とデスモイド腫瘍は主な死因である 19).FAPの全人口に対する発生頻度は日本では1:17,400であるのに対しアメリカでは1:10,000とされている.十二指腸腺腫もFAPに随伴する腫瘍性病変として重要であり,当院でもFAPの十二指腸病変に対するESDの需要は高い.アメリカでは大きな十二指腸腺腫は分割EMR,もしくは手術(局所切除やWhipple手術など)が行われることが一般的であるために,十二指腸ESDを行っている施設は日本人医師のいる施設 20)を除くと極めて少ない.本邦では十二指腸病変に対するESDは遅発性穿孔予防の観点から術後の縫縮術が一般的になってきており 21),当院でも十二指腸ESD後に糸付きクリップで縫縮術を行っている(Figure 2,3,4).

十二指腸第3部の半周を占める腺腫.

ESD後.

糸付きクリップによる縫縮.
大腸疾患において消化器診療の日常において重要な遺伝性疾患の一つとしてLynch症候群が挙げられる.Lynch症候群はミスマッチ修復遺伝子(MLH1,MSH2,MSH6,PMS2)の変異による大腸癌,胃,小腸,卵巣,子宮内膜,肝胆道系などの癌リスクをもたらす常染色体優性遺伝性疾患であり,大腸癌の生涯発癌リスクは30-74%とされている 22).日本における患者数は100,000人以上とされており,大腸癌による死亡が最も多い 23).一方,アメリカにおけるLynch症候群の頻度は1:279程度と見積もられており 24),年間推定133,000人がLynch症候群関連の大腸癌と診断され,その多くが45歳前後で発症する.Lynch症候群においては腺腫から大腸癌に進展するスピードが1~3年と速いために,20-30代から1-2年毎の大腸内視鏡が推奨され 25),5mm以下の腺腫でも切除の対象とされている 26).当院をはじめとする癌専門病院では大腸腫瘍切除後のミスマッチ遺伝子変異の検査は日常診療として行われており,またLynch症候群をはじめ多くの遺伝性疾患のサーベイランスも行っている理由から多数の症例が集積する傾向があるために表面型大腸腫瘍に対するESDの需要は高い.実際,当院でこの1年間に施行した大腸ESDのうち,15.4%もの症例でMLH1+,MSH+,MSH6+,PMS2+であり,ミスマッチ遺伝子異常の患者の割合が多く含まれていた.ミスマッチ遺伝子異常については早期大腸癌の内視鏡治療のみならず進行・再発大腸癌においてDNAミスマッチ遺伝子欠損を認める場合(dMMR)では従来の化学療法の効果が薄く,NivolumabやPembrolizumabなどの免疫チェックポイント阻害薬の効果が高いことは臨床上重要であり 27),大腸癌術前に見つかった他部位の大腸腺腫の場合は切除範囲のみならずミスマッチ遺伝子も含めた治療法が検討される.
これと同様に,下部消化管診療において本邦よりも頻度の高いものに炎症性腸疾患が挙げられる.近年日本では炎症性腸疾患の患者数が顕著に増加傾向であり2013年には16万人を超えている 28).かたやアメリカでは全人口の1.3%(300万人)程度が罹患していると言われ 29),IBD関連大腸癌やその前癌病変であるhigh grade dysplasia(HGD)を経験することが非常に多い.炎症性腸疾患関連のdysplasiaや早期癌に対するESDに対する報告は散見されるようになっているものの 30),31)アメリカでは通常,サーベイランス内視鏡でのランダム生検でHGDを認めれば大腸全摘を行うことが一般的である.以下に当院で行った,HGDを合併した長期間罹患のクローン病症例に対する大腸ESDを示す(Figure 5,6,7).同様の症例は現在増加しつつあるが,長期的な臨床的アウトカムについて今後のエビデンスの構築が待たれる.
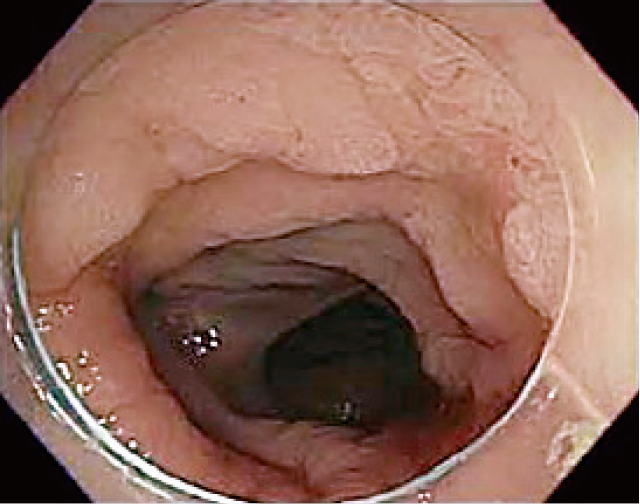
クローン病長期罹患歴のある56歳男性における半周以上を占めるS状結腸腺腫.他院で大腸全摘を勧められ来院.

S状結腸ESD.厳しい線維化を認める.
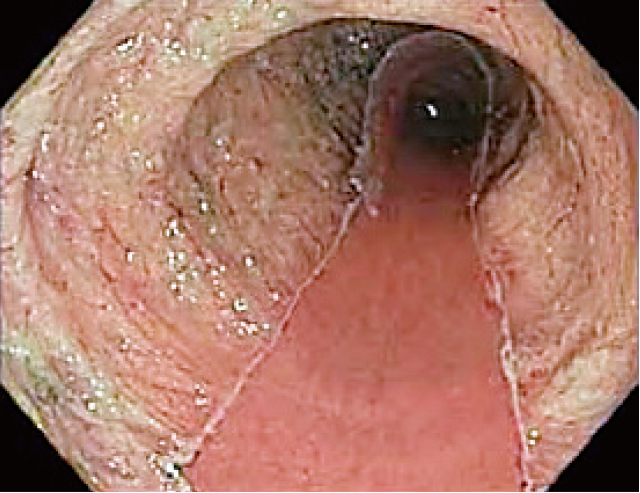
ESD後.Sessile serrated lesion with dysplasia.根治切除.
その他,アメリカでの大腸ESDの特徴に,前医での点墨や部分的な内視鏡治療後の遺残再発症例が多いことが挙げられる.これらに対しては牽引法やpocket creation methodによるESDが有効であると報告されている 32)~34).今後ESDが浸透するにつれ徐々に紹介医による点墨や部分的なポリペクトミーは少なくなると思われるが,現時点ではアメリカで大腸ESDを行うに際し点墨や瘢痕症例への対応が求められる(Figure 8,9,10).
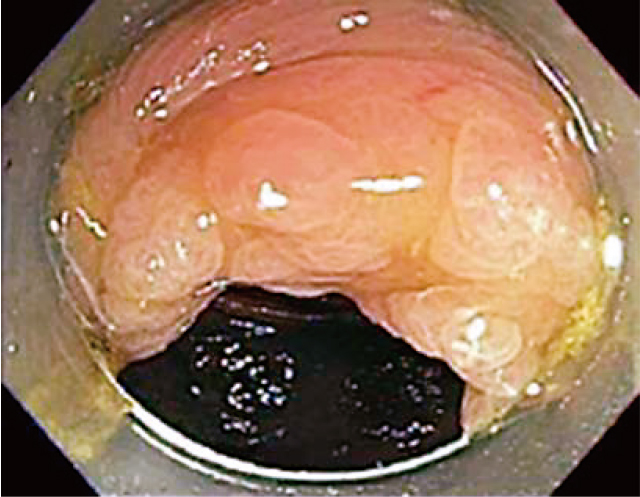
潰瘍性大腸炎既往患者の点墨後病変(下行結腸,腺腫).

線維化を伴った粘膜下層に広範囲に点墨を認める.

ESD後.剝離面が点墨のために黒く変色している.
日本でも近年使用が広がりつつある消化管縫縮デバイスの一つにOver The Scope Clip(OTSCⓇ,Ovesco,Germany)があり,従来から報告されてきた留置スネアとクリップによる粘膜縫縮法 35)とともにESDで粘膜欠損部や穿孔後のトラブルシューティングの際に用いられる 36).一方アメリカでは近年さらに多様な消化管縫縮デバイスが登場している.ESD困難例に対しては先端フードやpocket法 34),牽引などであくまでも穿孔を避けて一括切除を目指す本邦に対し,アメリカでは穿孔を気にせずに全層切除を行い,切除後に粘膜欠損部や穿孔部をOverStichTM(Apollo Endoscopy,USA)などで縫縮するコンセプトが広まりつつある 37),38).さらに近年,大腸に対してfull-thickness resection and diagnosis tissue acquisition(FTRDⓇ,Ovesco, Germany)が欧州やアメリカで認可された.これは大腸の瘢痕病変や再発症例を適応に謳っており,瘢痕部分も含めてクリップで全層縫縮後に切除するもので,サイズには制限があるもののnon-lifting signを呈する瘢痕病変に対する新たなアプローチ法として注目されている(Figure 11,12) 39).

対象病変をキャップの中に牽引し,OTSCで全層にクリップをかけた状態.
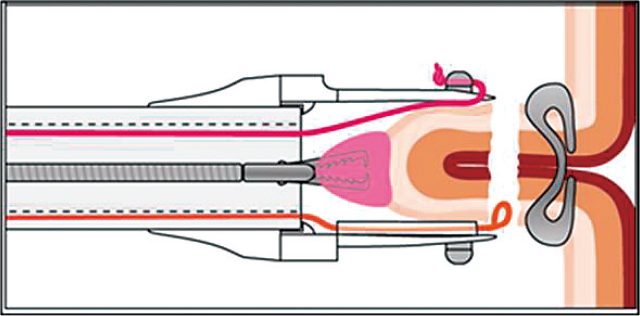
OTSCをかけた対象病変を装着してあるスネアで切除した状態.
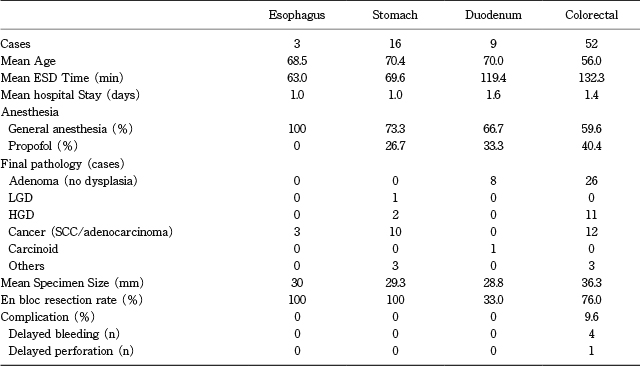
Table 1にこの1年間の当院におけるESDの詳細を示す.2018年6月1日にESDを立ち上げ,2019年5月31日までの1年間でESD総数は80件であった.平均年齢は60.2歳(男性45名/女性35名),麻酔に関しては全身麻酔54件,プロポフォールによる麻酔は26件であり,全例が後述する麻酔認定看護師(Certified Registered Nurse Anesthetists;CRNA)や麻酔科医による麻酔であった.
当院における1年間のESD実績(2018年6月~)2019年5月).
食道ESDは3例で全例(100%)を全身麻酔で施行し,平均ESD時間は63分であった.うち2例がBarrett食道由来の食道腺癌,1例は中東からの患者であったが本邦と同様の扁平上皮癌(SCC)であり,すべての症例で1泊の入院期間であった.平均切除径は30mmで一括切除率100%,合併症を認めなかった.前述のように9割が扁平上皮癌である本邦とは疾病構造が違い,Barrett食道に対する診断と治療の需要が非常に高いためにアメリカでのESDは腺癌が主体となる傾向がある.ニューヨークでは多数の医療機関がBarrett腺癌のサーベイランスおよびラジオ波焼灼術(RFA)を行っているためにBarrett症例は分散される傾向にあり,Barrett腺癌に対するESD後のアウトカムを出すことが今後の課題である.
胃ESDは全16例で平均ESD時間は70.4分,全身麻酔は73.3%,静脈麻酔は26.7%であった.病理結果は腸上皮化成に伴うLGD1例/HGD2例,早期胃癌10例で,その他の腫瘍として全層切除を行った胃粘膜下腫瘍(GIST,RCC)が1例ずつあった.一括切除率は100%,平均在院日数は1.0日で合併症を認めなかった.分化型早期胃癌に対するESDの需要が高い本邦と比べ症例数は少ないものの,胃ESDがこの1年間で全体の2割近くを占めたことはアメリカでも特に癌専門病院では早期胃癌の内視鏡治療の需要が一定数あることが示されている.遺伝性胃癌の家族歴を持つ症例のサーベイランス内視鏡におけるランダム生検で胃癌が検出されたために内視鏡治療に回ってくる症例もおり,果たしてそのような症例に対しESDが将来的な胃全摘を先延ばしできるのかどうか,またサーベイランス内視鏡の質の問題など今後の課題が残されている.
十二指腸は全9件で,平均ESD時間は119.4分,全身麻酔は66.7%,静脈麻酔は33.3%であった.うち8例がadenoma,1例がカルチノイドであり,8例中5例が3rd portionの病変であった.平均腫瘍サイズも2.9cm(17-40mm)と半周以上の大きめな病変が多く,また長時間のESDは内視鏡室スケジュールの問題で避けねばならないためにスネアリングに移行した症例も多かったために一括率は33.3%であった.合併症は0%で平均在院日数は2日間で全例退院した.十二指腸病変においてはFAPやLynch症候群で経過観察中の症例や他院で部分的にEMRを試みられた症例などが含まれ,深部病変や瘢痕症例が多く本邦よりも一括切除が困難な症例が多い印象であった.アメリカでは医療費の高騰や入院に対する社会的な問題により平均在院日数が極めて短いのが特徴であり,切除後の縫縮を積極的に行うことが重要である.
大腸病変は計52例で全体の65%を占めた.平均ESD時間は132.3分,全身麻酔は59.6%,静脈麻酔は40.4%であった.うち腺腫26例,HGD11例,腺癌12例であった.平均腫瘍径は36.3mmで一括切除率76.0%と低めであった.合併症は9.6%(後出血4例/遅発性穿孔1例)であり平均在院日数は1.4日であった.大腸病変も十二指腸と同様に他院で部分的にスネアリングを試みられた症例や点墨された症例が数多く含まれ,日本よりも技術的に困難な病変が多いのが特徴であった.
日本と違う点として,アメリカの多くの教育病院では内視鏡室に麻酔医や麻酔看護師(CRNA)が日常的に麻酔を行う環境にある点が挙げられる.アメリカ内視鏡学会もガイドラインにおいて,特に侵襲的な内視鏡においては麻酔科医が麻酔を行うことを推奨しており,プロポフォールもしくは挿管下での全身麻酔を容易に行うことが出来るために 40),長時間のESDでの誤嚥予防や急変時緊急挿管などの際には安全性が高い.その反面,保険制度の違いから日帰りもしくは1-2日の短期入院での退院を求められることが多く,クリティカルパスなどでESD後3-5日の入院が主流である日本とは入院事情は異なっている 41).遅発性穿孔や遅発性出血予防に対しては前述の縫縮デバイスを用いた縫縮を行う施設も増えているものの,どのような症例で日帰りESDや早期退院が可能であるか,また遠方の患者の場合,退院後のフライト時期などまだエビデンスが少なく不明な点が多い.当院では病院のWebサイトにてESD前後の注意点を公開し,連絡すべき症状および緊急連絡先などを明記している( https://www.mskcc.org/cancer-care/patient-education/about-your-endoscopic-submucosal-dissection-esd-colonoscopy-sigmoidoscopy).ただ医療経済的な観点からは日米どちらにおいても内視鏡治療のほうが外科治療よりも優れていることは認識されており,医療費の高騰が問題になっているアメリカでも内視鏡治療が今後ますます重視されることが想定される 42),43).
近年,日本では消化管診断学にAIが盛んに応用されており研究が進んでいる 44)~46).一方,アメリカでは前述のVLEにAI機能が搭載されたデバイスが登場したほか 47),内視鏡の結果やESD後の病理結果に加え癌のstageや遺伝情報などを総合的に加味してAIが治療方針のdecision makingを行う試みが進行中である 48).
ESDを取り巻く環境について様々な観点から日米の違いを考察した.ESDは今現在でも欧米・アジア諸国で広がりつつあり,診断学と手技に関しては未だ日本が遥かに先んじているものの,全層切除や縫縮に対する近年の欧米のベンチャー企業のデバイス開発のスピードには目を見張るものがある.かつて外科の世界で開腹手術から腹腔鏡へ移行したように,ポストESD時代に備えて海外の動きを注視して行くことが重要である.
本論文内容に関連する著者の利益相反:西村 誠(Boston Scientific)