第1部 食道扁平上皮癌
第1章 食道扁平上皮癌の術前診断と内視鏡切除適応
【序説】
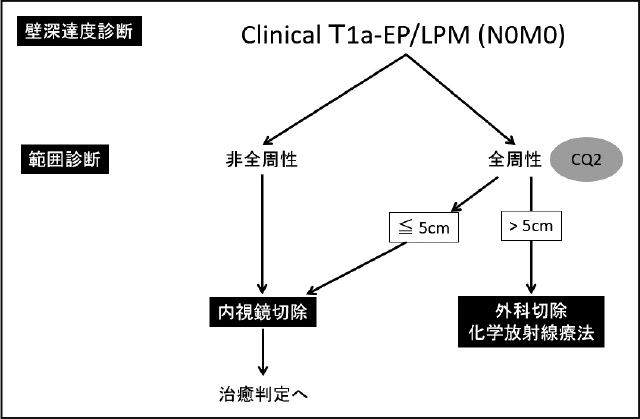
食道表在扁平上皮癌では,術前に壁深達度や病変範囲,転移の診断により進行度を評価し,治療方針を決定する.食道癌診療ガイドライン2017年版(第4版)
1)では,食道癌深達度診断に関するシステマティックレビュー
2)において,EUSおよび拡大内視鏡が非拡大内視鏡と比較してやや高い診断精度を有していたため,深達度診断において“非拡大内視鏡に加えてEUSもしくは拡大内視鏡による精査が弱く推奨”され,clinical T1a-EP/LPM癌が内視鏡切除の適応とされている.また,病変範囲診断では内視鏡切除範囲は狭窄リスクと密接に関連するため“術前に周在性の評価を行うことが強く推奨”され,周在性が広い場合には内視鏡的切除後狭窄の可能性があることが記載されている.範囲診断には画像強調拡大内視鏡やヨード染色が推奨され,ヨード染色はより明瞭に病変境界を描出できる.しかし高濃度のヨード液を使用すると,表層上皮が剝離し,それ以後の診断が困難となることがあるため,1%程度以下の低濃度ヨード液の使用が勧められる.
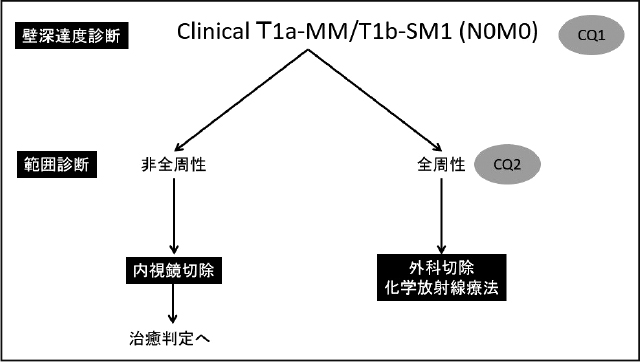
一方,食道癌診療ガイドラインの内視鏡治療の章では,T1a-MM/T1b-SM1癌は内視鏡切除の相対適応とされているが,T1a-MM/T1b-SM1の診断がclinicalなものかpathologicalなものかは明確にされていない.Clinicalな診断とpathologicalな診断には,相当の乖離が生じるため分けて扱う必要がある.前述したように本ガイドラインでは内視鏡切除の適応はclinical診断,治癒判定はpathological診断に基づき記載することとしているが,clinical(c)T1a-MM/T1b-SM1癌に対する内視鏡切除の妥当性は,これまであまり検討されていない.また,狭窄のリスクが非常に高い全周性食道癌に対する内視鏡切除の位置付けも明確ではない.そこで本章では,これらに関連するclinical question(CQ)に対してシステマティックレビューを行い,推奨を作成した.推奨のまとめを以下に図示する(Figure 1,2,3).
CQ1:術前診断でcT1a-MM/T1b-SM1(N0M0)の非全周性の食道扁平上皮癌に,初回治療として内視鏡切除は推奨されるか.
推奨文:術前にcT1a-MM/T1b-SM1と診断した非全周性の食道扁平上皮癌に対して,初回治療として内視鏡切除を行うことを弱く推奨する.
修正Delphi法による評価:中央値9,最低値8,最高値9
エビデンスの強さ:C
解説:内視鏡切除の適応は主に術前の深達度診断により決定される.cT1a-MM癌(以下,cMM癌)は内視鏡切除の相対適応とされているが,切除後の組織所見でpathological(p)EP/LPM,脈管侵襲陰性と診断されれば,治癒切除と判断される.一方,食道癌診療ガイドライン2017年版では,cT1b癌で耐術能があれば,外科切除または化学放射線療法が推奨されている.しかし,cT1b-SM1癌(以下,cSM1癌)と診断されても,外科切除後にpT1a-MM以浅である場合もあり,この場合には低侵襲治療である内視鏡切除で十分であった可能性も否定できない.そこで,cMM癌やcSM1癌に内視鏡切除を行うことが推奨されるかどうかが明確になれば,その後の治療方針決定の大きな助けとなるため,これら癌に対する内視鏡切除の有効性について検討した.なお,内視鏡による術前診断でcMM癌とcSM1癌を明確に鑑別することは困難であるため,ここでは両者を同一カテゴリー,すなわちcMM/SM1癌として扱った.
術前にcMM/SM1癌と診断された食道表在扁平上皮癌に対して内視鏡切除と他の治療法の成績を比較検討した論文は文献検索で抽出されなかった.cMM/SM1癌を外科切除もしくは内視鏡切除し,その病理結果を検討した研究に関して文献検索を行ったところ,PubMed:262編,Cochrane:15編,医中誌:78編の論文が抽出された.この355編を一次スクリーニングにかけ,さらに57編を二次スクリーニングにかけて,最終的に7編の論文
3)~9)を対象にシステマティックレビューを行った上で,追加治療としての化学放射線療法を施行した論文
10)や内視鏡切除と外科切除を比較した論文
11),12)を加えて検討を行った.
術前深達度診断精度
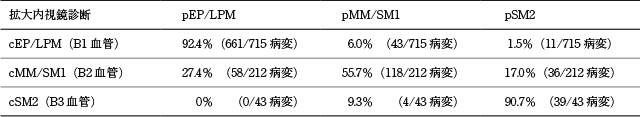
まず,術前診断能に関して画像強調拡大内視鏡,EUSの診断精度を検討した.日本食道学会拡大内視鏡分類のB2血管をもとにcMM/SM1と診断したものの切除後病理診断を検討した研究を集計すると,6編から計212病変あり
3)~8),その病理診断はpEP/LPM 27.4%(58/212),pMM/SM1 55.7%(118/212),pSM2 17.0%(36/212)であった(Table 3).IPCL Type-V3血管をもとにcMM/SM1と診断したもの
9)の切除後病理診断は,pEP/LPM 29.8%,pMM/SM1 42.3%,pSM2 27.9%であった.EUS所見をもとにcMM/SM1と診断したもの
3)の切除後病理診断は,pEP/LPM 55.2%,pMM/SM1 29.3%,pSM2 15.5%であった(Table 4).
上記結果から,cMM/SM1癌と治療前に診断されても,27.4~55.2%は内視鏡切除で治癒する可能性が高いpEP/LPM癌であること,逆にpSM2癌と深い病変も15.5~27.9%含まれることが分かる.すなわち,cMM/SM1癌の術前診断能は十分なものではなく,この場合には患者の立場を考えると,選択可能な治療の中ではより低侵襲なものを選択すべきと考える.
内視鏡切除の安全性と非治癒切除例への追加治療
cSM1/SM2癌を対象に,内視鏡切除後の病理組織学的評価に基づいて化学放射線療法を加える治療法の有効性に関して検討した検証的研究に,JCOG0508試験がある
10).この研究では内視鏡切除後の病理結果で「pMM,脈管侵襲なしかつ断端陰性」患者は経過観察,「pMM,脈管侵襲ありかつ断端陰性」,または「pSMかつ断端陰性」患者は予防的化学放射線療法(41.4Gy),「断端陽性」患者の場合は根治的化学放射線療法を行ったところ,全患者の3年全生存率は92.6%(90%CI:88.5~95.2),3年無増悪生存率89.7%(90%CI:84.2~93.4)という結果であった.そのうちpMM,脈管侵襲ありかつ断端陰性,またはpSMかつ断端陰性患者で予防的化学放射線療法を行った群の3年全生存率は90.7%(90%CI:84.0~94.7)と良好な結果であった.内視鏡切除に関連したGrade 3(CTC-AE 3.0)以上の有害事象は食道狭窄を0.6%に認めたのみであった.本研究の結果より,cMM/SM1癌よりさらに進行したcSM1/SM2癌に対しても内視鏡切除が安全に施行でき,この内視鏡切除が非治癒切除に終わった場合でも,病理所見に基づき適切な追加治療を行えば,良好な予後が期待できることが確認された.
内視鏡切除と外科切除の比較
食道扁平上皮癌のpT1癌に対してESDと外科切除の成績を比較した報告は2編あり,いずれも単施設後方視的観察である.上海からの報告
11)では,ESD群は治療関連死が有意差はなかったものの少なく(0.3% vs 1.5%,P<0.186),重篤な合併症(15.2% vs 27.7%,P<0.001),特に食道瘻形成(0.3% vs 16.4%,P<0.001),呼吸器合併症(0.3% vs 3.6%,P<0.004)は有意に少なかった.ESD群は治療後狭窄が多かったが有意差はなかった(13.4% vs 9.9%,P<0.203).ESD群は,治療時間および入院期間が短く(49分 vs 240分,P<0.001,3日 vs 11日,P<0.001),入院費用が安かった(中央値 $2,813 vs $10,001,P<0.001).平均21カ月の経過観察による全死亡,疾患特異的死亡率,転移再発率も両群間で差を認めなかった.年齢,性別,深達度,他臓器癌,放射線療法の有無で交絡を調節してもほぼ同様の結果であった.韓国からの報告
12)も同様に,ESD群43カ月,外科切除群63カ月の平均観察期間で,ESD群の全生存率,疾患特異的生存率,無再発生存率は,外科切除群と差がなかった.以上より,pT1癌に対し内視鏡切除が外科切除に比べ安全かつ低侵襲で,医療経済的にも優れていると考えられる.また,患者も外科切除より内視鏡切除を希望することが考えられ,患者希望にも合致すると考える.
まとめ
以上の検討より,内視鏡切除は外科切除に比べて低侵襲な治療である.また,cMM/SM1癌に対して内視鏡切除は安全に施行でき,その27.4~55.2%は内視鏡切除で治癒する可能性が高いpEP/LPM癌である.もし,内視鏡切除後の病理結果で非治癒切除であっても,追加治療により良好な予後が期待できる.このような結果から,益と害のバランスを考慮して,「術前にcMM/SM1と診断した非全周性の食道扁平上皮癌に対して,内視鏡切除を行うことを弱く推奨する」とした.ただし,内視鏡切除後に追加治療が必要になる可能性があることを説明した上で治療方針を決める必要がある.
CQ2:全周性の食道表在扁平上皮癌に内視鏡切除は推奨されるか.
推奨文:cT1a-EP/LPM,長径50mm以下の,全周性食道表在扁平上皮癌には狭窄予防処置を併用した上での内視鏡切除を行うことを弱く推奨する.
修正Delphi法による評価:中央値7,最低値3,最高値9
エビデンスの強さ:C
解説:食道癌に対する内視鏡切除は低侵襲で根治性も高い治療である.しかし,全周性の内視鏡切除後には,難治性の狭窄が生じることがあり,この場合には患者のQOLを著しく低下させる.一方,最近は全周切除後の狭窄も予防可能という報告がなされるようになった.全周性の食道癌に内視鏡切除を行うことが推奨されるかどうかが明確になれば,治療方針決定の大きな助けとなる.
全周性の食道表在扁平上皮癌に対して内視鏡切除を行った場合に,良好な予後が得られているか,QOLが損なわれていないかが最も重要ではあるが,そのような観点で内視鏡切除と他治療の成績を直接比較検討した報告は文献検索で抽出されなかった.そこで,全周性の内視鏡切除後の狭窄に関する成績,表層拡大型食道扁平上皮癌に対する内視鏡切除の成績,cT1N0M0食道扁平上皮癌に対する外科切除や化学放射線療法などの成績を間接的に比較することとした.
全周性のESDの治療成績を検討した研究に関し文献検索を行ったところ,PubMed:151編,Cochrane:18編,医中誌:26編の論文が抽出された.この195編を一次スクリーニングにかけ,さらに27編を二次スクリーニングにかけて,最終的に予防的内視鏡的バルーン拡張,ステロイド局注,ステロイド内服,PGAシートの効果を検討していた,1編のランダム化比較試験
13)と12編の後方視的観察研究
14)~25)についてシステマティックレビューを行った.
全周性食道癌に対するESDの成績
食道扁平上皮癌に対するESDの生存率に関してはこれまでに多数報告されているが,全周性食道扁平上皮癌のサブグループに関して生存率を記載している報告は,われわれが検索した範囲で抽出されなかった.しかし亜全周以上の切除を行った22例(全周7例を含む)を中央値で15.5カ月経過観察し,無再発生存であったという報告
26)や,亜全周以上の切除を行った51例(全周11例を含む)を中央値で29カ月経過観察し,狭窄を来した7例全例でバルーン拡張(中央値4回)による狭窄解除に成功し,重篤な有害事象を認めなかったと報告されている
16).ESDの完全(切除断端陰性)切除率は,記載があるものはすべて100%
14),19)であった.全周性食道癌に対するESDの治癒切除率に関する報告はなかったが,全周性食道癌同様に広範な病変である表層拡大型食道癌に対する内視鏡切除の成績をみたものでは,cT1a-EP/LPM癌では70%の患者で治癒切除であったと報告されている
27).
全周性食道癌に対するESD後の狭窄率(狭窄予防なし)
内視鏡切除後に狭窄予防を行わなかった場合には
13),15),17),18),22),23),31例全例で狭窄を来し,狭窄解除に平均26回のバルーン拡張を要しており,狭窄予防なしでの内視鏡切除が推奨される結果ではなかった.
全周性食道癌に対するESD後の狭窄率(ステロイドによる狭窄予防を行った場合)
内視鏡切除後の狭窄予防に,ステロイド局注を行った患者は45例で狭窄率は76%
13),15),16),20),21),ステロイド内服を行った患者は44例で狭窄率は55%
14),16),18)~20),22),23),ステロイド局注と内服の両方を行った患者は14例で狭窄率は71%
23)であった.しかしこれらの検討には平均長軸長が6cmと,かなり広範な食道癌が多く含まれていた.
一方で,Miwataら
20)は,全周切除後にステロイド局注もしくはステロイド内服にて狭窄予防を行った患者を検討し,狭窄リスクとして長径50mmを超える切除径を挙げている.長径50mmを超える切除を行った場合には,85%(11/13例)に6回以上の拡張術が必要であったが,長径50mm以下の切除の場合は,6回以上の拡張術が必要であったのは17%(1/6例)のみであった.この報告には長径50mm以下を切除した場合の具体的な拡張回数は記載されていないが,比較的少ない回数に抑えられる可能性が高い.また山口ら
16)は全周切除例でも経口ステロイドをプレドニン30mgから開始し12~18週と長めに投与すれば狭窄率は27.3%(3/11例)で,狭窄した場合でも,その解除に必要なバルーン拡張は平均1.6回と報告している.Shibagaki
26)らは,ESD直後と1週間後,軽度狭窄出現時に,内視鏡下にステロイドを食道内に充填させることにより,全周切除7例で狭窄が完全に予防できたことを報告している.このように,長軸径50mm以下の短いものに限れば狭窄を来しても拡張回数は比較的少ない回数で済むことや,全周切除後の狭窄予防に有効な方法が開発されていることが分かる.
ESDとステロイド投与に関する有害事象
ステロイドによる狭窄予防を行った場合には,壁の脆弱化による穿孔のリスク
28),29)や,ステロイド内服では,糖尿病や非常に稀ではあるが重篤な感染症の報告がある
30).また,広範な病変のESDは小さな病変に比べて,有意差はないものの合併症発生率が高く
27),熟練した内視鏡医が行うことが望ましい.
ラジオ波焼灼療法(RFA)
近年海外では,Barrett食道に対して行われるRFAが,表在型食道扁平上皮癌の治療にも行われている(本邦未承認).中国の研究
31)ではmoderate grade intraepithelial neoplasia(MGIN)~cT1a癌96例のうち,解析対象となった90例に対して,1年かけて1~4度のRFAを行い内視鏡で評価したところ78例で病変がいったん消失したが,12例では病変が残存した.病変が残存した12例のうち5例は追加RFAやEMRで病変が消失したが,他の6例は病変が進行し4例に外科切除,1例に化学放射線療法,1例にESDが施行された(他の1例は脱落).また,病変がいったん消失した78例からも,3例がSM癌で再発し,8例がmoderate~high grade INで再発していた.このように現状では,MGIN~cT1a食道癌に対するRFAの効果は不十分である.
化学放射線療法
cT1N0M0の食道扁平上皮癌72例に対する化学放射線療法のPhaseⅡ試験(JCOG9708)
32)では90%以上に完全奏効が得られ,4年全生存率80.5%であった.しかし,対象の31%に局所再発(異時性食道内多発癌を含む)を認め,4年無病生存率は52.8%であった.
最近の報告
33)ではcT1bN0M0の食道扁平上皮癌36例に対し根治的化学放射線療法を行った後方視的研究において5年全生存率86%,5年無病生存率は59%と局所や転移再発を多く認めていた.
有害事象として,JCOG9708試験
32)ではGrade 2以上の呼吸困難を11.1%,食道炎を2.7%,虚血性心疾患を2.7%,心膜炎を2.7%,不整脈を1.4%に認めた.最近の報告
33)ではGrade 2以上の食道狭窄を11%,胸水を14%,Grade 4の心嚢液貯留を3%,Grade 5の肺炎を3%に認めた.
外科切除
本邦においてcT1aN0M0食道扁平上皮癌のみを対象とした外科切除の成績に関する最近の報告は,文献検索で抽出されなかった.参考材料ではあるが,cT1bN0M0食道癌を対象にしたJCOG0502試験における外科切除の成績
34)では,5年生存率は86.5%と良好であった.一方で有害事象として,Grade 3,4の縫合不全が6.3%,肺炎7.7%,反回神経麻痺2.9%,瘻孔1.9%が発生したと報告されている.
コスト
本邦における2018年度改正の診療報酬点数は外科切除再建術(頸部,胸部,腹部操作)が77,040点,放射線療法は2,700点+840点×照射回数,化学放射線療法はそれに薬剤の点数が加算,食道ESDが22,100点,食道狭窄拡張術(拡張用バルーンによるもの)が12,480点である.診療報酬点数のみの計算では5回以上のバルーン拡張を行うとESDの診療費用が外科切除を上回るが,これに入院費用と化学放射線療法の場合は各種薬剤点数などが加わるため正確な比較は困難である.
まとめ
ESDと化学放射線療法の益と害をまとめると,両者とも臓器温存が可能で比較的低侵襲な治療である.ESDでは高頻度で発生する術後狭窄が問題となるが,切除長径が50mm以下で狭窄予防処置を施せば,狭窄を来しても5回以下の拡張で解除される可能性が高い.また,最近はより有効な狭窄予防法も開発されている.重篤な偶発症は稀である.一方,化学放射線療法では高頻度で発生する偶発症はないが,呼吸困難や心嚢液貯留などの重篤な偶発症の発生があり,最近の報告では肺炎死亡を3%に認めている
31).また,ESDでは1週間程度の入院と,狭窄を来せばバルーン拡張のための通院が必要となり,化学放射線療法では化学療法時の入院と放射線療法のための比較的多くの通院が必要となる.
また効果に関しては,ESDでは食道癌は高率に完全切除されるため局所根治性に優れ,50mm以下のcEP/LPM癌に限ると70%程度に治癒切除が期待できる.一方化学放射線療法は90%に完全奏効が得られるものの,比較的高い局所再発のリスクがある.局所再発はphotodynamic therapy(PDT)やESDでサルベージ可能なことが多いが,局所再発に対するかなり綿密なサーベイランスが必要となる.
このようにESDと化学放射線療法では,益と害のプロフィールが異なるため単純には比較できないが,対象を50mm以下のcEP/LPM癌に絞ると,ESDの益と害のバランスは,その侵襲度の低さから少なくとも化学放射線療法と同等か勝ると判断する.その場合,異時性食道内多発癌や転移再発のリスクが高い食道癌において,後の治療として化学放射線療法の選択肢を温存するという観点からも,ESDと化学放射線療法のいずれもが適応できる状況ではESDを推奨できると考える.
ESDと外科切除の益と害をまとめると,癌の短期的な根治性では外科切除が勝るが,縫合不全などの比較的重篤な偶発症が約19%に発生し,術後のQOL低下も懸念される.一方,先述したようにESDでは治癒切除が期待でき,治癒切除が得られなかった場合も追加治療で根治性は担保できる.臓器温存の益と術後合併症の害の面から,ESDを推奨できると考える.
今後は,治療後の予後やQOL,狭窄予防効果などを包括的かつ前向きにみた,多施設研究により全周性食道癌に対するESDの有効性をより明らかにする必要がある.
以上より,十分なエビデンスに裏打ちされたものではないため推奨度は弱いが,50mm以下のcEP/LPM,全周性食道癌にはESDを推奨する.
第2章 食道扁平上皮癌内視鏡切除
【序説】
食道表在扁平上皮癌に対する内視鏡切除は,広く普及し日常的に行われている.その目的は腫瘍の除去と同時に組織学的診断を得ることである.分割切除を行うと局所再発のリスクが高くなることが分かっているため,根治性の観点から一括切除を行うことが必要である.また,正確な組織診断は追加治療の有無や再発の可能性を得る重要な情報となる.このためにも一括切除を行う必要がある.従来のEMRで分割切除されていた病変も,ESDで一括切除が可能となっている.このESDをこれまで以上に容易にするトラクションデバイスなどの技術の普及が期待されている.
また,内視鏡切除後の粘膜欠損が3/4周以上になると,60%以上の割合で狭窄が生じることが知られている.食道狭窄は術後のQOLを低下させるため,食道癌診療ガイドライン2017年版(第4版)
1)では,“狭窄予防として,予防的バルーン拡張術,ステロイド局注,ステロイド内服のいずれかを行うことを強く推奨する”とされている.本章では予防法に関して一歩踏み込んだ推奨が行えるよう,ステロイド局注に関するclinical question(CQ)を立て推奨を作成した.さらに内視鏡切除後のマネジメントのCQとして,proton pump inhibitor(PPI)の必要性に関する項を設定し,推奨を作成した.推奨のまとめを以下に図示する(Figure 4).
CQ3:食道表在扁平上皮癌に対するESDを行う場合に,トラクションデバイスの使用が推奨されるか.
推奨文:食道表在扁平上皮癌に対するESDを行う際には,糸付きクリップによるトラクションデバイスを用いることを弱く推奨する.
修正Delphi法による評価:中央値8.5,最低値7,最高値9
エビデンスの強さ:B
解説:管腔が狭い食道内でいかに安全に食道表在扁平上皮癌に対する内視鏡切除を行うかは,実臨床における課題である.ESD時に発生しうる穿孔などの重篤な偶発症は,時に医療資源を消費することになる.トラクションデバイスを用いることで,安全性の向上に寄与するものと期待されている.したがって,治療時間の短縮,偶発症の減少などの安全性の観点からトラクションデバイスの使用に関して検討する必要がある.
食道癌に対するESDにおけるトラクションデバイスの有用性を検討した研究に関して文献検索を行ったところ,PubMed:337編,Cochrane:138編,医中誌:62編の論文が抽出された.この537編を一次スクリーニングにかけ,さらに17編を二次スクリーニングにかけて,最終的に糸付きクリップの有用性を検討した1編のランダム化比較試験と2編の症例対照研究を対象に定性的システマティックレビューを行った.
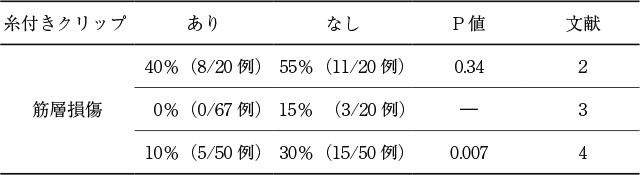
治療成績の評価(Table 5)
いずれの検討も2人以上の熟練者が治療を行っていた.治療時間について,ランダム化比較試験
2)において有意差を持って短縮することが示された(19.8分 vs 31.8分,P=0.044).症例対照研究においては,1編
3)で有意差があり,もう1編
4)では有意差がないという結果であった.有意差が認められなかった試験については全周例など周在性の広い患者も含まれており,半周以下の患者に限れば有意差が認められている(22.0分 vs 26.5分,P=0.018).
偶発症の評価(Table 6)
偶発症については筋層損傷,穿孔について評価を行っている.ランダム化比較試験
2)において筋層損傷例は40% vs 55%(P=0.34)で有意差はなく,穿孔例は両群に1例も認められていなかった.症例対照研究
3),4)では,穿孔例はともになく,筋層損傷は,1編では非使用群に15%,使用群0%,もう1編では非使用群30%,使用群10%,有意差あり(P=0.007)であった.
まとめ
トラクションデバイスの使用は,治療時間の短縮に関しては寄与するものと考えられる.安全性に関してもリスクを増加させることはない.糸付きクリップというトラクションデバイスを使用しても患者側のコスト増加がなく実質的な害がないため,トラクションデバイスを使用することを弱く推奨する.
CQ4:食道表在扁平上皮癌内視鏡切除後の粘膜欠損の周在が3/4周以上となった際に,トリアムシノロンの局注は予防なしと比べて推奨されるか.
推奨文:食道表在扁平上皮癌内視鏡切除後の粘膜欠損の周在が3/4周以上となった際に,トリアムシノロンの局注を弱く推奨する.
修正Delphi法による評価:中央値9,最低値5,最高値9
エビデンスの強さ:B
解説:本CQに対して文献検索を行ったところ,PubMed:190編,Cochrane:81編,医中誌:73編の論文が抽出された.この344編を一次スクリーニングにかけ,さらに39編を二次スクリーニングにかけて,最終的に1編のランダム化比較試験と3編の症例対照研究を対象に定性的システマティックレビューを行った.粘膜切除が非全周性の場合と全周性になる場合とで,トリアムシノロン局注後の狭窄の程度が異なるため,両者を分けて解説する.
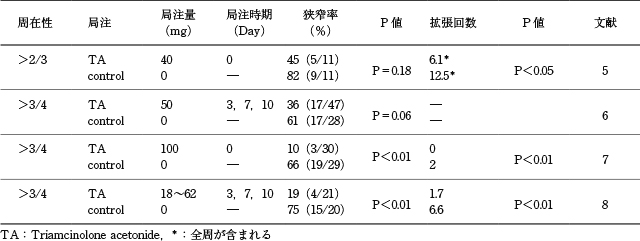
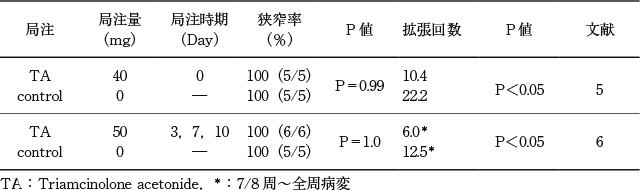
非全周性の粘膜欠損に対する狭窄予防効果(Table 7)
非全周性病変に対してトリアムシノロンの局注を行った場合,狭窄率は10~45%
5)~8)であり,局注を行わなかった場合の61~82%と比較して有意に狭窄率が低い傾向にあった.また,狭窄後にバルーン拡張術を要した平均回数も局注群で少ない傾向であった(局注群:0~1.7回 vs 非局注群:2~6回)
5)~8).
全周性粘膜欠損に対する狭窄予防効果(Table 8)
全周性病変に対するトリアムシノロンの狭窄予防効果は得られておらず,トリアムシノロンの局注の有無に関わらず,狭窄率は2編
5),6)での検討ではあるが,いずれも100%であった.しかし粘膜欠損の広さに比較して,少ない局注量での検討であった.一方で,狭窄後にバルーン拡張術を要した平均回数は局注群で少ない傾向であった(局注群:6~10.4 vs 非局注群:12.5~22.2)
5),6).拡張を要した期間については2編ともに有意差は認められなかった.
有害事象
安全性に関しては,トリアムシノロンの局注が直接影響した偶発症かどうかの判断を著者自身が明確にしていないため,狭窄を来した後の拡張術時の偶発症を含めての検討となっている.非全周性病変の場合,穿孔もしくは出血が報告されており,0~6.25%(16例中1例)
5)~8),全周性では0~33.3%(6例中2例)
5),6)であった.
経済的側面
トリアムシノロン局注にかかるコストは,現段階で,トリアムシノロン40mgアンプル:815円,内視鏡下局注針:2,000円などであり,バルーン拡張術は12,480点であるのに対し,バルーン単価は単回使用で65,000円などのコストがかかる(2019年9月時点).したがってトリアムシノロン局注によりバルーン拡張回数が減ることで一連の治療に関わるコストの削減につながる.
まとめ
トリアムシノロン局注後に起こる穿孔は,筋層への局注を避けることで回避可能であり,またバルーン拡張における穿孔はやや小さめの径のバルーンを使用することで回避できる可能性が高いことを考慮すると,トリアムシノロンの局注は,全周例に対する効果は狭窄率ではみられなかったものの拡張回数を有意に減少させる効果は認められ,非全周性の切除例には十分な狭窄率の減少効果がみられた.こうした状況から,トリアムシノロンの局注が狭窄予防に寄与する可能性は示唆される.安全性の側面も考慮すると,現状ではトリアムシノロンの局注を弱く推奨する.トリアムシノロンの使用量に関しては,論文により使用量が異なるため現段階で推奨する量に一定の見解はないが,有効性が示されている量はいずれも添付文書で示されている量より多い量である.
CQ5:食道表在扁平上皮癌に対する内視鏡切除後に,PPI投与が推奨されるか.
推奨文:食道表在扁平上皮癌に対する内視鏡切除後に,GERD症状を認める患者,内視鏡治療時ロサンゼルス分類Grade A以上の逆流性食道炎を認める患者を除くと,出血予防や潰瘍治癒促進目的にPPIを投与しないことを弱く推奨する.
修正Delphi法による評価:中央値9,最低値7,最高値9
エビデンスの強さ:C
解説:食道表在扁平上皮癌の増加とともに,それに対する内視鏡切除も実臨床で一般的に行われている.その術後管理においては,これまで先行して行われていた早期胃癌に対する内視鏡切除後のマネジメントに準じて行うことが多かった.しかし胃と異なり食道においては胃酸に曝露される機会はそれほど高くなく,PPIの投与によるメリットや経済的観念から,PPI投与に関して検討する必要がある.
食道癌に対する内視鏡切除後におけるPPIの有用性を検討した研究に関して文献検索を行ったところ,PubMed:187編,Cochrane:120編,医中誌:187編の論文が抽出された.この494編を一次スクリーニングにかけ,さらに3編を二次スクリーニングにかけて,最終的に1編のランダム化比較試験を対象に定性的システマティックレビューを行った.
本研究
9)は,frequency scale for symptoms of GERD(FSSG)が7点以下の患者を対象とし,ロサンゼルス分類Grade A以上の逆流性食道炎を認める患者や,ステロイドやnon-steroidal anti-inflammatory drug(NSAID)の投与が必要な患者,食道扁平上皮癌に対する手術・放射線・抗癌剤治療が過去に行われた患者を除外している.
潰瘍治癒率,GERD症状の出現率において評価され,PPI投与の有無に関わらず差がなく,有用性は認められなかった[潰瘍治癒率:84%(無)vs 85%(有),GERD症状:25%(無)vs 30%(有)].PPI投与が考慮されるのは,内視鏡切除後にGERD症状が出現した時であり,90%の患者で症状改善が認められた.また治療に関連する出血,疼痛,穿孔,狭窄などの偶発症に関しては,両群間で差は認められなかった.Grade 3以上の偶発症に言及すると,PPI非投与群で食道痛が4%,投与群で食道痛2%,咽頭痛3%が認められるのみであった.本試験では,PPIはESD直後から5週間の投与が行われており,非投与群よりその分の経済的負担が生じることになる.
以上より,GERD症状を認める患者,内視鏡治療時ロサンゼルス分類Grade A以上の逆流性食道炎を認める患者を除くと,有用性や経済的側面からPPIを投与しないことを弱く推奨する.
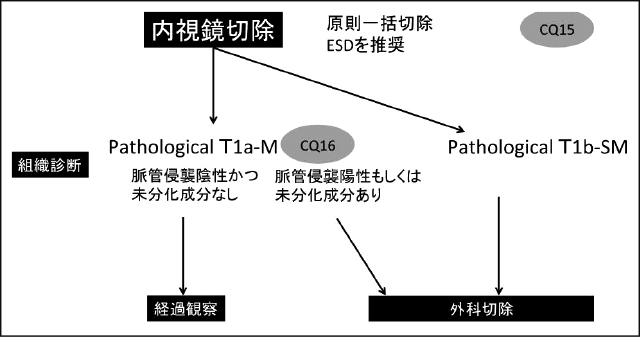
第3章 食道扁平上皮癌内視鏡切除後の治癒判定と追加治療
【序説】
内視鏡切除後には,切除標本の組織所見をもとに治癒判定が行われる.食道扁平上皮癌では,過去の外科切除でPathological(p)T1a癌でもリンパ節転移を認めた患者があることは知られているが,pT1a-EP/LPMで脈管侵襲陰性,切除断端陰性の場合は,その頻度は低いため,治癒切除と判定され,追加治療は必要ないとされている
1).一方,pT1a-MM癌では転移のリスクが高くなり,特に脈管侵襲の有無で転移頻度が異なるため,食道癌診療ガイドライン2017年版(第4版)
1)では“pT1a-MM癌で脈管侵襲陽性の場合は,追加治療を行うことが強く推奨”されている.本項では,pT1a-MM癌で脈管侵襲陰性例やpT1b-SM癌についての治癒判定をいかに行うかをclinical question(CQ)として,それに対する推奨を作成した.推奨のまとめを以下に図示する(Figure 5).
CQ6:内視鏡切除後の組織所見でpT1a-MM脈管侵襲陰性の食道扁平上皮癌に対する外科切除もしくは化学放射線療法による追加治療は推奨されるか.
推奨文:内視鏡切除後のpT1a-MM脈管侵襲陰性の食道扁平上皮癌に対する外科切除もしくは化学放射線療法による追加治療を行うこと,または,行わないことについては推奨を決定できない.
エビデンスの強さ:D
解説:内視鏡切除後の組織所見でpT1a-MM脈管侵襲陰性の食道扁平上皮癌に対する追加治療として外科切除もしくは化学放射線療法は,推奨されるかというCQに関して文献検索を行ったところ,PubMed:188編,Cochrane:24編,医中誌:19編の論文が抽出された.この231編にハンドサーチの14編を追加して,一次スクリーニングにかけ,さらに44編を二次スクリーニングにかけて,最終的に27編の論文を対象に定性的システマティックレビューを行った.「転移再発減少について」は,転移再発率および同時リンパ節転移率を,「外科切除もしくは化学放射線療法の有害事象」については,主にそれぞれの治療関連死を検討した.「生存率の向上について」は死亡率を検討したが,他病死が多く,本CQに合致する結果を抽出することができなかった.また,「外科切除もしくは化学放射線療法によるQOL低下」,「入院期間延長」,「治療にかかるコスト(患者側)」については論文がなかったため,検討できなかった.
外科切除例でのpT1a-MM癌の転移頻度についての検討
初回外科切除例による報告では,脈管侵襲陽性例も含むpT1a-MMの食道扁平上皮癌の切除標本での同時リンパ節転移頻度は,0~26.7%と報告されており,主な報告を集計すると29/199(14.6%,95%CI:10.0~20.3%)
2)~9)であった.この報告の中の1編で,pT1a-MM 50例の解析がされており,リンパ管侵襲陽性例でリンパ節転移頻度が高くなることが報告されている(陰性例:4/38(10.5%),陽性例:5/12(41.7%)
2).
しかし,以下の2つの理由で,これらの手術標本で評価されたpT1a-MM例の報告よりも,内視鏡切除標本で評価されたpT1a-MM例ではリンパ節転移の頻度が低いと考えられる.①病理診断において,手術標本は内視鏡切除標本よりも切片幅が厚く,手術標本でpT1a-MMと評価された病変の中には実際はpT1b-SMである病変を含んでいる可能性がある.②各文献に詳細な記載はないが,初回外科切除例では,治療前にリンパ節転移陽性と診断されていた患者(cN陽性)がある一定の割合で存在している可能性がある.そのため,治療前に基本的にはリンパ節転移陰性(cN0)と判断されている内視鏡切除標本とは少し集団が異なり,手術標本の同時リンパ節転移頻度は高くなることが予想される.
内視鏡切除例でのpT1a-MM癌の転移頻度についての検討
内視鏡切除後の組織所見でpT1a-MM脈管侵襲陰性の食道扁平上皮癌に対して,追加治療の有用性を明らかにしたランダム化比較試験や症例対照研究の報告はない.内視鏡切除後の脈管侵襲陽性例やpT1b-SM例を含む,経過観察群,追加外科切除群,化学放射線療法群に関する症例集積の報告を複数認めたため著者照会し,pT1a-MM脈管侵襲陰性かつpVM0の食道扁平上皮癌の,その後の転移再発頻度について集計した.
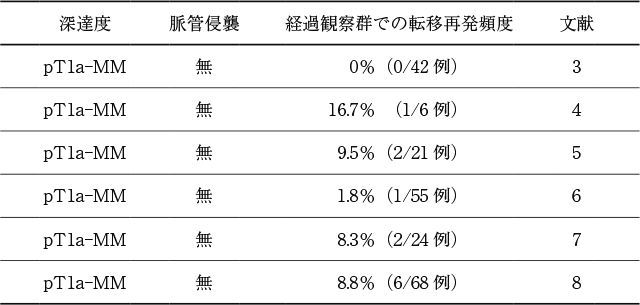
各群の転移再発率は,経過観察群で6編の報告から12/216(5.6%,95%CI:2.9~9.5%)(Table 9)
3)~8),追加外科切除群で3編の報告から0/6(0%,95%CI:0~46.0%)
9)~11),追加化学放射線療法群で6編の報告から1/17(5.9%,95%CI:0.2~28.7%)
7),11)~15)であった(Table 10).
一方,内視鏡切除後のpT1a-MM脈管侵襲陽性かつpVM0の食道扁平上皮癌で,経過観察群,追加外科切除群,追加化学放射線療法群に関しても著者照会し集計した.各群の転移再発率は,経過観察群で4編の報告から3/14(21.4%,95%CI:4.7~50.8%)
5)~8),追加外科切除群で4編の報告から1/20(5.0%,95%CI:0.1~24.9%)
8)~11),追加化学放射線療法群で7編の報告から7/45(15.6%,95%CI:6.5~29.5%)
6)~8),11)~14)であった(Table 10).
しかし,これらのデータは,フォローアップが不十分な患者も含まれており,十分にフォローアップすることでさらに転移再発割合が増える可能性がある.さらに,免疫染色で脈管侵襲を正確に評価していたかどうかは分かっていない.報告の中には,免疫染色を加えることで,脈管侵襲の診断が変わったという報告もあった
13).
追加治療の有害事象
追加外科切除の有害事象について,まとまった報告は少ないため,cT1癌に対する初回外科切除(一部食道腺癌も含む報告)も含めて検討を行った.追加化学放射線療法の有害事象については,内視鏡切除後の病理結果に関わらず(pT1a-MM脈管侵襲陽性例やpT1b-SM例も含む),内視鏡切除後の追加化学放射線療法について検討を行った.
外科切除の治療関連死は,症例集積4編
2),16)~18)と,非ランダム化比較試験の1編
19)の報告で,0~2.0%と報告されており,集計すると12/946(1.3%,95%CI:0.7~2.2%)であった.追加化学放射線療法の晩期有害事象としては,症例集積の8編
4),11)~13),15),20)~22)および単群前向き試験の1編
23)の報告から集計し,Grade 3以上の放射線性肺臓炎を1.0%(3/302),Grade 3の血栓塞栓症を0.3%(1/302),Grade 3以上の心筋梗塞を1.3%(4/302)に認めた.治療関連死としては,放射線性肺臓炎の1例,突然死の1例,心筋梗塞の2例の計4例(4/302:1.3%,95%CI:0.4~3.4%)が報告されていた.
まとめ
検討結果について,ほとんどの報告が後方視的な症例集積の報告であり,エビデンスの高い知見は現在まで得られておらず,エビデンスの強さはDとした.内視鏡切除後のpT1a-MM脈管侵襲陰性かつpVM0の食道扁平上皮癌の経過観察群で5.6%の転移再発率が認められる結果であったが,追加外科切除によるQOL低下や治療関連死の可能性,追加化学放射線療法の晩期有害事象・治療関連死を考慮して,「内視鏡切除後のpT1a-MM脈管侵襲陰性の食道扁平上皮癌に対する追加治療として外科切除もしくは化学放射線療法を行わないことを弱く推奨する」としてガイドライン委員会での合意を確認したが,ガイドライン委員内で合意が得られず(修正Delphi法による評価:中央値5,最小値2,最大値8),十分に議論したが,追加治療を行うまたは行わないについてはいずれも推奨が決定できず,最終的な推奨文は「内視鏡切除後のpT1a-MM脈管侵襲陰性の食道扁平上皮癌に対する外科切除もしくは化学放射線療法による追加治療を行うこと,または,行わないことについては推奨を決定できない.」とした.
日常臨床では,患者や家族に転移再発率についてのデータを提示し,患者のパフォーマンスステータス,年齢,主要臓器機能,併存疾患,患者や家族の希望などを考慮し,外科切除もしくは化学放射線療法による追加治療の適応を総合的に判断すべきである.追加治療を行わずに経過観察する場合は,ある一定の割合で転移再発を来す可能性があることを患者に説明する必要があり,転移検索を含めた慎重なフォローアップを行うことが肝要である.
今回,内視鏡切除後の転移再発頻度について検討した報告例については,その多くで病理評価においてD2-40などの免疫染色を用いた詳細な検討がなされているかが不明で,十分な経過観察が行われていない報告も多い.今後の研究として,免疫染色を含めた詳細な組織学的評価を十分に行った上で,長期のフォローアップ期間での経過観察例および追加治療例の転移再発頻度を検討した研究が行われることが期待される.また,内視鏡切除後の組織所見でpT1a-MM脈管侵襲陰性の食道扁平上皮癌に対して追加治療を行うことで転移再発が抑制できるか否かは明らかでないため,実現可能性の点では問題があるが,追加治療の要否についてのランダム化比較試験が望まれる対象であると考えられた.
CQ7:内視鏡切除後の組織所見でpT1b-SMの食道扁平上皮癌に対する外科切除もしくは化学放射線療法による追加治療は推奨されるか.
推奨文:内視鏡切除後のpT1b-SMの食道扁平上皮癌に対する外科切除もしくは化学放射線療法による追加治療を強く推奨する.
修正Delphi法による評価:中央値9,最低値7,最高値9
エビデンスの強さ:D
解説:内視鏡切除後の組織所見でpT1b-SMの食道扁平上皮癌に対する追加治療として外科切除もしくは化学放射線療法は,推奨されるかというCQに関して文献検索を行ったところ,PubMed:188編,Cochrane:24編,医中誌:19編の論文が抽出された.この231編にハンドサーチの13編を追加して,一次スクリーニングにかけ,さらに42編を二次スクリーニングにかけて,最終的に28編の論文を対象に定性的システマティックレビューを行った.「転移再発減少について」は,転移再発率および同時リンパ節転移率を,「外科切除もしくは化学放射線療法の有害事象」については,主に,それぞれの治療関連死を検討した.「生存率の向上について」は死亡率を検討したが,他病死も多く,本CQに合致する結果を抽出することができなかった.また,「外科切除もしくは化学放射線療法によるQOL低下」,「入院期間延長」,「治療にかかるコスト(患者側)」については論文がなかったため,検討できなかった.
外科切除例でのpT1b-SM癌の転移頻度についての検討
初回外科切除例による報告では,脈管侵襲陽性例も含むpT1b-SM1/SM2の食道扁平上皮癌の切除標本での同時リンパ節転移頻度はそれぞれ,pSM1で8.3~53.1%,pSM2で18.5~30.0%と報告されており,主な報告を集計するとpSM1で43/170(25.3%,95%CI:19.0~32.5%)
2),3),16),24)~28),pSM2で49/196(25.0%,95%CI:19.1~31.7%)
3),24)~28)であった.この報告の中の1編で,pT1b-SM1の32例の解析がされており,リンパ管侵襲陽性例でリンパ節転移頻度が高くなることが報告されている[陰性例:6/21(28.6%),陽性例:11/11(100%)]
2).
しかし,以下の3つの理由で,これらの手術標本で評価されたpT1b-SM例の報告と内視鏡切除標本で評価されたpT1b-SM例のリンパ節転移の頻度は一概に直接比較できないと考えられる.①病理診断において,手術標本は内視鏡切除標本よりも切片幅が厚く,実際は深達度がより深い病変を含んでいる可能性がある.②手術標本と内視鏡標本では,病理診断における深達度pSM1/pSM2の定義が異なることが挙げられる.手術標本では深達度pSM1を「粘膜下層を3等分し,上1/3にとどまる病変」,pSM2を「粘膜下層を3等分し,中1/3にとどまる病変」と定義されているのに対して,内視鏡標本では粘膜下層を3等分した距離が不明であるため,深達度pSM1を「粘膜筋板から200µm以内の粘膜下層にとどまる病変」,pSM2を「粘膜筋板から200µmを超える粘膜下層に浸潤する病変」と定義されており,特に手術標本でpSM1と診断された患者は,内視鏡切除標本より実際はより深く浸潤している病変が含まれている可能性がある.③各文献に詳細な記載はないが,初回外科切除例では,治療前にリンパ節転移陽性と診断されていた患者(cN陽性)がある一定の割合で存在している可能性がある.そのため,治療前に基本的にはリンパ節転移陰性(cN0)と判断されている内視鏡切除標本とは少し集団が異なり,手術標本の同時リンパ節転移頻度は高くなることが予想される.
内視鏡切除例でのpT1b-SM癌の転移頻度についての検討
内視鏡切除後の組織所見でpT1b-SMの食道扁平上皮癌に対して,追加治療の有用性を明らかにしたランダム化比較試験や症例対照研究の報告はない.内視鏡切除後のpT1b-SMに対する経過観察群,追加外科切除群,追加化学放射線療法群を含む症例集積の報告,および単群前向き検証試験を複数認めたため著者照会し,pT1b-SMかつpVM0の食道扁平上皮癌について集計した.また,pT1b-SM1とpT1b-SM2,脈管侵襲の有無は転移再発リスクが異なることが知られているため,深達度・脈管侵襲の有無別に集計を行った(Table 11).
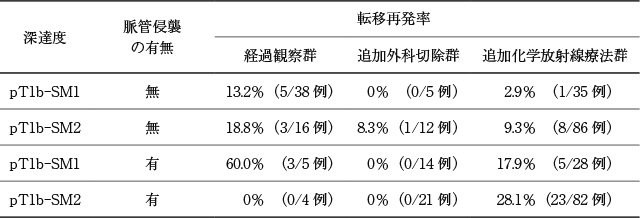
pT1b-SM1/SM2で脈管侵襲陰性に対する各群の転移再発率は,経過観察群で6編の報告から8/54(14.8%,95%CI:6.6~27.1%)
4)~8),追加外科切除群で6編の報告から1/17(5.9%,95%CI:0.2~28.7%)
5),6),9)~11),29),追加化学放射線療法群で11編の報告から9/121(7.4%,95%CI:3.5~13.7%)
4),6)~8),11)~15),21),30)であった.
pT1b-SM1/SM2で脈管侵襲陽性に対する各群の転移再発率は,経過観察群で4編の報告から3/9(33.3%,95%CI:7.5~70.1%)
5)~8),追加外科切除群で6編の報告から0/35(0%,95%CI:0~10.0%)
5),6),9)~11),29),追加化学放射線療法群で11編の報告から28/110(25.5%,95%CI:17.6~34.7%)
6)~8),11)~15),21),22),30)であった.
しかし,これらのデータは,フォローアップが不十分な患者も含まれており,十分にフォローアップすることでさらに転移再発割合が増える可能性がある.さらに,免疫染色で脈管侵襲を正確に評価していたかどうかは分かっていない.
追加治療の有害事象
追加外科切除の有害事象について,まとまった報告は少ないため,cT1癌に対する初回外科切除(一部食道腺癌も含む報告)を含んで検討を行った.追加化学放射線療法の有害事象については,内視鏡切除後の病理結果に関わらず(pT1a-MM脈管侵襲陽性例やpT1b-SM例も含む),内視鏡切除後の追加化学放射線療法について検討を行った.
外科切除の治療関連死は,症例集積4編
2),16)~18)と,非ランダム化比較試験の1編
19)の報告で,0~2.0%と報告されており,集計すると12/946(1.3%,95%CI:0.7~2.2%)であった.追加化学放射線療法の晩期有害事象としては,症例集積の8編
4),11)~13),15),20)~22)および単群前向き試験の1編
23)の報告から集計し,Grade 3以上の放射線性肺臓炎を1.0%(3/302),Grade 3の血栓塞栓症を0.3%(1/302),Grade 3以上の心筋梗塞を1.3%(4/302)に認めた.治療関連死としては,放射線性肺臓炎の1例,突然死の1例,心筋梗塞の2例の計4例(4/302:1.3%,95%CI:0.4~3.4%)が報告されていた.
まとめ
検討結果について,ほとんどの報告が後方視的な症例集積の報告であり,エビデンスの高い知見は現在まで得られておらず,エビデンスの強さはDとした.
内視鏡切除後のpT1b-SM脈管侵襲陰性かつpVM0の食道扁平上皮癌の経過観察例で13.2~18.8%程度の転移再発率が認められる一方,追加治療群では追加外科切除群5.9%,追加化学放射線療法群7.4%と転移再発率が低く抑えられている結果であった.追加外科切除によるQOL低下や治療関連死の可能性,追加化学放射線療法の晩期有害事象・治療関連死を考慮しても,追加治療の有効性が上回ると考えられ,「pT1b-SM脈管侵襲陰性の食道扁平上皮癌に対する追加治療として外科切除もしくは化学放射線療法を強く推奨する」とした.
内視鏡切除後のpT1b-SM脈管侵襲陽性かつpVM0の食道扁平上皮癌についても追加治療の有効性が上回るため,「内視鏡切除後のpT1b-SM脈管侵襲陽性の食道扁平上皮癌に対する追加治療として外科切除もしくは化学放射線療法を強く推奨する」とした.追加治療の内容について,今回の検討結果からは,追加化学放射線療法の転移再発率(25.5%)と追加外科切除の転移再発率(0%)で差を認めていたが,患者数の少ない検討でランダム化比較されておらず背景因子にも差があることが予想されること,化学放射線治療の照射野や照射量も整っていないデータであることから,追加治療の内容については推奨として触れなかった.今後の課題として,この対象に対する最適な追加治療方法を明らかにするためには,新たな研究やさらなる検討が必要である.
第4章 食道扁平上皮癌内視鏡切除後のサーベイランス
【序説】
食道扁平上皮癌の内視鏡切除後には,局所再発や転移再発,異時性食道内多発癌,異時性他臓器癌が発生し,禁酒・禁煙や適正なサーベイランスを行うことが予後向上の面からも重要である.そこで本章では,転移再発,異時性食道内多発癌,異時性他臓器癌に対するサーベイランスをいかに行うかをclinical question(CQ)として,それに対する推奨を作成した.推奨のまとめを以下に図示する(Figure 6).
CQ8:食道表在扁平上皮癌内視鏡切除後,禁酒と禁煙は推奨されるか.
推奨文:食道表在扁平上皮癌内視鏡切除後,禁酒と禁煙を強く推奨する.
修正Delphi法による評価:中央値9,最低値7,最高値9
エビデンスの強さ:B
解説:食道表在扁平上皮癌の内視鏡切除後には,異時性食道内多発癌や異時性他臓器癌の発生が問題となる.しかし,治療後の禁酒と禁煙の必要性は,十分に分かっていない.本CQに関して文献検索を行ったところ,PubMed:44編,Cochrane:8編,医中誌:12編の論文が抽出された.この64編を一次スクリーニングにかけ,さらに20編を二次スクリーニングにかけて,最終的に6編の論文を対象に定性的システマティックレビューを行った.コホート研究:5編,後向き研究:1編であった.
飲酒の影響(Table 12)
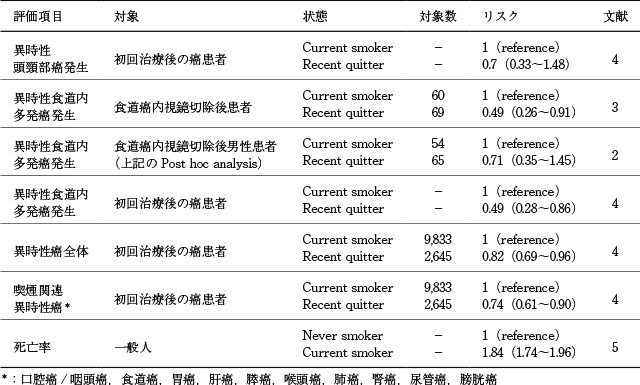
Katadaらは,食道表在扁平上皮癌に対して内視鏡切除を施行した331例の前向きコホート研究で,禁酒により異時性食道内多発癌の累積発生率が有意に低下し(HR:0.47,95%CI:0.25~0.91,P=0.025),食道のヨード不染帯の程度が高度な患者では,禁酒によりさらにそのリスクが低下することを報告している(HR:0.23,95%CI:0.09~0.60,P=0.003)
1).
Yokoyamaらは,食道表在扁平上皮癌に対して内視鏡切除を施行した上記の前向きコホート研究の男性278例を対象にしたpost hoc analysisを施行し,飲酒習慣・喫煙習慣・飲酒後の顔面紅潮反応・食生活を評価する問診票の合計点数が12点以上の食道癌発生の高危険群において,禁酒により異時性食道内多発癌の累積発生率が有意に低下することを報告している(HR:0.37,95%CI:0.14~0.97,P=0.042)
2).
食道表在扁平上皮癌に対して内視鏡切除を施行した患者において,禁酒と生存率の関連について検討した報告はなく,禁酒が死亡率を減少させるかどうかの判定は困難であった.
以上より,食道表在扁平上皮癌内視鏡切除後は,禁酒は異時性食道内多発癌発生のリスクを減少させると考えられるため,禁酒を強く推奨する.
喫煙の影響(Table 13)
Katadaらは,食道表在扁平上皮癌に対して内視鏡切除を施行した331例の前向きコホート研究で,禁煙により異時性食道内多発癌の累積発生率が有意に低下することを報告している(HR:0.47,95%CI:0.26~0.91,P=0.024)
3).
初回治療を受けた癌患者29,795名を対象とした喫煙に関する疫学研究では,禁煙により,すべての二次癌(HR:0.82,95%CI:0.69~0.96)や異時性食道内多発癌(HR:0.49,95%CI:0.28~0.86)の発生リスクが有意に減少することを報告している
4).しかし,異時性頭頸部癌の発生リスクに有意差はなかった(HR:0.70,95%CI,0.33~1.48).
喫煙と死亡率の関連をみると,27,311名の日本人男性,40,662名の日本人女性を対象にした,喫煙状況とあらゆる疾患の死亡率に関するコホート研究では,現喫煙者は非喫煙者と比較して男女ともに有意に死亡率が高かったと報告している[Odds ratio:1.84(1.74~1.96)]
5).また,34,439名のイギリス人男性医師を対象にした喫煙状況と死亡率に関するコホート研究では,現喫煙者は非喫煙者と比較して死亡率が有意に高いことを報告している(喫煙者の死亡率は35~44歳が1.6,45~54歳が2.3,55~64歳が2.5,65~74歳が2.7,75~84歳が2.2)
6).
以上より,食道表在扁平上皮癌内視鏡切除後は,禁煙は異時性食道内多発癌発生のリスクを減少させると考えられ,異時性他臓器癌発生のリスクや死亡率も減少させることが予想されるため,禁煙を強く推奨する.
CQ9:食道表在扁平上皮癌内視鏡切除後,異時性食道内多発癌のサーベイランスに1年に1度以上の内視鏡検査は推奨されるか.
推奨文:食道表在扁平上皮癌内視鏡切除後,異時性食道内多発癌のサーベイランスとして,1年に1度以上の内視鏡検査を行うことを強く推奨する.
修正Delphi法による評価:中央値8,最低値7,最高値9
エビデンスの強さ:C
解説:食道表在扁平上皮癌の内視鏡切除後には,異時性食道内多発癌の発生が問題となる.しかし,内視鏡切除後に異時性食道内多発癌のサーベイランスをどのように行うのがよいか,十分に分かっていない.本CQに関して文献検索を行ったところ,PubMed:66編,Cochrane:17編,医中誌:66編の論文が抽出された.この149編に追加論文1編を加えた150編を一次スクリーニングにかけ,さらに14編を二次スクリーニングにかけて,最終的に7編の論文を対象に定性的システマティックレビューを行った.コホート研究が1編,後向き研究が6編であった.
サーベイランス方法の違いと異時性食道内多発癌の早期発見率や生存率の関連について検討した報告はなかった.また,検査方法の違いに伴う患者の負担,コスト,有害事象についての検討も困難であった.
異時性食道内多発癌の検出をみた研究
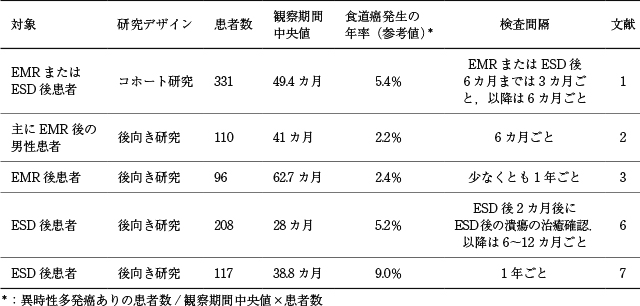
1),7)~12)では(Table 14),参考値であるが年率(平均観察期間のかわりに観察期間中央値を使って計算)2.2~9.0%と,非常に高い頻度で癌が発生していた.内視鏡検査の間隔は,6カ月ごとが3編,12カ月ごとが2編,6~12カ月ごとが1編,記載なしが1編存在した
1),7)~12).また,Katadaらは,内視鏡切除を施行して根治した食道表在扁平上皮癌患者を対象に食道・頭頸部を経過観察する前向きコホート研究を実施し,食道のヨード不染帯の程度が高度になるほど,異時性食道内多発癌の累積発生率が高くなることを報告している
1).
食道表在扁平上皮癌内視鏡切除後,異時性食道内多発癌のサーベイランスとして,多くの報告が6~12カ月ごとの高頻度の内視鏡検査を施行していた.このうち1編は前向きコホート研究であり,プロトコール検査として計画的に6カ月ごとに内視鏡検査を行っていた
1).また,発見された癌の進行度は詳細に記載されていなかったが,そのほとんどには内視鏡治療が行われていた
7),11),12).
以上より,食道表在扁平上皮癌内視鏡切除後,異時性食道内多発癌のサーベイランスとして,1年に1度以上の内視鏡検査を行うことを強く推奨する.また,食道のヨード不染帯の程度が高度な患者に対しては,特に慎重な内視鏡観察を要する.
CQ10:食道表在扁平上皮癌内視鏡切除後,画像診断を用いた異時性他臓器癌のサーベイランスは推奨されるか.
推奨文:食道表在扁平上皮癌内視鏡切除後,上部消化管内視鏡検査を用いた異時性他臓器癌のサーベイランスを行うことを強く推奨する.
修正Delphi法による評価:中央値9,最低値7,最高値9
エビデンスの強さ:C
解説:食道表在扁平上皮癌の内視鏡切除後には,異時性他臓器癌の発生が懸念されている.しかし,どの他臓器癌の発生リスクが高いか,他臓器癌のサーベイランスが生存率を向上させるかは十分に分かっていない.それらが,明確になれば,臨床決断の大きな助けとなる.
本CQに関して文献検索を行ったところ,PubMed:171編,Cochrane:32編,医中誌:15編の論文が抽出された.この218編を一次スクリーニングにかけ,さらに17編を二次スクリーニングにかけて,9編が抽出された.その後,重要論文と判断した2編を追加し,最終的に11編を対象に定性的システマティックレビューを行った.
Ishiharaらの癌登録を用いたコホート研究では,食道表在扁平上皮癌内視鏡切除後患者では悪性腫瘍による標準化死亡比が3.14(95%CI:1.79~5.09)と高かった
13).標準化罹患比(standardized incidence ratio:SIR)による罹患部位の検討では
14)~17),頭頸部癌(6.7~20.1)
14)~17),肺癌(1.6~3.1)
14)~16)でSIRが高いと報告されており,両者は少なくとも5年以上経過してもSIR高値が持続していた
15)~17).その他にSIR高値の他臓器癌として胃癌(1.5~3.3)
15),16),腎臓癌(1.9~2.2)
14)~16)など様々な臓器が報告されているが,頭頸部癌と肺癌以外の癌はいずれも経年的にSIRが低下し有意高値でなくなるため,食道癌精査時に行う各種検査による発見でSIRが一時的に上昇しているというバイアスが関与しているとも考えられる.なお,大腸癌についてはSIRの有意な上昇は報告されていない
14),16).日本人による食道扁平上皮癌の異時性他臓器癌についての論文2編を追加しさらに検討したところ,Matsubaraらによると食道扁平上皮癌術後患者では頭頸部癌,肺癌,胃癌が健常者と比較してそれぞれ34.9倍,3.2倍,2.0倍のリスクがあり
18),Tabuchiらによると食道扁平上皮癌患者の異時性他臓器癌に関する検討では,SIRが頭頸部癌(21.6)と肺癌(1.71)で有意に高かった
19).これら結果から食道癌患者において,頭頸部癌と肺癌のリスクはほぼ確実に高く,胃癌や腎臓癌についても高い可能性があると考える.
サーベイランスの方法については頭頸部癌に対する内視鏡を用いた報告が多く,これまで累積罹患率3.2~12.1%
1),13),20)~22)と報告されている.このうちKatadaらは食道表在扁平上皮癌に対して内視鏡切除を行い治癒切除が得られた331例の前向きコホートを用い,食道のヨード不染帯の程度別に異時性頭頸部癌の発生を検討しているが,ヨード不染のない患者,中等度(内視鏡1視野あたり1~9個)の患者,高度(10個以上)の患者ではそれぞれ2年の累積発見率が0%,1.7%,8.6%と多発ヨード不染の程度が高度になるほど頭頸部癌の発生が増えることを報告している
1).内視鏡検査の有無による直接の比較はないが,白色光観察のみと比較してNBI観察による上乗せ効果がMorimotoら(3.9% vs 9.8%,P=0.008)
20)とNonakaら(1.2% vs 10.9%,P<0.0001)
21)によって報告されており,さらにMorimotoらによると,narrow band imaging(NBI)群で発見された異時性頭頸部癌患者はいずれも局所治療のみで咽喉頭を温存でき,死亡率が白色光群で発見された異時性頭頸部癌患者と比較し有意に低かった(0% vs 60%,P<0.001)
20).また,Onochiらは,食道表在扁平上皮癌内視鏡切除術後患者に対して定期的に内視鏡検査を行うと5年間で累積4.1%の患者に胃癌を発見しており
22),内視鏡によるサーベイランスは頭頸部癌のみならず胃癌の発見にも有用であることが示唆される.
このように,食道扁平上皮癌患者では様々な異時性他臓器癌のリスクが報告されている.頭頸部癌に対しての生命予後,臓器温存を向上させること,当然ながら異時性食道内多発癌の発生もあることから定期的な上部消化管内視鏡検査は推奨される.一方,頭頸部以外の臓器では特に肺癌について長期的なサーベイランスが必要であるが,肺癌に関しては高危険群も含めて死亡率減少に向けた公共的対策がすでにとられているため,本ガイドラインで特別な推奨は行わない.サーベイランスにかかる患者負担やコスト,有害事象の問題は今回検討できていないため,どのような方法で行うかについては最終的に個々の患者の年齢,併存疾患の有無や経済状況などの背景を考慮して決定する必要がある.
以上より,食道表在扁平上皮癌内視鏡切除後,上部消化管内視鏡検査を用いた異時性他臓器癌のサーベイランスを行うことを強く推奨する.
CQ11:食道表在扁平上皮癌内視鏡切除後,Pathological(p)MM以深であった患者に対して,転移再発のサーベイランスに1年に1度以上のCTによる画像診断は推奨されるか.
推奨文:食道表在扁平上皮癌内視鏡切除後,pMM以深であった患者に対して転移再発のサーベイランスに1年に1度以上のCTによる画像診断を弱く推奨する.
修正Delphi法による評価:中央値7,最低値5,最高値9
エビデンスの強さ:C
解説:CQ11に対して文献検索を行ったところ,PubMed:344編,Cochrane:17編,医中誌:46編,ハンドサーチ1編が一次スクリーニングされ,さらに52編に対して二次スクリーニングを行った.この中で画像診断の期間が明記され,約100例以上のpMM以深癌患者に対して転移再発率の長期成績が示されている観察研究6編
10),23)~27)に対して定性的システマティックレビューを行った.
食道表在扁平上皮癌内視鏡切除後に経過観察した研究における転移再発率は,pMM(脈管侵襲陽性例含む)の患者で1.9%(104例中2例)
10),pMM以深のpT1癌全体では5.1~11.8%
23),24),27)と報告されている.また,食道内視鏡切除例402例の検討
25)でみると5年累積転移率はpT1a-EP/LPMで0.4%,pT1a-MMでは8.7%,pT1b-SM1では7.7%,pT1b-SM2では36.2%(P値<0.0001)と深達度の進行とともに頻度が高くなっている.多変量解析においてもpT1a-EP/LPMに対してハザード比がpT1a-MMで13.1(95%CI:1.3~133.7),pT1b-SM1では40.2(95%CI:2.9~552.7),pT1b-SM2では196.3(95%CI:10.9~3,523.6)と深逹度が転移の独立したリスク因子として示された.今回システマティックレビューを行ったうち,唯一の前向き研究はJCOG0508試験
26)である.本研究ではcT1bN0M0の176例を対象に内視鏡切除を行い,切除後pT1aかつ脈管侵襲陰性の低リスク群74例(Group A)は無治療で,pT1aかつ脈管侵襲陽性もしくはpT1b-SM1/2)の高リスク群87例(Group B)と垂直断端陽性15例(Group C)においてはそれぞれ予防的化学放射線併用療法と根治的化学放射線併用療法を行った上で,内視鏡切除後3年以内は4カ月ごとに,以後は6カ月ごとにCTが施行されている.本CQで想定されているような内視鏡的完全切除が得られたものの転移再発の高リスク群であるGroup Bにおける3年全生存率は90.7%(95%CI:84.0~94.7%)であった.再発転移は全体で15例(8.7%,Group A/B/C:1/10/4例)にみられた.このうち5例は転移再発が発見された時点ですでに遠隔転移があり,転移がリンパ節のみに限られておりサルベージ手術が行われた7例では,観察期間終了時の生存例は2例であった.
このように,食道表在扁平上皮癌内視鏡切除例においてpT1a-MM以深であった患者はpT1a-EPやpT1a-LPMに比べて明らかに転移再発のリスクが高く,追加で化学放射線併用療法が行われた患者でも一定の頻度で転移再発が認められる.画像診断のサーベイランス間隔と生存率との関係を直接検討した研究はないが,患者数の少ない後ろ向き試験ではあるが根治手術後の限局した領域の再発例に対してサルベージの化学放射線療法やリンパ節郭清が生存率を改善させるという報告
28)~36)があり,転移再発病変の早期発見および早期治療介入が予後改善につながる可能性がある.多くの文献でサーベイランスとしてのCTが少なくとも年1回以上施行されていることや,患者側もサーベイランスを希望する場合が多いと予想される
37)ため,年1度以上のCTによる画像診断は推奨されると考えられる.なお,今回システマティックレビューを行った文献の中で1編のみ内視鏡切除後のサーベイランスとしてCT以外にEUSが行われており,内視鏡切除後のリンパ節再発を認めた7例中6例はEUSで診断したのに対してCTで診断できたものは7例中3例であった
27).なお,食道癌の領域リンパ節に関するEUS,CT,FDG-PETの診断能を比較したメタアナリシス
38)によると,EUS,CT,FDG-PETがそれぞれ感度(80%,50%,57%),特異度(70%,83%,85%)と報告されている.PETはCTと同等の感度と特異度を有しており,EUSはCTに比較して特異度は劣るものの感度は優っている.したがって,モダリティの違いによりサーベイランスの有効性が改善する可能性はあり,今後これらモダリティの有用性を比較する検討が望まれる.
以上のことから,推奨文は「食道表在扁平上皮癌内視鏡切除後,pMM以深であった患者に対して転移再発のサーベイランスに1年に1度以上のCTによる画像診断を弱く推奨する」とした.
第2部 食道腺癌
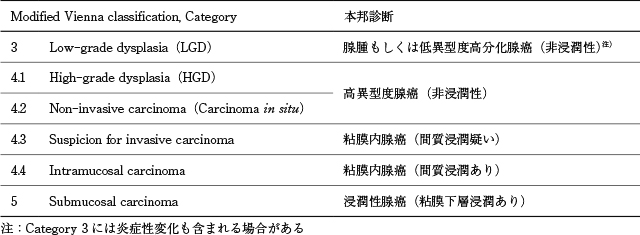
食道腺癌の多くはBarrett食道から発生する.そのBarrett食道に関連する定義において,本邦と欧米ではいくつかの違いがある.本邦では下部食道柵状血管の下端を食道胃接合部とし,胃から連続性に食道に伸びる円柱上皮と定義され,その長さや組織学的な腸上皮化生の有無は問われない.一方,欧米のガイドラインの多くは,胃の縦走ひだの口側終末部が食道胃接合部とされ,1cm未満のものはBarrett食道として取り扱われず,英国を除き,組織学的な腸上皮化生の存在が必須とされている.また,本邦では全周3cm以上のBarrett粘膜を有するものをlong-segment Barrettʼs esophagus(LSBE)と称するが,欧米においては最大長3cm以上と定義されている.本ガイドラインで引用された報告の多くが欧米からであることから,LSBEの定義は原則としてBarrett粘膜の最大長3cm以上とした.しかし,全周3cm以上のLSBEに基づく記載とせざるを得ない場合は,全周3cm以上と明記した.また,日本と欧米では食道腺癌の病理学的評価も異なり,欧米では日本にないlow-grade dysplasia(LGD)やhigh-grade dysplasia(HGD)という組織学的診断が存在する.本ガイドラインではmodified Vienna classification
1)と本邦診断の対応表(Table 15)を作成し,これに基づき各種記載を行った.扁平上皮癌同様に,“表在”腺癌の定義は,“粘膜下層までにとどまる癌病変”とした.
第1章 食道腺癌の術前診断と内視鏡切除適応
【序説】
食道腺癌に対する内視鏡治療に関しては,食道癌診療ガイドライン2017年版(第4版)
2)で“粘膜内腺癌に内視鏡治療を行うことが推奨”されているが,術前検査の方法などに関する記載はない.しかし,食道表在腺癌・HGDに対するESDの治療成績に関する報告では,524病変中R0切除率は74.5%であり,またR1切除のうち54病変(40.3%)においては水平断端が陽性であったことから,内視鏡による病変範囲診断は容易ではないことが示唆される.特にLSBEにおいては病変範囲診断が非常に困難なことが少なくない
3),4).また,食道表在腺癌が口側の扁平上皮に接する場合,約半数の病変で扁平上皮下に進展するとの報告もあり病変範囲診断の難易度はさらに上がることが示唆される
5).よって,食道表在腺癌に対する術前範囲診断について推奨される方法を検討する必要があり,これに関連するclinical question(CQ)を作成した.
CQ12,13のシステマティックレビューでは術前範囲診断に関する論文をまず検索したが,食道腺癌の頻度が低い本邦からの報告は極めて限られていた.また,欧米ではEMR後にBarrett食道全体をラジオ波で焼灼する(radiofrequency ablation:RFA)内視鏡治療が主流であるため,病変範囲診断の必要性は低く,これに関する報告は皆無であった.しかし,食道腺癌の検出(存在診断)に関しては欧米から数多く報告されていた.食道表在腺癌の範囲診断は存在診断と同様の癌・非癌診断を連続的に行い,腫瘍境界線を決定するものと考えられる.よって,CQ12,13に関しては,主に欧米からの食道腺癌存在診断に関する報告をシステマティックレビューし,CQに対する解説・推奨文を作成した.推奨のまとめを以下に図示する(Figure 7).
CQ12:食道表在腺癌の範囲診断で,画像強調併用拡大内視鏡検査を行うことは推奨されるか.
推奨文:食道表在腺癌に対する内視鏡的切除前の範囲診断で,画像強調併用拡大内視鏡検査を行うことを弱く推奨する.
修正Delphi法による評価:中央値8,最低値3,最高値9
エビデンスの強さ:D
解説:本邦では食道表在腺癌に対してESDが広く行われているが,内視鏡による病変範囲診断は容易ではない.特にLSBEにおいては,癌やHGDの周囲にも広範にLGDが広がっていることがあり病変範囲診断の難易度は上がる.また,食道表在腺癌が口側の扁平上皮に接する場合,約半数の病変で扁平上皮下への進展を認めたとの報告
4)があり,内視鏡的に扁平上皮下進展を診断することは重要である.扁平上皮下進展に関しては,酢酸法やNBIを併用した拡大観察が診断に有用であったとの報告
6),7)があり,画像強調併用拡大観察の有用性が示唆される.
病変範囲診断に関する文献検索では,PubMed:359編,Cochrane:91編,医中誌:46編の論文が抽出された.この496編を一次スクリーニングにかけ,さらに34編を二次スクリーニングにかけたが,病変範囲診断に関する検討を行った文献は抽出されなかった.そこで,食道表在腺癌の範囲診断は,検出(存在診断)と同様の癌・非癌診断を連続的に行いながら腫瘍境界線を決定するものと考え,画像強調併用拡大内視鏡を用いた内視鏡的検出(HGD,腺癌)に関する文献を中心に検索を行った.一次,二次スクリーニングを行ったところ,10編の論文が抽出された.また,ハンドサーチで文献を追加検索したところ4編の論文が抽出された.よって,最終的に14編の論文を対象に定性的システマティックレビューを行った.
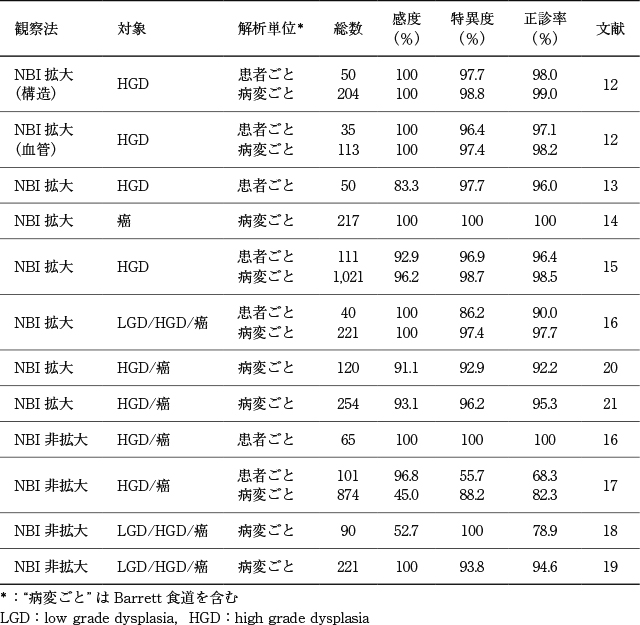
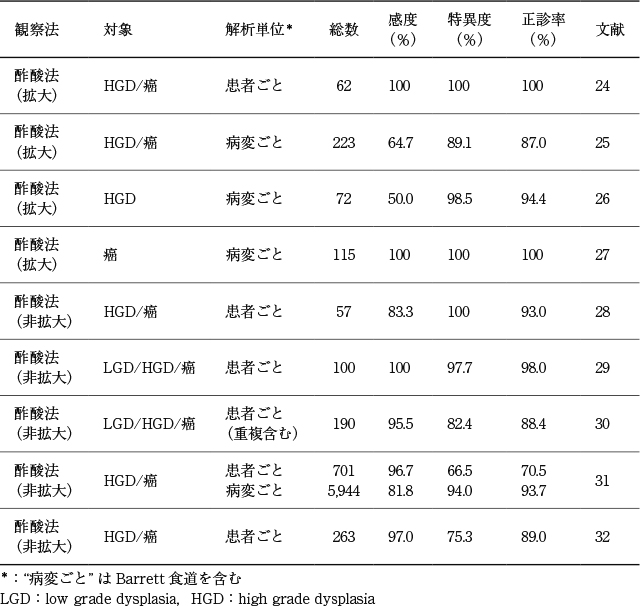
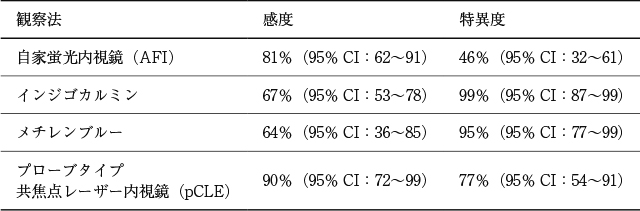
欧米ではBarrett食道表在腺癌やdysplasiaのスクリーニング法としてランダム生検(いわゆるシアトルプロトコール)が推奨されているが,先進施設では画像強調併用内視鏡を用いたターゲット生検が併用されている.米国消化器内視鏡学会(ASGE)Technical Committeeによるメタアナリシスの報告では,酢酸法,NBIにおいては,その診断精度が一定の基準(内視鏡患者ごとの感度が90%以上,陰性的中率が98%以上,特異度が80%以上)を上回っており,サーベイランスにおけるターゲット生検時の併用が推奨されている.一方で,自家蛍光内視鏡検査やインジゴカルミン,メチレンブルー染色による色素内視鏡検査,プローブタイプ共焦点レーザー内視鏡検査は,いずれも感度・特異度ともに低く,推奨はされていない
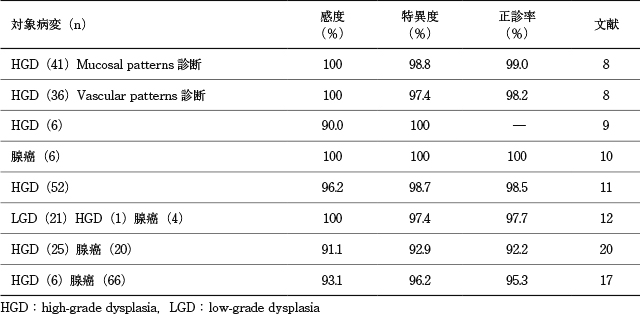
8).同解析に含まれたNBIに関する研究の多くは拡大内視鏡を併用しており,NBI併用拡大内視鏡の診断能は,感度94%(95%CI:83~98),特異度94%(95%CI:81~99)と優れた成績であった
9)~13).酢酸法併用拡大観察の報告は同解析に含まれなかったものの,その他の研究において有用性が示されている
14)~17).本邦からの報告に限ると,NBI併用拡大観察,酢酸法併用拡大観察の診断能はさらに良好であり
11),17)~20),拡大内視鏡を併用することで病変の質的診断能の向上にも寄与することが示唆される(Table 16).
最近ではBarrettʼs International Group(BING)ワーキンググループがNBI併用拡大内視鏡所見に関する簡略化した新しい国際分類を作成し,国際多施設共同研究を行った結果,HGD/表在腺癌診断おいて,高い診断精度と良好な観察者間一致率が示された
21).
以上,画像強調併用拡大内視鏡検査が食道腺癌の範囲診断に有用であるという直接的なエビデンスはなかったが,存在診断に有用であるとする報告は多くみられた(Table 16).連続的に腫瘍の存在診断(癌・非癌診断)を行い,腫瘍境界線を決定することが範囲診断であるという考えに基づけば,画像強調併用拡大内視鏡検査がBarrett食道内および扁平上皮下に進展する表在腺癌の範囲診断の向上に寄与することが示唆されるため,食道表在腺癌の範囲診断にその使用を弱く推奨する.
CQ13:最⼤⻑3cm以上のBarrett食道(LSBE)に発⽣した食道表在腺癌に対する内視鏡切除前の範囲診断で,周囲⽣検を行うことは推奨されるか.
推奨文:最⼤⻑3cm以上のBarrett食道(LSBE)に発⽣した食道表在腺癌に対する内視鏡切除前の範囲診断では,周囲⽣検を行うことを弱く推奨する.
修正Delphi法による評価:中央値7,最低値4,最高値8
エビデンスの強さ:D
解説:本邦以外の諸外国では,最大長3cm以上のBarrett食道をLSBEと呼称することが多い.本邦においてLSBEは極めて稀なものの,LSBEに発生した食道表在腺癌の範囲診断は時に困難なことがあり,周囲生検を行うべきかは重要な問題である.CQ13に対し文献検索を行ったところ,PubMed:1,921編,Cochrane:107編,医中誌:239編が抽出された.この2,267編を一次スクリーニングにかけ,さらに12編を二次スクリーニングにかけたが,CQに直接関連する論文は抽出されなかった.それに類似する状況を検討した論文6編をハンドサーチで抽出した.
LSBEでは癌やHGDの周囲にも広範にLGDが広がっていることがあり
22),時に腺癌の範囲診断は非常に困難である.欧州からのBarrett食道表在腺癌に対する内視鏡治療の報告では,87例に対してESDが施行され,SSBEでのR0切除率(対HGD)が85%であったのに対し,LSBEではわずか48%であった
3).本邦でも,Barrett食道表在腺癌に対するESD 193例のうち,SSBEでのR0切除率は91%であったのに対し,全周3cm以上のLSBEでは70%とされており(著者照会データ)
4),LSBEでの病変範囲診断の困難さが示唆される.よって,範囲診断の補助的な役割としての病変周囲陰性生検の有用性を検討する必要があるが,今回の検索ではBarrett食道の長さに関わらずBarrett食道表在腺癌の範囲診断に病変周辺部の生検が有用であるという直接的な文献は抽出されず,検討を行うことができなかった.
一方,生検による病理診断の問題点として,小さな生検検体での診断の困難さ(特にLGD)が挙げられる.欧米でもLGDの診断に関しては病理医間の診断一致率が低いことが問題視されており
23),欧米のガイドラインの多くは2人以上の病理医(うち少なくとも1人は消化管専門の病理医)が生検診断に携わるよう推奨している
24)~27).また,生検検体にp53免疫染色を追加することでLGDの病理医間の診断一致率が改善したという報告もあり
28),29),英国のガイドラインでは生検検体に補助的にp53免疫染色を行うことを推奨している
26).
このように,最大長3cm以上のBarrett食道(LSBE)に発生した食道表在腺癌の範囲診断において周囲生検を行う明確な根拠はない.しかしながら,過去の報告からLSBEでは腺癌と種々の異型度のdysplasiaが混在する傾向があり,そのことが内視鏡的な範囲診断を困難にし,その結果として,ESD後の病理学的切除断端(水平断端)が陽性となるリスクが高まる(R0切除率が低下する)ことが推察される.以上より,最大長3cm以上のLSBEに発生した食道表在腺癌に対する内視鏡切除前の範囲診断においては,画像強調併用拡大観察(CQ12参照)に加え,病変周囲からの生検による病理学的評価を行うことを弱く推奨する.
CQ14:食道表在腺癌の内視鏡切除前の深達度診断に,EUSを行うことは推奨されるか.
推奨文:食道表在腺癌の内視鏡切除前の深達度診断にはEUSを行わないことを弱く推奨する.
修正Delphi法による評価:中央値8,最低値6,最高値9
エビデンスの強さ:C
解説:食道表在腺癌に対する内視鏡切除の適応は主に術前の深達度診断により決定される.しかし,深達度診断に有用なモダリティは明らかになっていない.深達度診断にEUSを行うことが推奨されるかどうかが明確になれば,臨床決断の大きな助けとなることが期待される.
本CQに対する文献検索の結果,PubMed:243編,Cochrane:20編,医中誌:28編の論文が抽出された.この291編を一次スクリーニングにかけ,さらに21編を二次スクリーニングにかけて,最終的に6編の論文
30)~35)を対象に定性的システマティックレビューを行った.
今回検討した6編で使用されているEUSの仕様に関しては,ラジアル型が3編
30),32),33),リニア型が1編
31),コンベックス型が1編
34),細径プローブが1編
35)であった.EUSの診断能についてはpathological T1aとT1bを分ける深達度診断の正診率が76.4~85.4%と報告されている
30)~35).Mayらの食道表在癌94例(うち腺癌77例)の前向き研究では,白色光による肉眼型に基づく深達度診断の正診率は83.4%であり,一方EUSの正診率は79.6%で白色光と有意差がみられなかったという報告
35)はあるが,それ以外に白色光観察に対するEUSの上乗せ効果について直接言及した研究は今回見出せなかった.
本CQに対する文献検索の結果からは,ランダム化比較試験やメタアナリシスなどといったエビデンスレベルの高い研究は検出されなかった.また,採用した研究はいずれも欧米からの報告であり,多くはLSBEを背景とした患者が解析対象となっていた
30),31),34).一方,日本人ではshort segment Barrett食道(SSBE)の頻度が高い
36)とされている.EUSによる深達度診断の正診率をみた2つの研究では,食道胃接合部とそれ以外で比較すると,それぞれ68.6%,92.9%(P<0.001)
35),47.6%,87.1%(P<0.001)
37)と食道胃接合部で有意に正診率が低かったと報告されている.このように,日本人に多いSSBE由来の食道表在腺癌に対するEUSの深達度診断は,他の部位より難しい可能性が高い.実際に有馬らによる日本人のBarrett食道表在腺癌に対するEUSの検討でも,正診率は73%であったがT1aの感度が56%と低く浅い病変を深く読みすぎる傾向にあったと報告している
38).
EUSによる患者負担,コスト増加,偶発症に関しては今回研究が少なく詳細な検討はできていないが,益と害のバランスからは少なくとも食道表在腺癌患者に深達度診断として一律にEUSを施行することは推奨できない.以上より,食道表在腺癌の内視鏡切除前の深達度診断に一律にはEUSを行わないことを弱く推奨する.
第2章 食道腺癌内視鏡切除
【序説】
2017年に上梓された食道癌診療ガイドライン2017年版(第4版)
1)では,Barrett食道表在腺癌について,術前にT1a-M癌と診断されたもの,すなわち“clinical(c)T1a-M癌を適応として内視鏡切除を行うことが強く推奨”されており,この点においては世界的にコンセンサスが得られているといえる.しかし,実際の切除法に関しては,本邦ではESDが,海外ではEMRが主流である点で乖離がみられている.これは当該施設でESDを日常診療として導入しているか,正確な内視鏡診断が行えているかどうかなどが影響していると考えられるほか,病変切除後にラジオ波焼灼療法(RFA)が施行できる環境であるかによって異なってくると考えられ,RFAが承認されていない本邦ではより確実な病変切除が期待できるESDが,RFAによる追加焼灼を行うことのできる海外ではR0切除にこだわらないEMRが許容されている,と解釈することもできる.今回は,この背景の相違も考慮しつつ,2つの手技における根治性および安全性についてのclinical question(CQ)を立て,システマティックレビューをもとに推奨文を作成した.
一方,切除後の組織検査でpathological(p)T1a-EP(上皮内にとどまる)/SMM(浅層粘膜筋板にとどまる)/LPM(深層粘膜筋板に達しない)癌であれば内視鏡切除で治癒することが期待できる
2),3)が,pT1a-DMM(深層粘膜筋板に浸潤する)癌については明確な指針がない.そこで本ガイドラインでは,pT1a-DMM癌の治癒判定に関するCQを立て,食道表在腺癌のリンパ節転移リスクや予後に関する最新のエビデンスを含めたシステマティックレビューを行い,推奨を作成した.推奨のまとめを以下に図示する(Figure 8).
CQ15:内視鏡治療適応となる食道表在腺癌の切除法として,ESDはEMRより推奨されるか.
推奨文:内視鏡治療適応となる食道表在腺癌に対する根治的な切除法として,EMRよりESDを強く推奨する.
修正Delphi法による評価:中央値9,最低値7,最高値9
エビデンスの強さ:B
解説:転移の危険性が低い食道表在腺癌には内視鏡切除が行われている.本邦ではESDによるR0切除が試みられるが,海外では主にEMRによる切除が施行されており,結果的に分割切除となるケースも少なくない.そこで,内視鏡治療適応となる食道表在腺癌の切除法として,ESDはEMRより推奨されるかというCQに対して文献検索を行ったところ,PubMed:523編,Cochrane:151編,医中誌:26編,および追加論文1編の論文が抽出された.この701編を一次スクリーニングにかけ,さらに74編を二次スクリーニングにかけて,最終的に26編の論文を対象に定性的システマティックレビューを行った.
食道表在腺癌に対するEMRの一括切除率は50.0%(95%CI:44.9~55.1)
2),4)~8),ESDの一括切除率は96.4%(95%CI:95.2~97.7)
2),8)~20)であった.また,EMRのR0切除率は39.7%(95%CI:28.4~51.0)
2),8),ESDのR0切除率は81.9%(95%CI:79.3~84.5)
2),8),9),11)~19)であった.ESDの一括切除率,R0切除率はEMRに比べ高率であった.
食道表在腺癌に対するEMRの遺残再発率は12.4%(95%CI:10.7~14.1)
2),4)~6),8),21)~24)であった.一方,ESDの遺残再発率は2.5%(95%CI:1.3~3.6)
2),8)~16),18)~20)であった.EMRとESDの平均観察期間はそれぞれ4.2年
2),4)~6),8),21)~24)と2.8年
2),8)~11),13)~16),18)~20)で,ESDの観察期間が短かったものの,ESDの遺残再発率はEMRに比べ低率であった.
食道表在腺癌に対する内視鏡切除の偶発症発生率(後出血,穿孔,狭窄)に関しては,EMRが9.3%(95%CI:8.1~10.4)
4)~8),21),23)~28),ESDが10.5%(95%CI:7.5~13.5)
8)~11),13),15),16),18),20)であった.後出血,穿孔,狭窄のそれぞれに対して各々の報告をまとめると,EMRでは後出血率3.1%(95%CI:2.4~3.8)
4)~8),21),23),25)~28),穿孔率0.4%(95%CI:0.1~0.6)
4)~8),21),23)~28),狭窄率6.4%(95%CI:5.5~7.5)
4)~8),21),23),24),27),28)であった.一方,ESDでは後出血率2.8%(95%CI:1.0~4.5),穿孔率1.5%(95%CI:0.15~2.9),狭窄率6.3%(95%CI:3.8~8.7)であった
8)~11),13),15),16),18),20).
本CQにおけるシステマティックレビューで抽出された論文では,入院期間と治療時間の延長に関して十分に評価することはできなかった.
EMRと比較してESDは一括切除率,R0切除率ともに高く,遺残再発率が低かった.偶発症(後出血,穿孔,狭窄)に関しては概ね同程度であった.以上より,内視鏡治療適応となる食道表在腺癌に対する根治的な切除法として,EMRよりESDを強く推奨する.
CQ16:内視鏡でR0切除が得られた脈管侵襲陰性の分化型pDMM食道腺癌に対する追加外科切除は経過観察よりも推奨されるか.
推奨文:内視鏡でR0切除が得られた脈管侵襲陰性の分化型pDMM食道腺癌に対して,追加外科切除を行わないことを弱く推奨する.
修正Delphi法による評価:中央値9,最低値8,最高値9
エビデンスの強さ:C
解説:内視鏡切除後の組織所見で,pEP/SMM/LPMであった食道腺癌の転移再発リスクは極めて低く,追加治療は必要ないと考えられている.一方,pDMM癌における追加治療(主に外科切除)の必要性は明確になっていない.そこで,R0切除の得られた脈管侵襲陰性の分化型(低分化型成分の混在例を除く)pDMM癌で,追加治療を行うことが推奨されるかどうかというCQに関して文献検索を行ったところ,PubMed:77編,Cochrane:6編,医中誌:3編,および追加論文6編の論文が抽出された.この92編を一次スクリーニングにかけ,さらに35編を二次スクリーニングにかけた上で,最終的に17編の論文を対象に定性的システマティックレビューを行った.
食道腺癌に対する外科切除後に脈管侵襲陰性の分化型pDMM食道腺癌と病理学的に診断された計105症例の手術標本におけるリンパ節転移率は0%(95%CI:0~2.5)であった
3),29)~32).一方,内視鏡切除後に脈管侵襲陰性の分化型pDMM食道腺癌と診断され経過観察を行った計200症例における転移再発率は0.5%(95%CI:0~2.1)であり
3),4),14),23),32)~39),1例にリンパ節転移再発を認めた
32).
主にpT1aの食道腺癌に対する外科切除の5年生存率は80.2~89.3%
14),29),30),34),35),5年疾患特異的生存率は94.4~98.4%
30),31),37),38)であった.一方,主にpT1aの食道腺癌に対する内視鏡切除の5年生存率は91.5~100%
2),4),16),23),39),5年疾患特異的生存率は96.2~100%
2),14),16)であった.食道腺癌に対する外科切除と内視鏡切除の5年疾患特異的生存率はいずれも高いものの,外科切除の5年生存率は,内視鏡切除と比べてやや低い傾向にあった.ただし,手術成績に関しては主に海外からの報告を集計したものであり,SSBE由来の癌が多い本邦とLSBEからの癌が多い海外では,選択される術式の傾向が異なると考えられることから,上記の手術成績をそのまま本邦に置き換えて考察することには慎重になるべきであると思われる.
なお,上記の理由も含め,本CQに対するシステマティックレビューにおいて,外科切除による周術期死亡,QOLの低下および治療に要する入院日数を十分に評価することはできなかった.
以上より,内視鏡でR0切除が得られた脈管侵襲陰性の分化型pDMM食道腺癌に対して追加外科切除を行った場合の転移再発リスクは,経過観察した場合の転移再発リスクとほぼ同等と考えられる.したがって,内視鏡でR0切除が得られた脈管侵襲陰性の分化型pDMM食道腺癌に対して,追加外科切除を行わないことを弱く推奨する.
第3章 食道腺癌内視鏡切除後のサーベイランス
【序説】
Barrett食道患者に対するサーベイランスの目的はHGDや異時性食道内多発癌を早い段階で発見することである.食道癌診療ガイドライン2017年版(第4版)
1)では,十分なエビデンスがないものの“Barrett食道をサーベイランスすることが弱く推奨”されており,食道腺表在癌内視鏡切除後のBarrett食道にもサーベイランスが必要と考えられる.ここでは,食道腺癌内視鏡切除後のサーベイランス期間や方法を明確にするため,これらに関連するclinical question(CQ)を立て,推奨を作成した.
システマティックレビューを行う上で,本邦と欧米の内視鏡治療法やサーベイランス方法の違いを理解する必要がある.欧米においては,食道表在腺癌の内視鏡治療時にすべてのBarrett食道を焼灼する治療が一般的となっており,本邦の表在腺癌に対する内視鏡切除のみと比べ大きく異なっている.Barrett食道焼灼術後には扁平上皮が再生するため,内視鏡でのサーベイランス方法も本邦とはかなり異なると考えられる.したがって,本ガイドラインの内視鏡切除後サーベイランスに対するCQとしては,欧米の食道腺癌内視鏡治療+Barrett食道焼灼術後を対象にした論文は採用せず,内視鏡切除のみで経過観察した論文に絞りシステマティックレビューを行った.
また,サーベイランスの方法に関しても,欧米ではシアトルプロトコールによるランダム生検が標準的に行われており,本邦における狙撃生検を基本としたサーベイランス方法とは異なっている.いわゆる白色光での食道腺癌診断能は,欧米論文ではランダム生検を含めて算出されており,白色光のみの食道腺癌診断能の評価は困難である.一方,本邦では画像強調内視鏡の普及が著しく,それを日常的に使用できる施設が多く占めている.これら画像強調内視鏡の中には,食道腺癌の診断に高い精度を持つことが報告されているものもある.以上の背景をもとに,ここでは各種画像強調内視鏡検査の食道腺癌・dysplasiaに対する診断精度に関するシステマティックレビューを行い,本邦におけるサーベイランスで推奨できるモダリティを検討した.推奨のまとめを以下に図示する(Figure 9).
CQ17:食道表在腺癌内視鏡切除後の異時性癌のサーベイランスで,どの程度の間隔の内視鏡検査が推奨されるか.
推奨文:食道表在腺癌内視鏡切除後のサーベイランスで,最大長3cm以上のBarrett食道に対しては1年に1度程度の内視鏡検査を弱く推奨する.
修正Delphi法による評価:中央値8,最低値8,最高値9
エビデンスの強さ:C
解説:食道表在腺癌内視鏡切除後のサーベイランスで,どの程度の間隔の内視鏡検査が推奨されるかというCQに関して文献検索を行ったところ,PubMed:184編,Cochrane:91編,医中誌:2編,および追加論文1編が抽出された.この278編を一次スクリーニングにかけ,さらに67編を二次スクリーニングにかけた上で,最終的に3編の論文を対象に定性的および定量的システマティックレビューを行った.
サーベイランス頻度を検討するにあたり,益として「異時性食道内多発癌・dysplasiaの早期発見率上昇」,「必要検査数の減少」,「患者負担の軽減」,「医療コストの低下」,害として「間隔延長での異時性食道内多発癌の発見率の低下」,「間隔短縮での追加検査による有害事象」を考慮した.「患者負担の軽減」,「医療コストの低下」については検討対象となる論文が抽出されなかった.「間隔短縮での追加検査による有害事象」については,消化器内視鏡関連の偶発症に関する第6回全国調査報告
2)によると,上部消化管内視鏡検査での偶発症率は0.005%,死亡率は0.00013%と報告されており,この検討項目が与える影響はそれほど大きくないと考えられた.以上より,「異時性食道内多発癌・dysplasiaの早期発見率上昇」,「必要検査数の減少」,「間隔延長での異時性食道内多発癌の発見率の低下」を検討項目として重視した.しかし,これらの項目を直接的に検討できる論文,すなわち食道表在腺癌内視鏡切除後のサーベイランス間隔を比較したランダム化比較試験は存在しなかった.そこで,食道表在腺癌内視鏡切除後の異時性食道内多発癌発生率から間接的に検討することとした.また,欧米の論文では,病変の内視鏡切除後にBarrett食道全体を焼灼しており,本邦との違いが大きく対象に含めなかった.そのため,本邦からの食道表在腺癌内視鏡切除後の観察研究3編を検討対象とした.
なお,本邦でのLSBEは,食道癌取扱い規約
3)で全周3cm以上と定義されており,欧米の基準である最大長3cmとは異なっている.本章ではこれらの記載が頻出するため,本邦の基準である全周(circumferential)3cmに基づくLSBE,SSBEをLSBE-C,SSBE-C,欧米の基準である最大長(maximum)3cmに基づくLSBE,SSBEをLSBE-M,SSBE-Mと記載した.
内視鏡切除後Barrett食道からの異時性食道内多発癌発生
Abeらは,Barrett食道表在腺癌238症例(SSBE-C由来204例,LSBE-C由来34例)の長期予後の検討を行い,SSBE-C 年率0.26%(3例/1,161人年),LSBE-C 年率0.62%(1例/164人年)の発生率で異時性食道内多発癌が指摘されたと報告している
4).その他の論文2編
5),6)も含めた3編のデータを,固定効果モデル,分散逆算法を用い統合した結果,異時性食道内多発癌発生率の統合値はSSBE-C 年率0.29%(95%CI:-0.35~0.97,3例/1,262人年),LSBE-C 年率0.70%(95%CI:-1.90~3.30,2例/176人年)であった
4),5).
Barrett食道からの腺癌発生
上記の食道表在腺癌内視鏡切除後の長期予後を検討されたLSBE患者数が少ないため,癌既往がないLSBEに関しての論文データを補足する.本邦からLSBE-M(132例)のサーベイランスにおいて,年率1.2%(3例/251人年)で食道癌発生がみられたと報告されている
7).また,欧米からは,dysplasiaや癌を認めないBarrett食道からのHGD/腺癌の発生率をSSBE-MとLSBE-Mとで分けて検討した結果,SSBE-M(882例)からの食道腺癌発生率は年率0.29%(14例/4,767人年)であるのに対し,LSBE-M(1,061例)からは年率0.91%(67例/7,321人年)と,LSBE-Mのほうが有意差を持って高かったという報告がある
8).一般的にはリスクが低いと考えられる,食道癌の既往がないBarrett食道であっても,LSBE-Mでは年率1%前後で食道腺癌が発生していた.
ところで,早期胃癌の内視鏡切除後には,年率2.3%で異時性胃癌が発生すると報告され
9),1年に1度程度以上のサーベイランスが行われている.前述したように食道表在腺癌内視鏡切除後のLSBE-Cの異時性食道腺癌発生率は0.7%と胃癌のそれと比較してやや低いが,LSBE-Mの年率1%前後で食道腺癌発生が報告されていること,食道腺癌の発見が難しいこと,表在腺癌内視鏡切除後患者がハイリスクであることを考えると,胃癌同様のサーベイランス間隔が妥当と考え,LSBE-Mの内視鏡切除後には1年に1度程度の内視鏡検査を推奨するとした.一方,SSBEの内視鏡切除後患者では年率0.2~0.3%の異時性食道腺癌発生率を認めており,SSBEの内視鏡切除後には2~3年に1度以上の頻度で内視鏡検査が考慮される.しかし,今回のシステマティックレビューではどの程度の頻度で内視鏡検査が必要なのかは結論が出せなかった.
食道表在腺癌内視鏡切除後の異時性食道内多発癌発生について検討できた患者数は少なく,エビデンスの強さは限定的ではあるが,益と害のバランスなどを勘案し,推奨文は「食道表在腺癌内視鏡切除後のサーベイランスで,最大長3cm以上のBarrett食道に対しては1年に1度程度の内視鏡検査を弱く推奨する」とした.
CQ18:食道表在腺癌内視鏡切除後のサーベイランスで,画像強調内視鏡や拡大内視鏡検査を行うことは推奨されるか.
推奨文:食道表在腺癌内視鏡切除後のサーベイランス内視鏡検査で,画像強調内視鏡および拡大内視鏡の使用を弱く推奨する.
修正Delphi法による評価:中央値7.5,最低値7,最高値9
エビデンスの強さ:C
解説:わが国において,narrow band imaging(NBI)をはじめとする光デジタル技術による画像強調内視鏡は広く使用されており,インジゴカルミンなどの色素や酢酸は通常どこの施設でも使用可能である.NBIを使用することで,病変のコントラストが強調され,拡大内視鏡を併用することで血管や表面構造の詳細観察が可能となる.また,酢酸法は1~3%の酢酸をBarrett食道に散布すると食道内円柱上皮はいったん白色化し,一定時間で癌/dysplasiaが周囲に比較して発赤してくることでコントラストができる技術である.酢酸散布後に拡大内視鏡を併用することで表面構造の詳細観察も可能となる.
本CQは,食道表在腺癌内視鏡切除後のサーベイランスに関するものであるが,序説の通り,欧米においてはBarrett食道を焼灼する治療が一般的となっているため,内視鏡切除後の焼灼していないBarrett食道に対するサーベイランスでの画像強調内視鏡および拡大内視鏡観察の有用性を評価できる文献は,抽出されなかった.また,欧米論文では白色光での食道腺癌診断能はランダム生検を含めて算出されており,比較対象としての白色光のみの食道腺癌診断能の評価は困難である.そのため,ここでは内視鏡治療未施行のBarrett食道に対する食道腺癌サーベイランスにおける画像強調内視鏡や拡大観察の有用性(感度,特異度,陰性的中率)を評価している文献を中心に,検索を行った.その結果,PubMed:295編,Cochrane:33編,医中誌:16編の論文が抽出された.この344編を一次スクリーニングにかけ,さらに29編を二次スクリーニングにかけて,最終的に画像強調内視鏡によるサーベイランスに関するメタアナリシス1編
10)とその採用論文9編
11)~19),NBIに関する論文2編
20),21)とblue laser imaging(BLI)に関する論文1編
22),酢酸に関するメタアナリシス1編
23)とその採用論文9編
24)~32)の合計23編に対して,定性的システマティックレビューを行った.
各モダリティの有用性をみる上で必要な検討項目を,益として「表在癌もしくはdysplasiaの発見」と「生検個数を減少させる効果」,害として「検査時間の延長」と設定した.しかし,「生検個数を減少させる効果」については,ランダム生検を基準とした論文のみ存在し,狙撃生検の数を減少させる効果をみた論文は,抽出されなかった.「検査時間の延長」に関しても検討されている論文が少なく,検討困難であった.したがって,各モダリティの「表在癌もしくはdysplasiaの発見」における有用性について検討した.
システマティックレビューの対象となった論文で,表在癌もしくはdysplasiaの発見における感度,特異度などの診断能をみたところ,NBIは感度94%(95%CI:83~98),特異度94%(95%CI:81~99)
10)(Table 17),酢酸法は感度92%(95%CI:83~97),特異度96%(95%CI:85~99)
23)(Table 18)であり,いずれも優れた成績であった.Barrett食道のサーベイランスにおける狙撃生検と併用するモダリティに対しては,米国消化器内視鏡学会(ASGE)よりpreservation and incorporation of valuable endoscopic innovations(PIVI)という基準が提唱され,感度90%,特異度80%,陰性的中率98%を超えるモダリティは有用であるとされている
33).酢酸法とNBIはこのPIVIの閾値を上回っており,ASGEからも有用なモダリティとして承認されている
10).また,NBI拡大観察の感度・特異度
11)~15),19)~21)は,全体的にNBI非拡大観察
16)~19)に比べて高く,NBIと拡大内視鏡との併用がより有用であることが示唆された(Table 17).
一方で,欧米の国際グループから白色光観察とBLI観察を比較している論文が1編抽出された
22).この論文では,BLIのほうが腫瘍の肉眼型や境界診断の評価に優れていたと報告しており,BLIはNBIと同等の効果が期待できる.また,自家蛍光内視鏡(AFI)やインジゴカルミン,メチレンブルー,プローブタイプ共焦点レーザー内視鏡(pCLE)は,それぞれ感度と特異度が低く
10),推奨できる成績ではなかった(Table 19).
酢酸法やNBI,拡大観察の有用性の検討において,よくデザインされた比較試験はないものの,前述のようにこれらモダリティの診断成績は非常に良好であった.ただし,これらのモダリティの追加で発生する検査時間延長は,患者負担増につながる可能性がある.
以上,益と害のバランス,エビデンスの程度など勘案し,「食道表在腺癌内視鏡切除後のサーベイランス内視鏡検査で,NBIや酢酸法による画像強調内視鏡および拡大内視鏡の使用を弱く推奨する」とした.