2020 年 62 巻 4 号 p. 457-469
2020 年 62 巻 4 号 p. 457-469
内視鏡医が日常診療で遭遇する機会の増えている直腸神経内分泌腫瘍(NET)であるが,診断,治療から治療後の対応に至るまで,十分にコンセンサスが得られていない事項が多く,その取り扱いに苦慮することが経験される.内視鏡治療適応についても,腫瘍径1~1.5cmの病変の扱いなどさらなる検証を要するが,少なくとも,最も高頻度に遭遇する,粘膜下層にとどまる1cm未満の直腸NETが内視鏡治療の適応であることについてはコンセンサスが得られている.そのような病変に対する内視鏡治療手技としては,有効性,安全性,患者負担の観点から,ESMR-LやEMR-Cといった通常のEMRに工夫を加えた手技が推奨される.内視鏡治療後には,切除病変の病理評価に基づき追加手術の必要性を判断するが,細胞増殖能や脈管侵襲などの結果によって判断に迷う症例も多い.特に脈管侵襲については,病理における免疫・特殊染色の使用に伴い,粘膜下層にとどまる小さなNET G1病変でも脈管侵襲陽性例が高頻度に見られることが報告されており,その取り扱いについてさらなる議論が望まれる.
直腸NETは,大腸内視鏡に携わる内視鏡医にとっては稀な疾患というよりも日常臨床において定期的に遭遇しうる疾患であり,臨床上の取り扱いに関して精通しておく必要がある.しかし,治療法選択から治療後対応にいたるまで,コンセンサスの得られていない事項も多く,日常臨床において対応に迷うことが比較的良く経験される.そこで本稿では,直腸NETの内視鏡診断と治療について,現在分かっている事項と未解明の事項両方を概説し,今後の直腸NET診療向上にむけて必要なことを考える.
比較的稀な腫瘍とされる神経内分泌腫瘍(neuroendocrine tumor;以下NET)であるが,近年では日本のみならず世界的にも患者数の増加が報告されており,注目を集めている 1),2).その発生部位は,下垂体,副甲状腺,肺,膵臓,消化管と多岐に渡るが,特に膵臓や消化管に発生することが多い.消化管の中では,食道,胃,十二指腸,小腸,虫垂,結腸,直腸のいずれからの発生も報告されているが,本邦では直腸NETの頻度が最も高い.日本におけるNETの全国調査結果によると,消化管NETは2010年時点で2005年よりも増加しており,中でも直腸NETを含めた後腸NETが最も多く,2010年時点での後腸NETの人口10万人あたりの有病患者数,推定年間新規発症患者数は各々4.52人,2.10人となっている 1).直腸NETの増加理由のひとつとしては,内視鏡技術の進歩,内視鏡受診機会の増加が推定され,その意味では今後さらに直腸NETの発見が増える可能性も考えられる.
(2)用語の説明とWHO分類ここで,直腸NETの「NET」という用語について確認する.以前は,直腸「カルチノイド」という用語が使用されることがほとんどであったが,近年では,WHO分類に準じて直腸「NET」という用語が使われることが多い.組織所見(特に異型度)を重視した病理学的分類である「カルチノイド腫瘍」に対して,「NET」は「細胞増殖能の指数」を重視してきたWHO分類に基づくものである 3)~6).これまでのWHO分類では,細胞増殖能が高い(Ki-67指数が20%を超える)ものの組織所見からはNeuroendocrine carcinoma(NEC)ではなくNETと考えられる病変の分類が困難という問題やKi-67指数2-3%のNETのグレード分類をどうするかという問題があった 4).しかし,最近のWHO分類の改訂により,NET G3という概念が新設され,またNET G1とG2のKi-67指数のカットオフ値が3%と明記されたことによりこれらの問題が解決された 6).Table 1に最新のWHO分類における神経内分泌腫瘍の分類を提示する.

神経内分泌腫瘍WHO分類.
NETは,腫瘍細胞が粘膜深層の内分泌細胞より発生する上皮性腫瘍であるが,腸管内腔側への発育傾向は強くなく,粘膜筋板内,さらには粘膜下層(SM)以深へと膨張性に発育するがゆえ,表面が非腫瘍性粘膜上皮に覆われた,弾性硬な,無径性~亜有径性の粘膜下腫瘍(SMT)様隆起を呈する.色調は黄色調~正色調で,表面には拡張した血管が見られることも多く(Figure 1),病変の増大・進行に伴い,表面に陥凹や潰瘍を認めることもある.超音波内視鏡検査(EUS)では,通常第2層深層~第3層浅層に主座をおく境界明瞭で内部エコー均一な低エコー腫瘤として描出されることが多いが,増大・進行に伴い内部エコーが不均一となり,浸潤による層構造の破壊も見られる.
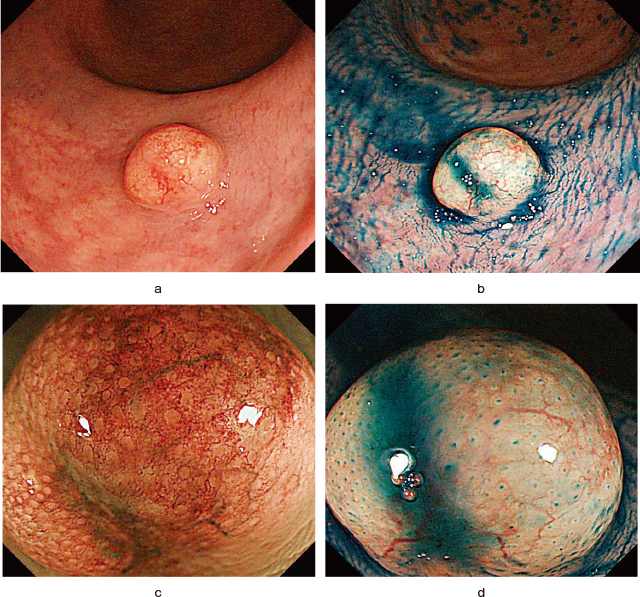
直腸NETの大腸内視鏡像.
a:通常光(非拡大).下部直腸に7mm大の黄色調粘膜下腫瘍様隆起を認める.
b:色素(インジゴカルミン)内視鏡(非拡大).明らかな表面潰瘍・陥凹は見られない.
c:NBI(拡大).拡張した血管が見られる.
d:色素(インジゴカルミン)内視鏡(拡大).病変が非腫瘍性粘膜に覆われていることが確認される.
直腸NETの発生部位は,直腸の中で下部直腸が最も多いが,病変が歯状線に近い場合など内視鏡画面の死角に病変が存在することも少なくないため,病変を適切に発見するには直腸を死角なく丁寧に観察することが必要である.直腸における内視鏡の反転観察が有用な場合もあるが,反転観察は穿孔のリスクもゼロではないため,安全に反転できない場合は,無理をせずに順方向での丁寧な観察を行うことが重要である.
直腸NET診断において鑑別に挙がる疾患としては,平滑筋腫,脂肪腫,顆粒細胞腫,リンパ管腫,良性リンパ濾胞性ポリープ,悪性リンパ腫,GISTなどのSMTが挙げられる.硬さや色調,肉眼形態といった内視鏡所見が鑑別に有用だが,それだけでは質的診断をつけることは困難なことも多い.そのような状況下,特にNETの診断については内視鏡下生検による病理診断が有用である.直腸NETは,SMT様隆起を呈するものの,正確にはSMTではなく上皮性腫瘍であり,内視鏡下生検による腫瘍の診断能が高い.生検でも診断がつかない場合は,EUSも有用で,さらにEUSガイド下穿刺吸引法(EUS-FNA)が質的診断につながるケースもある.それに加えて,小さい病変であれば,診断的内視鏡治療という形で,病変全体を内視鏡できれいに切除し,質的診断をするという方法もある.小さいSMT様隆起で,NETが疑われる場合は,生検により病変の大部分が取られ,治療に際し病変がはっきりしない,もしくは残っていてもごくわずかで治療後病理評価が十分にできない可能性を考慮し,あえて生検を行わずに,診断的内視鏡治療を行うこともありうる.
直腸NETを含めた大腸NETの治療方針について,治療前検査で転移陽性と判断される場合は,その所見・進行度に応じて,外科治療や薬物療法を選択する.一方で,治療前検査で明らかな転移所見がない場合は,早期消化管癌に対する治療同様,病変の転移リスクに応じて治療方針を決定する.転移リスクがない(極めて低い)と判断される場合は内視鏡切除(施設によって経肛門的手術を選択する場合もある)を,転移リスクがあると判断される場合はリンパ節郭清を伴う直腸切除(断)術を選択する.
直腸NETの転移に関連する因子としては,過去の主に手術例を用いた研究結果から,腫瘍径,深達度,細胞増殖能,脈管侵襲が知られている 7)~15).このうち,治療前診断の対象である腫瘍径,深達度をもとに治療方針を決定する.これに加えて,特に日本では,病変表面の陥凹・潰瘍を転移関連因子と考え,治療法選択に際し参考にすることがある.細胞増殖能については,生検検体にKi-67(MIB1)の免疫染色を行うなどしてグレード分類(NET G1/G2)を行う考え方もあるが,細胞増殖能は本来病変全体で評価すべきものであり,生検検体による判断の有用性は限定的である.細胞増殖能の代表的な評価指標としてKi-67指数が挙げられるが,腫瘍の中でKi-67の染まりにばらつきがあることが知られ,病変の一部のみを採取する生検検体でのKi-67指数の評価は不十分と言わざるを得ない.
腫瘍径,深達度を用いた治療方針の決定について,本邦の「膵・消化管神経内分泌腫瘍診療ガイドライン」(2019年9月に第2版が発刊)では,「腫瘍径が1cm未満で固有筋層浸潤がなくリンパ節転移を認めないもの」を内視鏡治療の適応としている 16).この点,他の国際ガイドラインを見ても同様であり,腫瘍径1cm未満で深達度が粘膜下層までにとどまる直腸NETを内視鏡治療の適応にすることについてはコンセンサスが得られている 17)~19).
それ以外の腫瘍径が1cm以上,もしくは固有筋層に浸潤する直腸NET病変については,本邦の膵・消化管NET診療ガイドラインでは,「リンパ節郭清を伴う直腸切除(断)術」の適応としている.欧米のガイドラインと見比べると,腫瘍径が2cmを超える病変に対する治療としては,リンパ節郭清の扱いを含めて推奨されている術式がガイドラインによってやや異なるが,いずれも外科的治療を中心に据えている.一方で,腫瘍径が1~2cmの病変における局所治療(内視鏡切除や経肛門的手術)と外科的根治術の選択については,コンセンサスが得られていない.ガイドラインによっては,転移や固有筋層浸潤の所見がなければ,局所治療を推奨しているものもあるが,それを支持するエビデンスはまだ十分ではない.本邦のガイドラインでは,腫瘍径1~2cmでも転移リスクが高いという既報に基づき,リンパ節郭清を伴う手術を推奨するというスタンスをとっている.このスタンスは,将来の転移・再発のリスクを可能な限り低くするという観点から理に適っているが,直腸NETのリンパ節転移リスクについての既報は主に手術症例に基づく後ろ向き研究が多く選択バイアスの問題があるという点,直腸の場合は特に手術の侵襲・QOLへの影響が大きいという点を考慮すると,腫瘍径1cm以上の直腸NET病変すべてに本当に外科的根治術が最初から必要かについては議論の余地がある.「1.2cm,NET G1,脈管侵襲陰性」と「0.9cm,NET G1,脈管侵襲陰性」の間に腫瘍学的にどれくらい違いがあるのか,言い換えると,両者に「リンパ節郭清を伴う直腸切除(断)術」と「内視鏡治療」の侵襲の差に相当するほどの腫瘍学的な違いがあるのかは判断に悩むところであり,腫瘍径1cm以上の直腸NET病変の中にも局所治療(内視鏡治療)のみで治療を完遂できる対象がないか,今後さらなる検証が期待される.腫瘍径1.5cm程度までで他に転移関連因子を有していなければ転移リスクが低い可能性もこれまでいくつか報告されており,まずは,内視鏡治療を行い,その病理結果に応じて追加手術を行うかを決める方針も考えられうる 13),20)~22).
このようにコンセンサスの得られていない項目が複数ある中で,一例として,著者らの施設(国立がん研究センター中央病院)における直腸NETに対する治療方針をFigure 2に提示する 23)~25).腫瘍径,深達度に加えて,表面陥凹・潰瘍の有無も参考にしている.腫瘍径1cm未満で表面陥凹・潰瘍がないような病変は,治療前のEUSは必須とせず,その場で日帰りの内視鏡治療を行っている.
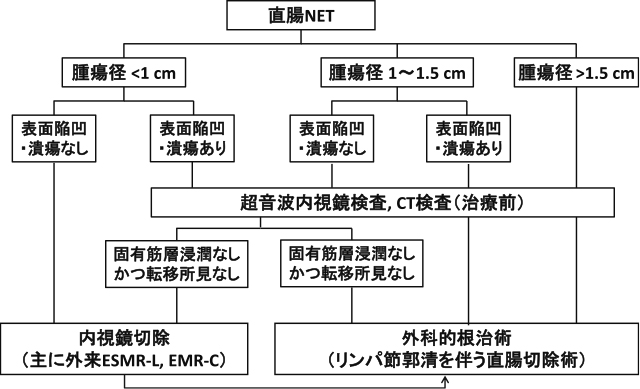
国立がん研究センター中央病院における直腸NETの治療方針.
直腸NETに対する局所治療としては,大きく分けて,内視鏡治療と経肛門的手術がある.経肛門的手術についても安全性・有効性の報告があり,本邦の「膵・消化管神経内分泌腫瘍診療ガイドライン」でも推奨される手技のひとつになっている 16),26)が,内視鏡治療の発達に伴い,簡便に安全かつ有効な治療を提供できる内視鏡治療が直腸NET局所治療の主流となっている.ここでは,内視鏡治療手技選択について述べる.
大腸腫瘍性病変に対する内視鏡治療手技の中で,最も簡便に行える手技はポリペクトミー,内視鏡的粘膜切除術(EMR)であるが,いわゆる大腸ポリープと異なり,大腸NETは前述のように病変の主座が粘膜下層にあるため,ポリペクトミーや従来のEMRでは深部断端が陽性となってしまうリスクが高い.そこで,大腸NETを断端陰性一括切除する方法として,従来のEMRに工夫を加えたmodified EMRや内視鏡的粘膜下層剝離術(ESD)が有用である.modified EMRの代表的なものとして,食道静脈瘤治療用のligation deviceを用いたEndoscopic submucosal resection with ligation device(ESMR-L)法(Figure 3)やキャップを用いた内視鏡的粘膜吸引切除術(EMR-C)がある.いずれも,より確実な深部断端陰性切除を目指し,病変を吸引したうえで切除するという方法だが,腹膜反転部より肛門側に存在するNET病変に対しては,穿孔のリスクをそれほど気にせずにESMR-LやEMR-Cを行うことができる.著者らの施設では,1999年にESMR-Lを直腸NETに対する内視鏡治療法として導入し,それまでのポリペクトミーや従来法EMRに比べて,治療成績(断端陰性一括切除割合)が飛躍的に向上した 23)~25),27)~29).1999年以降,ESMR-Lが150例以上の直腸NETに実施しているが,その断端陰性一括切除割合は97%強と良好な治療成績が得られている.合併症は,1%強に内視鏡的止血術を要する後出血が見られたのみで,穿孔は一例も経験されていない.ESMR-Lは,このように有効性・安全性の点から優れており,かつ日帰り外来治療で対応可能という簡便さが良い点として挙げられる.ESMR-Lは,海外施設を含めた他の多くの施設からもその有用性・安全性が報告されている確立した内視鏡治療法である 30)~36).その意味では,ligation device に直腸NET治療に対する保険適応が認められていないという唯一の問題点が早急に改善されることが望まれる.EMR-Cも,ESMR-L同様に直腸NETに対する良好な治療成績が報告されている 37)~41).当院でも近年は,ligation deviceの保険適応の問題もあり,EMR-Cを選択することも多いが,ESMR-L同様,日帰りで安全に断端陰性一括切除が得られている.Modified EMRには,ESMR-L法,EMR-C法に加えて,2チャンネル法や周囲切開EMR,近年では浸水下EMRなども提案されている 42)~45).
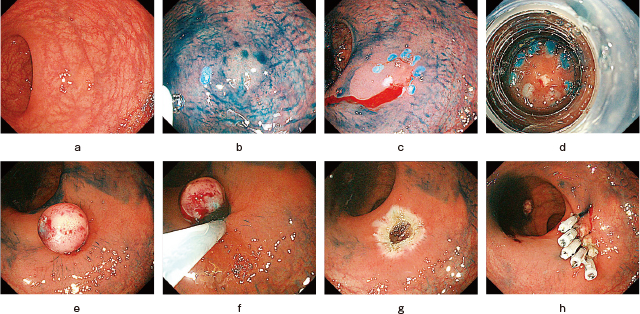
直腸NETに対するESMR-L.
a:下部直腸に5mm大の直腸NETを認める.
b:スネア先端で病変周囲にマーキングを行うと,ligation deviceを用いた吸引の際,良い目印となる.
c:粘膜下層に生理食塩水を用いて局注.
d:体外で内視鏡スコープの先端にligation deviceを装着し直腸にスコープを再挿入.その後マーキングを参考にしながら病変をキャップ内にとらえて十分に吸引し,Oリングをリリースする.
e:Oリング上の絞扼された部分に黄色調の直腸NET病変が入っていることが視認される.
f:Oリングの下にスネアをかけて切除する.
g:切除後潰瘍.病変が偶発症なく一括切除されていることが確認される.
h:必要に応じて潰瘍底をクリップで縫縮する.
ESDについては,最近,早期大腸癌に加えて,最大径5~10mmまでの大腸NETに対するESDが保険収載され,直腸NETに対してESDを施行するケースは今後益々増えると想定される.粘膜下層を剝離する手技であるESDでは,NET病変を上に視認しながら,それより深層の粘膜下層を剝離していくことで,確実な断端陰性一括切除が期待でき,実際に,これまでに良好な治療成績が報告されている 46)~52).但し,問題点としては,現時点ではESDは原則入院治療で行われ,治療に伴う医療費もmodified EMRより高い点が挙げられる.有効性・安全性に加えて,患者負担や医療経済学的観点もふまえて,内視鏡治療(modified EMR,ESD)の使い分けについて今後さらなる議論が必要である.腫瘍径1cm程度までの直腸NET病変であれば,modified EMRで安全かつ簡便に完全切除ができることを考慮すると,現時点では内視鏡治療対象となる直腸NET病変の多くはmodified EMRで切除可能であり,modified EMRで対応するのがベストである,という立場を当院を含めた多くの施設がとっている.一方で,腹膜反転部より口側にNET病変があり穿孔のリスクが懸念される場合や,腫瘍ボリュームが大きくmodified EMRでは一括切除が困難な場合(何らかの理由で1cmを超える直腸NETに対して診断的内視鏡治療を行う場合を含む)はESDの良い適応と言える.実臨床においては,内視鏡治療後に断端陽性となり,内視鏡治療後瘢痕に対して遺残がないか再度内視鏡切除で評価を行いたいというケースも少ないながら考えられ,そのような場合にもESDが有効になることがある.但し,直腸NETの内視鏡治療後瘢痕であれば,比較的高い確率で,ESMR-L法などでも瘢痕部をきれいに内視鏡切除できるため(Figure 4),まずは外来でESMR-Lを試し,それが困難と判断される場合に,あらためて入院ESDで対応するという方法も考慮される.
直腸NET内視鏡治療後瘢痕に対するESMR-L.
a:下部直腸に内視鏡治療(切除断端陽性)後の瘢痕を認める.
b:局注にてある程度リフティングが得られることを確認.
c:ligation deviceを用いて瘢痕部を吸引.
d:Oリングで瘢痕部を絞扼.
e:スネアで切除.
f:切除検体病理像(シナプトフィジン染色).少量の遺残腫瘍成分(矢印)が切除されているのが確認される.
g:切除検体病理像(シナプトフィジン染色).fの矢印部分(遺残腫瘍成分)を拡大.
直腸NETの内視鏡治療後,切除された標本の病理評価結果に基づき,その後の対応を決定する.病理評価においては,質的診断(カルチノイド腫瘍であることの確定診断)は言うまでもなく,前述の直腸NET転移関連因子である腫瘍径,深達度,細胞増殖能,脈管侵襲,そして切除断端を評価する.これらの評価の結果,転移・再発リスクありと判断されれば追加外科手術の検討が必要となる.それ以外は,無治療経過観察となることが多いが,切除断端が陽性もしくは判定不能の場合に追加内視鏡切除を行い,腫瘍遺残の有無を確認することもある.直腸NETは下部直腸に存在することが多く,外科的根治術の,排便機能をはじめとするQOLへの影響が大きいがゆえ,手術を行うかどうかの判断を慎重にする必要がある.
ここで,実臨床で判断に迷うことの多い,細胞増殖能,脈管侵襲,切除断端について説明する.
(1)細胞増殖能の評価と対応細胞増殖能の評価は,核分裂像数(/10 HPF)や,Ki-67の免疫組織化学染色を行いその陽性細胞数の割合を評価するKi-67指数を用いて行う.そしてその結果に基づき,グレード分類を行う.グレード分類はこれまで,NET G1,G2分類のみであったが,最新のWHO分類ではTable 1のようにNET G3も新設されている 6).
NET G1よりもNET G2以上の方が転移のリスクが高いという報告がこれまでに複数出ているが,実臨床においてNET G2以上であればどんな症例にでも追加外科手術を行うべきかどうかは判断に迷うのが現状である 7)~15).例えば,Ki-67指数がわずかに3%を超えるのみで,他に転移リスクを示唆するような所見がない場合,医療者,患者ともに自信をもって手術という選択肢を選ぶところまでには至っていない.その意味では,臨床上で対応を変えるべきKi-67指数のカットオフ値が3%でよいかどうかについても今後さらなる議論・検証の余地がある.
(2)脈管侵襲の評価と対応脈管侵襲は,リンパ管侵襲と静脈侵襲を評価する.その評価を以前はヘマトキシリン・エオジン(HE)染色のみで行っていたが,細胞異型の弱いNETではHE染色のみで脈管侵襲を評価するのは容易でない.そこで近年では,脈管侵襲の病理評価に特殊染色や免疫染色を用いて評価することが多い.具体的には,リンパ管侵襲の評価に抗ポドプラニン抗体(D2-40)染色が,静脈侵襲の評価にElastica van Gieson(EVG)染色やVictoria Blue染色が用いられる.
特殊染色・免疫染色を用いるようになり,より再現性の高い形で脈管侵襲の病理診断が可能となったが,その結果,内視鏡治療対象となるような小さな直腸NET病変でも,内視鏡切除後に脈管侵襲が陽性と診断され(Figure 5),その後の対応に苦慮するケースが日常臨床で増えてきている.
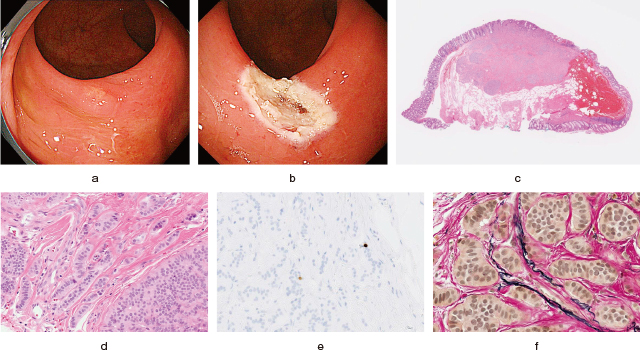
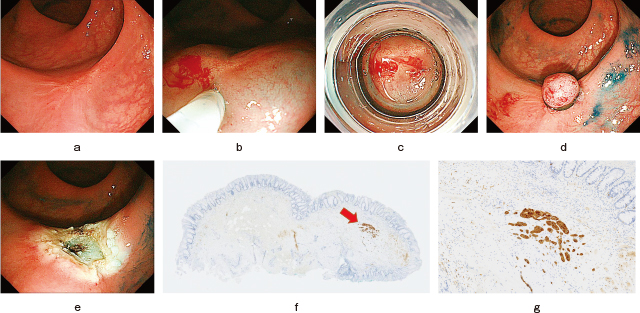
粘膜下層にとどまる小さな直腸NET G1病変に静脈侵襲陽性が確認された一例.
a:下部直腸に4mm大のNET病変が見られる.
b:ESMR-L法で偶発症なく病変を一括切除.
c:切除検体病理像(HE染色).粘膜固有層から粘膜下層にかけて存在する病変が断端陰性切除されている.
d:切除検体病理像(HE染色).類円形核と淡好酸性細胞質を有する異型細胞が,索状,管状,小胞巣状に増殖している.
e:切除検体病理像(MIB-1染色).Ki-67陽性率は1%程度で,NET G1に分類.
f:切除検体病理像(EVG染色).静脈侵襲陽性所見が見られた.
脈管侵襲は,過去の研究から大腸NETでも転移の強い危険因子であることが示されている 8)~15).これは非常に重要な知見であるが,過去の研究は,主に手術例を対象としていること,さらには,脈管侵襲が特殊染色や免疫染色で系統的に評価されていないことから,その過去の研究結果をそのまま,特殊染色や免疫染色で診断がつく近年の脈管侵襲陽性の解釈に当てはめるのは難しいと言わざるを得ない.つまり,直腸NETの内視鏡治療後に特殊染色や免疫染色を用いて脈管侵襲陽性と判定されても,絶対的に追加手術が必要とまでは確信をもっては推奨できない状況にある.この状況を改善するのに,内視鏡切除例を対象に,脈管侵襲を特殊染色・免疫染色で系統的に評価したデータが必要である.そこで,近年当院では,自施設で過去に内視鏡切除した直腸NET症例を対象に,その脈管侵襲を特殊染色・免疫染色を用いて系統的に再評価し,臨床経過と照合することで脈管侵襲の臨床的意義を検証したので,その内容を以下に紹介する 29).
1997年から2011年に当院で内視鏡治療を行った直腸NET 90病変(86患者)を対象に,その切除保存標本を使って,新たに,抗シナプトフィジン抗体とD2-40を用いた重染色でリンパ管侵襲を評価,抗シナプトフィジン抗体と抗CD-31抗体を用いた重染色とEVG染色で静脈侵襲を評価した.対象病変は腫瘍径の中央値が5mmで,すべてで深達度が粘膜下層にとどまり,Ki-67指数が3%未満(中央値0.9%)であった.脈管侵襲は,HE染色のみの評価に基づく臨床の場では一例に静脈侵襲陽性を認めるのみであったが,新たに系統的に脈管侵襲を再評価した結果,対象病変の約半数(46.7%)で脈管侵襲が陽性(リンパ管侵襲陽性:25.6%,静脈侵襲陽性:38.9%)であると判明した.これらの症例は,臨床の場における診断に基づき全例で無治療経過観察が選択されている(HE染色の診断で静脈侵襲陽性となった一例も併存疾患の関係で無治療経過観察が選択された)が,経過観察期間中央値88カ月(範囲:12-233カ月)の間に,再発や転移は一例も見られていない(2019年9月時点).脈管侵襲再評価にて陽性となった42例のみに注目しても,経過観察期間中央値91カ月(範囲:13-229カ月)の間に,再発や転移は見られていない.限られた症例数での検討であり,この検討のみから,脈管侵襲の扱いについて決定的な結論を導き出すことは困難であるが,腫瘍径が小さく粘膜下層にとどまる直腸NET G1病変でも非常に高い割合で脈管侵襲陽性が見られること,そして陽性例の臨床経過が良好であることから,他に転移危険因子を有さない直腸NET病変においては,免疫染色や特殊染色を用いて見つかる脈管侵襲陽性が追加手術を行う絶対的な条件とならない可能性も考えられる.当院からの発表の後,同様の論調のデータ・検討結果の報告が増えてきており,脈管侵襲陽性の扱いについて今後さらなる議論を要する 53)~57).
追加手術の侵襲・QOLへの影響が大きい分,過剰な手術は避けたいところであり,上記の検討結果などから,粘膜下層にとどまる小さなNET G1病変における脈管侵襲陽性については,追加手術なしに経過観察できる可能性が期待される一方で,現時点では,手術をせずに経過観察して再発が起こった際には有効な根治療法がない状況もありうる点を理解しておかなければならない.
NET G2病変の脈管侵襲陽性例については,内視鏡治療後無治療経過観察した症例のまとまったデータは存在せず,現時点では,無治療経過観察という選択は困難であり,追加手術が推奨される.
(3)切除断端の評価と対応内視鏡治療後の病理評価にて,切除断端は,垂直断端と側方断端の両方を評価する.切除断端については,前述のようにmodified EMRなどを用いて断端陰性で病変を切除することが最も大切であり,実際にほとんどの症例を断端陰性で切除できるようになってきている.しかし,それでも一部の症例で切除断端陽性,もしくは判定不能例が生じうる.また現実には,直腸NETにポリペクトミーや従来法のEMRが行われてしまった結果,断端陽性となってしまい対応を要することもある.断端陽性例に対する対応法としては,追加外科切除,追加内視鏡切除,無治療経過観察の3通りが考えられる.断端陽性例もしくは判定不能例に対する対応に注目した研究として,韓国からの多施設後向き研究が存在するが,そこからは断端陽性もしくは判定不能例を無治療経過観察で対応しても長期予後が良好であると解釈することができる 58).しかし,「切除断端陽性・判定不能」と言っても,断端陽性の程度がどうか,深部断端か側方断端かなど色々な状況が混在しており,すべて無治療経過観察で良いと断言するのは難しい.早期癌における対応も参考にすると,特に深部断端陽性例に対する対応には注意を要する.一方で,追加外科切除の侵襲の大きさを考えると,深部断端陽性もしくは判定不能例すべてに手術を行うのは過剰な可能性が高い.そこで,ひとつの対応案として,深部断端陽性もしくは判定不能例については,内視鏡切除後部位の瘢痕に対して追加の内視鏡切除を行い,十分量の検体を切除したうえで病理評価を行い,腫瘍の遺残がないかを確認する方法が考えられる.追加内視鏡切除した結果,腫瘍の遺残がない,もしくは粘膜下層にごく少量あるのみで,かつ他の転移危険因子が問題ない場合は追加手術なしに経過観察を行うが,比較的ボリュームのある遺残腫瘍があり追加の内視鏡切除でも断端陰性で切除できなかった場合などは追加手術を検討する,という対応につながりうる.この際の,追加内視鏡切除の方法としては前述のようにESMR-Lを原則とし,不可能な場合のみESDを用いるのが良いだろう.著者らの経験からは,このようなケースに追加内視鏡切除を行った場合,ほとんどの場合は病理学的に腫瘍の遺残を認めないが,肉眼的に遺残がはっきりせずとも追加内視鏡切除を行ったところ病理学的に少量の遺残が確認されたケースも存在する(Figure 4).このような追加内視鏡治療を行う方法が現実的な対応法として期待されるが,その有効性についてのエビデンスはまだ乏しく,今後,さらなる検証が必要である.
(4)サーベイランス方法内視鏡治療後のサーベイランスについて,本邦の膵・消化管神経内分泌腫瘍診療ガイドライン(第1版,2015年4月)では,12カ月ごとの内視鏡,CTによるサーベイランスを推奨する記載が見られた 59)(その後,2019年9月に発刊された第2版ガイドラインでは具体的なサーベイランスの方法,頻度は明記されていない 16)).一方で,海外のガイドラインの中には,転移のない1cm未満の粘膜下層にとどまる内視鏡切除NET症例に対するサーベイランスは不要,もしくは推奨する正当な理由なしと記載しているものもある 17)~19).このように,サーベイランスについては,根本的なところからコンセンサスが得られていない項目が多いのが実情である.
そのような状況下,著者らの施設におけるサーベイランスに対する考え方を紹介する.内視鏡切除にて一括断端陰性切除され,病理評価においても転移関連因子で問題になるようなものがひとつもない場合は,そこまで頻度の高いサーベイランス検査までは必要ないと考えている.しかしその一方で,大腸NETについてはまだ未解明なことも多いことを考慮すると,定期的にサーベイランスを行うメリットは十分にあると思われる.そこで,治療後最初のうちは2-3年に一度を目安として内視鏡を中心に必要に応じてCT・腹部超音波検査などを用いたサーベイランスを行うのが現実的なところと考えている.内視鏡切除後,脈管侵襲陽性だが無治療経過観察するような場合については,これよりもさらに慎重なサーベイランスが必要と判断される.決まったサーベイランスプログラムはないが,現時点では,より慎重に半年~1年に一度,内視鏡やCT検査などを用いたサーベイランスを行うことが望ましいと判断している.サーベイランス検査の患者負担も考慮し,腹部超音波検査や直腸鏡も適宜有効活用するようにしている.
今後,様々な直腸NET症例の長期予後データが明らかになるにつれて,追加治療の必要性の議論に加えて,より適切なサーベイランスプログラムも明らかとなってくることが期待される.
本稿では,直腸NETに対する内視鏡診断・治療,治療後対応について概説した.内視鏡診断,治療,さらには治療後の病理学的評価において様々な進歩が見られる一方で,内視鏡治療適応,内視鏡治療後の追加手術の適応,サーベイランス方法などコンセンサスの得られていない項目も少なくない.患者にベストの診療を提供するうえで,これらの項目についても早急にコンセンサスを得られることが望まれる.そのためにはさらなる知見の集積が必要であり,日本全国規模で多数例のNET症例を集積し,検証しなければならない.そのひとつとして,現在われわれのグループでは,全国60施設で協力し,大腸NETに関する多施設共同前向き症例登録追跡研究(石川秀樹班:日本医療研究開発機構研究費「革新的がん医療実用化研究事業」)を行っており,将来的に重要な知見を発信したいと考えている.
謝 辞
国立がん研究センター中央病院 内視鏡科斎藤豊氏,坂本琢氏,山田真善氏,高丸博之氏,岡村卓真氏にご協力いただき深謝します.
本論文内容に関連する著者の利益相反:なし