2021 年 63 巻 12 号 p. 2495-2507
2021 年 63 巻 12 号 p. 2495-2507
バレット食道は食道腺癌の発生母地であり,その発癌プロセスの初期段階にあるバレット上皮および異型粘膜に対しては,内視鏡的切除および内視鏡的焼灼法を併用した多角的なアプローチが必要である.現在欧米では内視鏡的焼灼法を施行するにあたり,主にラジオ波焼灼法,内視鏡的凍結療法,そしてアルゴンプラズマ凝固が用いられている.この中から治療法を適切に選択し,安全に施行しそして有効な治療効果を得るには,それぞれの治療法に使用されるデバイスの種類やその構造,使用法,治療適応,そして発生し得る偶発症に関し理解を深めることが重要である.本稿ではこれらの内視鏡的焼灼法に関し,主に手技的な側面に焦点を合わせて解説する.
本邦では欧米と比較し,食道扁平上皮癌が圧倒的に多く食道腺癌の罹患率は低い.しかしながらアジア諸国では近年,食生活の欧米化などによる肥満人口および胃食道逆流症の増加に伴い,扁平上皮癌が減る一方で腺癌の症例数の増加が見られている 1).本邦では,バレット食道を背景として発生した腫瘍性病変には内視鏡的治療が行われるものの,バレット食道自体には治療が行われていない.一方で欧米では,バレット食道に対しても積極的な内視鏡的治療が行われている.本稿ではバレット食道の焼灼法に関し,手技的な側面を中心に解説する.
バレット食道(Barrett’s esophagus;BE)は,逆流性食道炎などによる化学的炎症により傷害された食道の扁平上皮が円柱上皮で置き換えられたものと定義 2)され,食道腺癌の発生プロセスにおける異型粘膜の発生母地として位置付けられている.バレット食道は慢性的な胃食道逆流症状を訴える患者のおよそ7-10%,そして一般成人の1-2%に存在する 3),4).米国ではほとんどの食道腺癌がリンパ節転移や遠隔転移を伴った状態で発見され,食道癌全体の5年生存率は20%以下である 5).2017年には米国でおよそ17,000名が食道癌と診断され,約16,000名が死亡したと報告されている 6),7).
食道腺癌は多段階発癌プロセス,すなわち腸上皮化生(非異型バレット食道)から低異型度病変(low-grade dysplasia;LGD),高異型度病変(high-grade dysplasia;HGD),粘膜内癌(intramucosal adenocarcinoma),そして浸潤癌(invasive adenocarcinoma)を経て段階的に発癌することが知られている 8).バレット食道における年間の食道腺癌の発生率は0.1%から0.4%と見積もられている 9)~17)が,この発生率は発癌プロセスの進行とともに上昇し,低異型度病変で0.54% 18),高異型度病変で4-8% 19),20)である.すなわち食道腺癌の発生を予防し死亡率を低下させるためには,腫瘍性病変のみではなくバレット食道に対しても積極的な治療を行い,定期的な内視鏡的サーベイランスを行うことが重要である.
バレット食道,およびバレット食道に発生した腫瘍性病変に対しては内視鏡的切除(endoscopic mucosal resection;EMR/endoscopic submucosal dissection;ESD)および粘膜焼灼法を併用した治療が行われるが,これを総括的にBarrett’s Endoscopic Therapy(BET)と呼称している 21).粘膜焼灼法としてはラジオ波やアルゴンプラズマによる焼灼,および液体窒素による凍結療法などが挙げられる.最も用いられる方法はラジオ波の直接接触法による焼灼であるが,食道の狭窄や屈曲のために接触法での治療が困難な場合には非接触法,すなわち噴霧式凍結療法やアルゴンプラズマ凝固などによる治療が試みられる.以下,内視鏡的食道粘膜焼灼法の適応について解説する.
1.非異型バレット食道異型病変を伴わないバレット食道の年間の食道腺癌発生率は前述のごとく0.1-0.4%であり,予防的に内視鏡的粘膜焼灼法を行う意義は乏しい.米国のガイドラインでは非異型バレット食道に対し,Seattle Protocol 3)によるランダム生検(4箇所のランダム生検を2cm間隔で行う)による3-5年ごとのスクリーニングが勧められている.一方で,Long Segmentのバレット食道を有する若年症例や,食道腺癌の家族歴により発癌リスクが危惧される場合には,例外的に焼灼法の適応となる場合がある.
2.低異型度病変(LGD)低異型度病変に対する病理医間の診断一致率は低く 21),まずは消化器病理専門医による生検標本の見直しが勧められる.低異型度病変と再度診断された場合,低異型度病変を含めたバレット上皮全体の内視鏡的焼灼を行う.近年行われたメタ解析 8)では,内視鏡的焼灼法による低異型度病変の発癌リスクの明らかな低下が示されている.一方で低異型度病変の発癌率が低いことを考慮し,焼灼法を施行せず経過観察を行うことも考え得るが,この場合にはSeattle Protocolに基づき1年ごとに1cm間隔のランダム生検が必要となる.
3.高異型度病変(HGD)および粘膜内癌(T1a Esophageal Adenocarcinoma;EAC)隆起型の高異型度病変および粘膜内癌に対しては,EMRまたはESDによる内視鏡的切除が第一選択である 22).一方で内視鏡による検出が困難な平坦型の高度異型病変および粘膜内癌,いわゆる“Invisible Lesion”に対しては内視鏡的焼灼が勧められている.近年行われたメタ解析 23)では,隆起型病変にEMR を行い平坦型病変(高異型度病変・粘膜内癌)およびバレット上皮に対しラジオ波焼灼法(Radiofrequency Ablation;RFA)を行った群では,平坦型病変およびバレット上皮の根治率がそれぞれ93.4%および73.1%で,広範囲のEMRを行ったEMR単独群(94.9%および79.6%)との根治率の差が見られなかった.さらにEMR単独群では食道狭窄,穿孔,術後出血のリスクがRFA群と比較し有意に高いことが示された.
4.粘膜下層浸潤癌(T1b EAC)T1b食道腺癌に対し内視鏡治療を行った場合,切除断端陰性,高・中分化型腺癌,粘膜下層浸潤距離500μm未満,そして静脈・リンパ管侵襲がない場合に根治治療と見なす 21).米国では,ESDの普及の遅れからT1b食道腺癌に対する内視鏡治療の臨床成績に関するデータは乏しかったものの,最近T1b食道腺癌に対するESDの米国内の多施設研究が終了し,その成績がまもなく報告される予定である.
バレット食道に発生した腫瘍性病変を内視鏡的に切除し,バレット食道を無治療で経過観察した場合,高異型度病変および腺癌の異時性再発率は14.5-36.7%と見積もられている 24)~26).この高い再発率にはいわゆる平坦型の“Invisible Lesion”の存在が寄与していると考えられ,このような平坦型病変を含めたバレット上皮全体の内視鏡的焼灼が重要である.
内視鏡的食道粘膜焼灼法に使用されるデバイスは多岐にわたり,現在までアルゴンプラズマ凝固(Argon Plasma Coagulation;APC) 27),ハイブリッドAPC 28),スプレー型凍結療法(cryotherapy) 29),バルーン型凍結療法 30),そしてラジオ波焼灼法 31)が開発されている.しかしながら,これらの焼灼法の有用性を直接比較した研究はほとんどなく,またラジオ波焼灼法の有用性に関するエビデンスから,数々のガイドラインがラジオ波焼灼法の使用を推奨しているのが現状である.
1.ラジオ波焼灼法(Radiofrequency Ablation;RFA)内視鏡的ラジオ波焼灼法では,まずバレット上皮を全周性に焼灼し,その後部分的に遺残した小さなバレット上皮を局所的に焼灼する(Figure 1).全周性焼灼に使用されるデバイスはBarrx FLEX system(Medtronic, Sunnyvale, CA)と呼ばれ,ラジオ波のジェネレーターであるBarr FLEX RFA Energy Generator(Figure 2)および専用の焼灼用デバイスから構成される.焼灼用のデバイスとしては,全周性焼灼用のBarrx 360 Express RFA Balloon Catheter(Figure 3-A)および局所焼灼用のBarrx 90 RFA Focal Catheter(Figure 3-B)が広く使用されている.全周性焼灼用デバイスは,4cm幅の板状のバイポーラ電極がバルーンの周囲を全周性に覆うデザインを有しており,バルーンの大きさは食道内腔の大きさに応じて調整可能である.また最近になり,内視鏡の鉗子孔から挿入可能なBarrx Channel RFA Endoscopic Catheter(Figure 3-C),より細かい焼灼が可能なBarrx 60 RFA Focal Catheter(Figure 3-D),そして食道の長軸方向に広い焼灼が可能なBarrx Ultra Long RFA Focal Catheter(Figure 3-E)が発売された.このラジオ波のエネルギーは,食道壁内に約0.5mmの深度まで到達する.以下が実際の焼灼法におけるステップ(Figure 4)である.
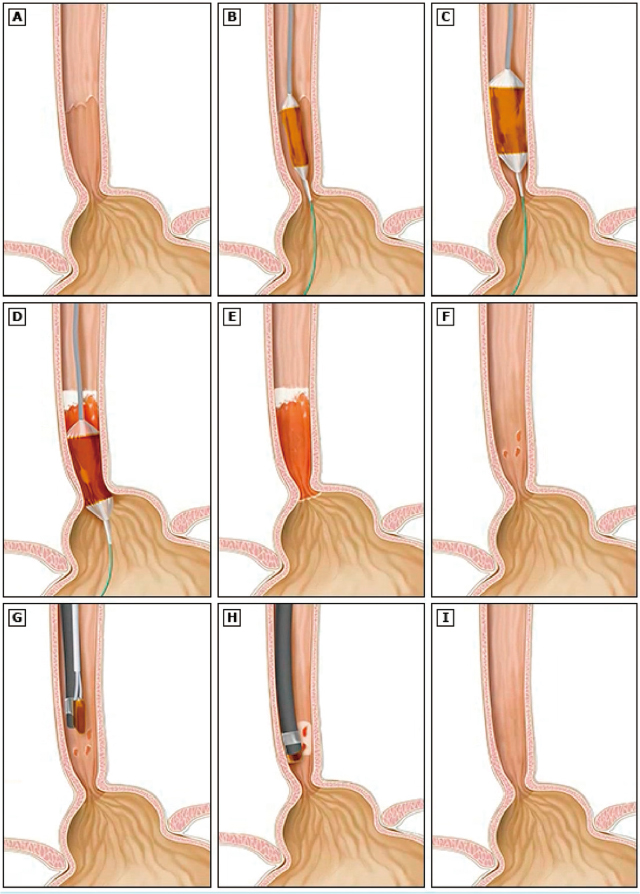
ラジオ波焼灼法における治療ステップ.
A:バレット上皮の下端および上端を確認し焼灼領域の位置設定を行う.
B:ガイドワイヤーを鉗子孔から挿入し内視鏡を抜去,全周焼灼用のデバイスを挿入する.
C:バルーンの上端をバレット上皮の上端の約1cm近位側に設置しバルーンを膨らませる.
D:追加焼灼のためにバルーンを肛門側に移動させる.その際に初回の焼灼部と5mm程度のオーバーラップを設ける.
E:内視鏡フードを用い焼灼された組織を掻爬,バレット上皮が全体的に焼灼されたことを確認する.
F:初回治療から約12週間後に経過観察を行い,バレット上皮が扁平上皮に置換されたことを確認する.島状に遺残したバレット上皮に対しては局所焼灼用のデバイスで追加焼灼を行う.
G:追加焼灼用のデバイスを挿入する.
H:島状に遺残したバレット上皮を焼灼する.
I:完全に扁平上皮した食道.

Barr FLEX RFA Energy Generator(Medtronic, Sunnyvale, CA).

A:Barrx 360 Express RFA Balloon Catheter.
B:Barrx 90 RFA Focal Catheter.
C:Barrx Channel RFA Endoscopic Catheter.
D:Barrx 60 RFA Focal Catheter.
E:Barrx Ultra Long RFA Focal Catheter.
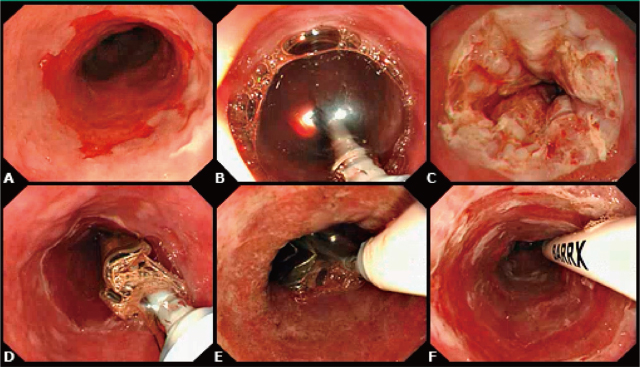
ラジオ波によるバレット上皮の全周性焼灼.
A:Long Segmentのバレット食道.生検により平坦型の高度異型病変が確認されている.
B:全周焼灼用のデバイスを挿入,バレット上皮の上端で焼灼を施行する.
C:焼灼後の様子.焼灼された上皮が白色化している.
D:焼灼された上皮を内視鏡フードで掻爬,2回目の焼灼に移る.
E:2回目の焼灼後には黄褐色調の上皮が観察される.
F:2回の全周焼灼後の内視鏡像.
a.焼灼領域の位置設定およびガイドワイヤーの挿入
バレット上皮の上端(小さな島状のバレット上皮を含む)および下端(胃のひだの上縁)の切歯からの距離を記録する.その後内視鏡の鉗子孔を通しガイドワイヤーを挿入し,内視鏡を抜去する.
b.バレット上皮の焼灼
全周焼灼用デバイス(Barrx 360 Express RFA Balloon Catheter)をガイドワイヤー越しに挿入,引き続き内視鏡を挿入し直視下に位置調整を行う.この際に重要なのは,バレット上皮のみに焼灼を行うのではなく,扁平上皮側および噴門側にも1-2cmのオーバーラップをおき焼灼を行う点である.その後バルーンを膨らませ,焼灼用のフットペダルを踏み食道粘膜の焼灼を行う.バルーンは焼灼終了後に自動的に収縮し,引き続き肛門側の焼灼に移ることが可能となる.この際も,口側の焼灼領域との間に5mm程度のオーバーラップを置くことが重要である.このように口側から肛門側に段階的に焼灼することで,最終的にバレット上皮の全体が焼灼される.
c.焼灼済みバレット上皮の掻爬
ラジオ波による焼灼後には白色調に変性したバレット上皮が残るが,追加焼灼を効果的に施行するために,この変性上皮を完全に掻破する必要がある.まずは内視鏡および焼灼用デバイスを抜去し,フード付きの内視鏡を挿入する.そしてフードの縁および送水ポンプを使用し変性上皮を剝離し完全掻爬を行う.
d.追加焼灼
変性上皮の掻爬後,2回目の焼灼を行う.1回目の焼灼と同様の方法で全周焼灼用デバイスおよび内視鏡を挿入し,直視下に再度焼灼を行う.再焼灼された上皮は黄褐色調を呈することから,非焼灼領域との鑑別は容易である.標準的なプロトコールでは,1回目,2回目の焼灼ともに10 J/cm2の設定で施行する.
e.内視鏡的サーベイランスおよび追加全周・局所焼灼
初回の焼灼療法から12週間後,内視鏡サーベイランスを行う.ラジオ波で焼灼した領域は通常,組織の治癒過程により正常の扁平上皮で覆われるが,この際に部分的に遺残したバレット上皮が観察される場合がある.この遺残バレット上皮が2cm以上で全周性または亜全周性,または島状の多発性である場合は全周焼灼を考慮する.一方で,全周性または亜全周性でも2cm以下のもの,または島状のバレット上皮が散見されるのみである場合には90 RFA Focal Catheterを用いた追加局所焼灼を行う(Figure 5).この局所焼灼用のデバイスの電極部は20mm×13mm大で,対象領域を直視下に焼灼することが可能である.この局所焼灼の治療プロトコールとしては主に以下の2つが挙げられる.すなわち12 J/cm2での焼灼を凝固上皮の掻爬を行わず連続で3回施行する方法,および15 J/cm2で2回施行し掻爬後に再度15 J/cm2で2回施行する方法であるが,この2つの方法を比較した多施設ランダム化比較試験 32)ではバレット上皮の完全根治率に明らかな差は見られなかった.

全周性焼灼後に遺残したバレット上皮の局所性焼灼.
A:全周性焼灼後に完全扁平上皮化した食道の内視鏡像.
B:11時および6時方向に島状のバレット食道が確認される.
C:Narrow Band Imagingによる観察.
D:局所焼灼用デバイスによる追加焼灼直後の様子.12時方向には焼灼用デバイスの位置が確認できる.
E:初回焼灼(15 J/cm2で2回焼灼)後,組織掻爬後の様子.
F:2回目の焼灼後の様子.焼灼部は黄褐色調を呈している.
f.ラジオ波焼灼法後の患者管理
ラジオ波焼灼法はすべて外来で行うことが可能であるが,術後疼痛を抑え焼灼部の上皮化を促進するためにも徹底した胃酸コントロールが必要である.われわれはEsomeprazole 40mgを一日2回,H2ブロッカーを就寝前に投与している.また,術当日は流動食,翌日から低残渣食を数日間とし,その後次第に通常食に戻している.また一部の患者で術後胸部痛が経験されるが,ほとんどの場合アセトアミノフェンを500mgまたは1,000mgを一日数回投与することでコントロール可能である.
g.術後偶発症
ラジオ波焼灼法の偶発症としては,狭窄(0-6% 33),34)),胸部痛(3% 35)),出血(1% 35))と報告されている.しかしながら狭窄に関しては,焼灼法施行前に行われたEMRや逆流性食道炎に起因していることも多い.
2.内視鏡的凍結療法(Endoscopic Cryotherapy)内視鏡的凍結療法では,液体窒素や亜酸化窒素のようなCryogenと呼ばれる薬剤を用い,バレット上皮を凍結させ組織変性を誘導する.この過程で発生する急速な凍結・解凍のプロセスにより細胞膜の破壊,アポトーシスの誘引,そして血管内の血栓誘発といった様々な要因により,バレット上皮の結晶化が促進される.
内視鏡的凍結療法には,噴霧式凍結療法およびバルーン式凍結療法の2つの方法が存在する.噴霧式凍結療法に最も使用されているデバイスはtruFreeze Spray Cryotherapy System(STERIS, Mentor, OH)と呼ばれ,コンソール部(Figure 6-A)と噴霧用カテーテル(Figure 6-B)から構成される.この噴霧用カテーテルは内視鏡の鉗子孔から挿入することが可能であり,凍結療法には-196℃の超低温の液体窒素が使用される.一般的には20秒間の凍結療法を2回,または10秒間の凍結療法を4回行う(Figure 6-C).カテーテルから噴霧された液体窒素は食道内で急速にガス化する.噴霧式凍結療法中にはこのガス圧による食道損傷のリスクがあり,経鼻胃管の留置が必須である.
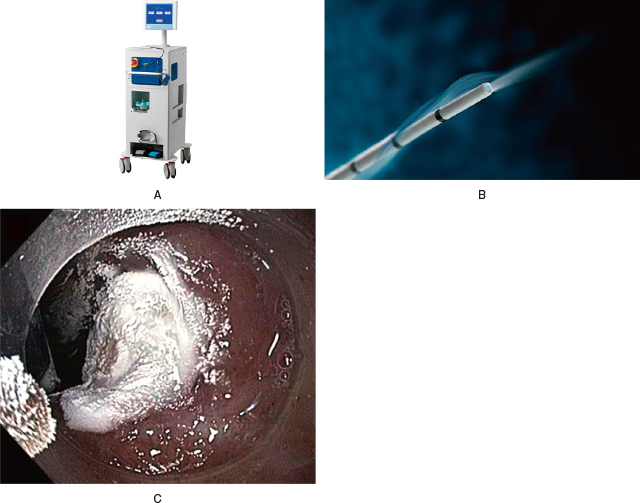
A:truFreeze Spray Cryotherapy System(STERIS, Mentor, OH)のコンソール部.
B:同システムの噴霧用カテーテル.
C:噴霧式凍結療法により凍結したバレット上皮(文献47).
一方でバルーン式凍結療法に使用されるシステムはC2 CryoBalloon Ablation System(PENTAX Medical, Redwood City, CA)と呼ばれ,デバイス本体は液体窒素のカートリッジが入ったコントロール部とフットペダルから構成される(Figure 7-a).専用のバルーンカテーテル(Figure 7-b)は内視鏡の鉗子孔から挿入が可能で,バルーンの内部に液体窒素を噴霧するディフューザーが配置されている.バルーン径は3.6cm,バルーン長は3.0cmで,ディフューザー部は治療対象部位に合わせて回転させ位置調整が可能である.現在専用カテーテルとしてC2 CryoBalloon Focal Catheter(CBF),C2 CryoBalloon 90°Catheter(CB90),そしてC2 Cryoballoon 180°Catheter(CB180)の3種類が用意されている.CBFはおよそ2cm2のみの小さな領域の治療に適しているが,CB90およびCB180ではさらに広い範囲の治療が可能である(Figure 7-c).液体窒素はバルーン内で放出されるため食道粘膜に直接噴霧されることはないが,標的部位は液体窒素の超低温により-85℃まで冷却され凍結する.この凍結領域は食道壁内の約1-2mm程度の深度に達するとされる.バルーン内に充満した窒素ガスはカテーテルを介して放出され,コントロール部にあるスポンジで吸着されるため経鼻胃管の留置は必要ないことがメリットである.以下にバルーン式凍結療法の手順を示す.
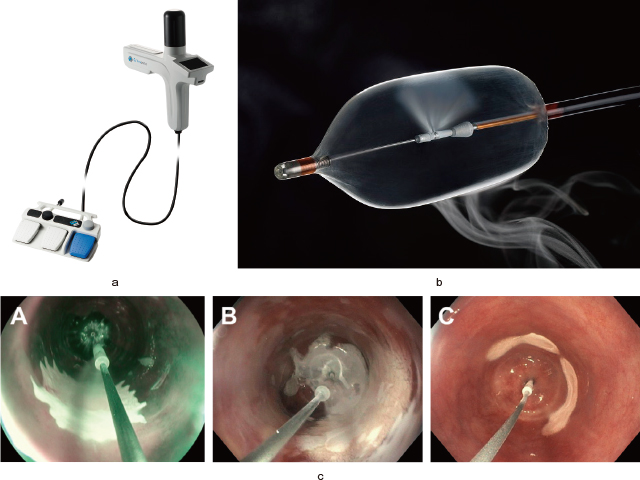
a:C2 CryoBalloon Ablation system(PENTAX Medical, Redwood City, CA)のコントロール部とフットペダル.
b:同システムのバルーンおよびディフューザー.
c:(A)CryoBalloon Focal Catheter, (B)CryoBalloon 90 Catheter, and (C)Cryoballoon 180 Catheterによる内視鏡的凍結療法.大小異なる範囲が凍結されているのが確認できる(文献47).
a.バルーンカテーテルの挿入
内視鏡の鉗子孔からバルーンカテーテルを挿入し,カテーテルをコントロール部に接続する.次に,青いフットペダルを踏みバルーンを拡張する.
b.ディフューザーの角度調整
青いフットペダルを短時間踏み,少量の液体窒素を噴霧しディフューザーの位置を確認する.対象領域からずれている場合には,白いフットペダルによりディフューザーを回転させ調整を行う.
c.バレット上皮の凍結療法
青いフットペダルを踏み続けることでディフューザーから継続的に液体窒素が噴霧され,凍結療法が行われる.一般的には10秒間の凍結療法を行い,凍結療法終了後には液体窒素の噴霧が自動的に完了する.
d.追加凍結療法
広範囲にわたる凍結療法が必要な場合には,前述の方法でディフューザーを再度回転させ位置合わせを行い,追加治療を行う.
e.バルーンの抜去
フットペダル上の灰色のボタンを踏みバルーンを収縮させ内視鏡から抜去する.
ラジオ波による焼灼法では,組織温度を上昇させ細胞の蛋白質を変性させることで治療効果が得られるが,内視鏡的凍結療法では細胞質が凍結し結晶化するため,蛋白質の構造には永久的なダメージが与えられないとされる.この点で内視鏡的凍結療法はラジオ波焼灼法と比較し,術後食道狭窄のリスクが低いとされるが,この点に関しては未だ十分な検討がなされていない.現在までに行われたいくつかの観察研究 36)~38)では,内視鏡的凍結療法により95-100%の高異型度病変の根治が可能で,55%のバレット上皮の完全寛解が可能であったことが示されている.しかしながら現在,凍結療法の長期的な予後に関するデータが不足しており,さらなる臨床試験が必要である.
3.アルゴンプラズマ凝固(Argon Plasma Coagulation;APC)アルゴンプラズマ凝固では,約6,000ボルトのエネルギーによりイオン化されたアルゴンガスがプラズマ化し,プローブから放出される.放出されたプラズマはプローブ先端から一番近傍の領域に到達し,対象領域が焼灼される.熱エネルギーの到達深度はエネルギー量の設定や焼灼時間に依存するが,他の焼灼法よりも深く,消化管壁内の2-3mmに達するとされる.アルゴンプラズマ凝固はその特性から,ラジオ波焼灼法や内視鏡的凍結療法とは異なり,一度に広い領域をカバーすることが困難である.すなわちShort Segmentのバレット食道患者では1回の治療で全バレット上皮の焼灼が可能であるが,Long Segmentの患者では複数回にわたる治療が必要となる.一般的には,扁平上皮化の程度を確認しつつ,最終的に全バレット上皮が扁平上皮に置換されるまで4-6週間ごとに焼灼を繰り返す.バレット食道患者129名を無作為に焼灼群と非焼灼群に分けて行った前向き比較試験 39)では,1年後の経過観察時には,焼灼群で47/56名(83.9%)の患者で扁平上皮化が保たれており,7年後の長期経過観察時においても21/32名(65.6%)の患者でバレット上皮の再発が見られなかった.また,非焼灼群では経過観察中に軽・高異型度病変がそれぞれ3名および6名に発生したが,焼灼群では1名ずつのみであった.
アルゴンプラズマ凝固では,ラジオ波焼灼法や内視鏡的凍結療法と比較し食道狭窄のリスクが5-10% 40)~43)と高いが,これはアルゴンプラズマ凝固における熱エネルギーの深達度が他の方法と比較して非常に深いことに起因している.これを受け近年になり,ウォータージェットシステム(ERBEJet2, Erbe Elektromedizin, Tuebingen, Germany)とAPCを統合した新しいHybrid APCシステム(APC2-unit)が開発された(Figure 8-a).この新しいAPCシステムでは,従来のAPCプローブにウォータージェットによる局注機能を搭載(Figure 8-b)している.これによりアルゴンプラズマ凝固を行う前に粘膜下局注を行うことで,食道筋層への熱エネルギーの到達を防ぐことが可能となる.従来のAPCとHybrid APCを比較したランダム化ex-vivo研究 44)では,従来のAPCでは熱エネルギーの到達および組織変性が固有筋層にまで見られたのに対し,Hybrid APCでは粘膜筋板から粘膜下層までに留まることが示された(70W使用時の熱深達度距離:従来のAPC群1,096±320mm,Hybrid APC群 468±136mm;p=0.003).また,このHybrid APCを用いたパイロット研究 45)では,50名のバレット食道患者にHybrid APCが使用され,最終的に48名(96%)で遺残バレット上皮の完全扁平上皮化(Short Segment:16/16,Long Segment:32/34)が可能であったと報告している.また,このコホートにおいては内視鏡的焼灼法後の食道狭窄は1名(2%)のみであった.アルゴンプラズマ凝固の使用法は広く知られておりその手技の詳細は割愛するが,ウォータージェットにより粘膜下局注後,APCのフットペダルを踏むことにより対象領域を焼灼する(Figure 8-c).アルゴンプラズマ凝固施行後には対象領域に焼痂が残るが,ラジオ波焼灼法同様フードを用いこれを掻爬し繰り返し焼灼することでバレット上皮の完全焼灼を図る.

a:Hybrid APCシステム(APC2-unit: ERBEJet2, Erbe Elektromedizin, Tuebingen, Germany).上から2段目がAPC2本体である.
b:APCプローブの中央にウォータージェット機能を搭載しており,焼灼前に粘膜下の局注が可能である.
c:Hybrid APCの様子.
(A)ERBEJet2による生理食塩水の粘膜下局注.
(B)アルゴンプラズマ凝固による焼灼中の様子.
(C)内視鏡フードによる凝固組織掻爬後に追加焼灼を行う.
ラジオ波焼灼法,凍結療法,そしてアルゴンプラズマ凝固による内視鏡的バレット食道焼灼法の手技の詳細につき解説した.米国ではラジオ波による焼灼法が最も多く行われている 46)が,新しく開発されたHybrid APCによるバレット食道焼灼法は食道狭窄部などでも安全で有効に行える利点があり,今後の研究が期待される.
本論文内容に関連する著者の利益相反:なし