2021 年 63 巻 3 号 p. 264-278
2021 年 63 巻 3 号 p. 264-278
消化管粘膜下腫瘍(submucosal tumor:SMT)は日常臨床ではしばしば遭遇する疾患であるが,その定義は粘膜より深部に存在する壁内病変により粘膜が挙上された隆起の総称とされている.通常内視鏡検査では病変そのものの観察を行うことができず,かつ多彩な組織を呈するため診断は困難な場合が多く,超音波内視鏡検査(endoscopic ultrasonography:EUS)が診断に有用である.EUSには大きく分けて,超音波内視鏡専用機を用いて行う方法と,通常内視鏡の鉗子口から出す細径超音波プローブを用いた方法があるが,いずれにしても詳細な画像診断には良好な画像の描出が必須であり,機器や描出方法の選択に留意する必要がある.EUSで特徴的な所見を示す脂肪腫,異所性膵,嚢胞,リンパ管腫などのSMTでは,通常内視鏡およびEUSで診断がほぼ可能であり,組織採取は必要ない.一方,粘膜下層および固有筋層の内部が低エコーや不整なエコーの病変は診断困難な病変も多く,これらの病変を確定診断するには,組織採取による病理診断が推奨される.そのような病変に対してはEUS下穿刺吸引細胞診および開窓生検法など様々な手法で組織採取が行われているが,同時に新しい診断手技の開発による画像診断の進歩にも期待したい.
粘膜下腫瘍(submucosal tumor:SMT)は日常臨床ではしばしば遭遇する疾患であるが,その定義は粘膜より深部に存在する壁内病変により粘膜が挙上された隆起の総称とされている 1).通常内視鏡検査では病変そのものの観察を行うことができず,かつ多彩な組織を呈するため,診断は困難な場合が多く超音波内視鏡検査(endoscopic ultrasonography:EUS)が診断に有用である 2),3).超音波内視鏡は1980年に消化管用ファイバースコーブに電子リニア走査方式やメカニカルラジアル走査方式で超音波振動子を組み込んだものが報告され,その後の機器開発の進歩により実用化された 4)~6).また鉗子口から挿入可能で直視下で目的病変の高分解断層像が得られる高周波細径超音波プローブが実用化されたことにより 7),層構造の詳細な描出 8)や,小病変でも正確なスキャンが可能となった.さらに小腸や近位結腸など,超音波内視鏡専用機でアクセスできない領域でも検査を行うことが可能となったことより,全消化管でのSMT診断が簡便にかつ高い精度で検査が行える様になっている 9)~11).その後も3次元走査法 12),13),ドップラー法 14),15),造影ハーモニックイメージング法 16)~24),elastography法 24)~30)など様々な点で改良が加えられSMTにおいても新たな知見が得られてきている.本稿では広義のSMTについてその描出方法を含め超音波内視鏡診断について述べる.
EUSには大きく分けて,超音波内視鏡専用機を用いて行う方法と,通常内視鏡の鉗子口から出す細径超音波プローブを用いた方法に大別される.丈のある病変では深部減衰の少ない専用機での観察が優れている一方で,小病変では内視鏡観察下に検査可能な細径超音波プローブが優れている特徴があり,使い分けることが重要である.また超音波内視鏡専用機はスコープの先端に超音波探触子が備え付けられており,その種類によってラジアル型,コンベックス型,リニア型に分けられ,病変の大きさや部位,特徴によってそれぞれを使い分けられる.一般的にSMTの画像診断には層構造の診断が行いやすいラジアル型が用いられ,EUS下穿刺吸引細胞診(EUS-guided fine-needle aspiration:EUS-FNA)にはコンベックス型やリニア型が用いられることが多い.
(2)描出方法描出方法としては主に脱気水充満法(水浸法)とバルーン法があるが一般的には脱気水充満法を用いることが多い.これは管腔内に脱気水を満たし,その中で超音波を走査する方法である.胃では水の貯留が容易であるが,食道,十二指腸,大腸では蠕動により水が流出してしまいやすいことより,細径超音波プローブでは単独または洗浄チューブを挿入 31)した2chスコープ,もしくは送水機能のついたスコープを使用して,適宜水の追加と空気の吸引を行うことで検査が容易となる.また,脱気水充満法では,余分な粘液や胃液が残存していると,脱気水が混濁し減衰やアーティファクトのため,詳細な観察が困難になるため事前に吸引しておくことが重要である 32).バルーン法は探触子の周囲のバルーンに脱気水を満たし,バルーンを病変に押し当てて走査する方法で,脱気水を貯留するのが困難な部位で特に有用だが,バルーンによる圧迫で消化管壁の層構造が変形することがあるので注意が必要である 33).いずれにしても詳細な画像診断には良好な画像の描出が必須であり,機器や描出方法の選択に留意する必要がある.
(3)EUSによる画像診断SMTを描出する際には病変の消化管壁内外の鑑別,壁内の場合は局在層診断,エコーレベルによる組織性状の推測,病変径,辺縁性状などに注意を払って行う必要がある 9)~11),34).消化管壁層構造は1984年に相部ら 35)が胃壁の5層構造を提唱し,その後層構造の解釈は議論され2000年の日本消化器内視鏡学会コンセンサスミーティングで集約された(Figure 1) 8).消化管粘膜下腫瘍診断においてはその主座を認識することは重要であり層構造の解釈は理解しておく必要がある.基本となる5層構造は内腔側の第1層は内腔と粘膜上皮の境界で生じる高エコーであり,第2層の低エコーと合わせて粘膜層に相当する.高エコーの第3層は粘膜下層にほぼ相当する.低エコーの第4層は固有筋層に相当する.高エコーの第5層は漿膜下層・漿膜に相当するとされる.また,条件により7層から13層に分離されるが層構造の解釈は食道と胃,大腸ではやや異なることに留意する必要があるが,詳細に関して引用元の論文をご参照いただきたい.なお,本稿では5層構造での解説を行っている.

山中桓夫.コンセンサス・ミーティング1:EUS壁構造の解釈.Gastroenterol Endosc 2001より一部改変して転載.
SMTは狭義のものとしては非上皮性の腫瘍性病変に限るが,消化器内視鏡用語集第4版1)では粘膜より深部に存在する壁内病変により粘膜が挙上されて生じた隆起の総称とされ,良性非上皮性腫瘤としては平滑筋腫,線維腫,脂肪腫,神経性腫瘍,血管腫,リンパ管腫など,良性上皮性腫瘤として嚢胞,異所性膵,炎症性腫瘤として寄生虫性肉芽腫や炎症性線維性ポリープ(inflammatory fibroid polyp:IFP),悪性非上皮性腫瘍として消化管間質腫瘍(gastrointestinal stromal tumor:GIST),悪性上皮性腫瘍として神経内分泌腫瘍,転移性癌など多種の腫瘤が含まれており必ずしも粘膜下層以深に主座をもつ腫瘍とは定義されていない 36).これらのことから広義のSMTとしては上皮性腫瘍であっても表面粘膜が非腫瘍上皮で覆われたSMT様隆起を呈するものは含めたほうがよいと考えられ,本稿でもこれらの病変を含めた広義のSMTについて解説を行う.
平滑筋腫は全消化管に発生する良性の間葉系腫瘍であるが,粘膜筋板由来のものと固有筋層由来のものがある.EUS像は,粘膜筋板由来のものは第2層深層〜第3層浅層に,固有筋層由来のものは第4層に主座をおく境界明瞭,辺縁整,内部エコーが比較的均一な低エコー病変として描出されるが時に一部石灰化による高エコーがみられる.しかし画像所見のみで平滑筋腫と後述するGISTや神経鞘腫など他の消化管間葉系腫瘍と鑑別することは困難である(Figure 2-a,b) 37),38).

消化管間葉系腫瘍.
a:平滑筋腫 通常内視鏡像.
b:EUS像.第2層深層〜第3層浅層に主座をおく境界明瞭,辺縁整,一部高エコーを伴った低エコー病変として描出されている.
c:GIST 通常内視鏡像.
d:EUS像.第4層に主座をおく境界明瞭,辺縁整,内部やや不均一な低エコー病変として描出されている.
e:神経鞘腫 通常内視鏡像.
f:EUS像.第4層に主座をおく境界明瞭,辺縁整,内部やや不均一な低エコー腫瘍として描出されている.
GISTは全消化管に発生する消化管のペースメーカー細胞とされるCajalの介在細胞の異常増殖であり,粘膜筋板由来のものと固有筋層由来のものがある.EUS像は粘膜筋板由来のものは第2層深層〜第3層浅層に,固有筋層由来のものは第4層に主座をおく境界明瞭,内部エコーが低〜等エコー病変として描出される.内部性状は腫瘍径に依存し,大きくなるにつれ嚢胞性変化や石灰化などの内部変性を伴う.また,GIST診療ガイドライン 3)ではEUSでの悪性所見は実質エコー不均一,辺縁不整,リンパ節腫大であり,腫瘍サイズと辺縁不整が悪性度と関連しているとの報告もある(Figure 2-c,d) 39)~41).
(3)神経鞘腫神経鞘腫は全消化管に発生するが筋層間のAuerbach神経叢が主な発生母地で,稀にMeissner神経叢からも発生する.EUS像はGISTや平滑筋腫と同様に第4層に連続する境界明瞭で内部エコーが低〜等エコー病変として描出される.また,嚢胞,液状変性をきたすと無エコー域を認める(Figure 2-e,f).
(4)顆粒細胞腫顆粒細胞腫は全消化管に発生し,主に粘膜固有層から粘膜下層に存在し,EUS像では,第2層深層〜第3層内の境界明瞭で内部エコーが比較的均一な低〜等エコー病変として描出される(Figure 3).

顆粒細胞腫.
a:通常内視鏡像.
b:EUS像.第2層〜第3層内の境界明瞭で内部比較的均一でやや輝度の高い低エコー病変として描出される.
IFPは全消化管に発生し,粘膜固有層深層から粘膜下層に存在しEUS像では,第2層〜第3層に存在する境界不明瞭で内部エコーが均一な低エコー病変として描出されるが,間質や細胞成分の過多などにより均一性,エコーレベルは異なる.
(6)脂肪腫脂肪腫は全消化管に発生し主に粘膜下層を中心に存在し,EUS像は第3層内に主座をおく境界明瞭,辺縁整,内部均一な高エコー病変として描出されるが,腫瘍が大きくなると深部減衰を伴う(Figure 4).

脂肪腫.
a:通常内視鏡像.
b:EUS像.第3層内に主座をおく辺縁整,境界明瞭,内部均一な高エコー病変として描出される.
異所性膵は主に胃,十二指腸,空腸に存在することが多く,粘膜下層に存在する.EUS像は第3層内に主座をおく境界明瞭で辺縁は分葉状を呈することが多い,低〜等エコー病変として描出される.内部に膵実質でみられるような点状の高エコーや導管様エコー,導管が拡張した嚢胞状エコーを認め,第4層の肥厚を伴う症例もある(Figure 5).
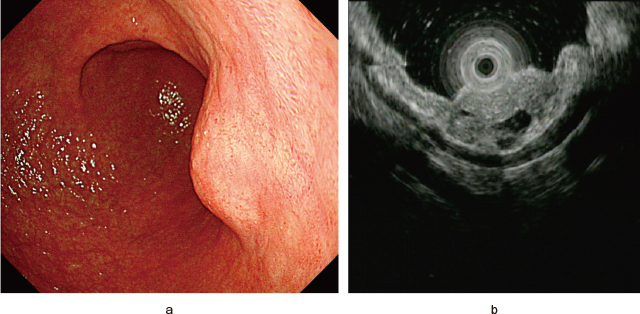
異所性膵.
a:通常内視鏡像.
b:EUS像.第3層内に主座をおく境界は明瞭で辺縁は分葉状の低〜等エコー腫瘍として描出され,内部に導管様エコー,嚢胞状エコーを認める.
粘膜下異所性胃腺とは,本来胃粘膜固有層内に存在する胃腺組織が異所性に胃粘膜下層に認められるものである.びまん性病変とhamartomatous inverted polypとも称される孤発性病変がある.びまん性病変のEUS像は第3層に主座をおく複数の無エコー域を,hamartomatous inverted polypのEUS像では第2〜3層に主座をおく内部に大小不同の無エコー域と低エコー域を認める.
(9)Brunner腺過形成主に十二指腸球部〜下行部にかけて認め,病理組織学的には粘膜深部から粘膜下層にBrunner腺の増生を示す.EUS像では第2〜3層,境界明瞭な高エコー腫瘤として描出され,内部に腺管の拡張と考えられる低〜無エコー領域を伴うことが多い.
(10)嚢胞食道嚢胞は大きく先天性と後天性に分けられ,先天性食道嚢胞には,気管支原性嚢胞,重複嚢胞などが,後天性のものでは食道貯留囊胞がある 42).食道貯留囊胞のEUS像では第2〜3層を主座とする境界明瞭,辺縁整,内部均一な無エコーとして描出される(Figure 6-a,b).気管支原性嚢胞のEUS像は無エコーまたは嚢胞内の粘液性物質による低エコーの病変として描出される(Figure 6-c~e).食道重複嚢胞のEUS像は無エコーまたは嚢胞内の粘液性物質による低エコーの病変で,外側と内側に筋層を示唆する低エコー層がみられるのが特徴的であり,消化管との筋層の連続性を確認できる場合がある.胃の粘膜下嚢胞は種々の分類 43)~45)があるが,粘膜下層に液状成分の貯留を認める病変でEUS像では,第3層内に境界明瞭な内部エコーが均一な無エコー病変として描出される.十二指腸の粘膜下嚢胞にはBrunner腺由来の嚢胞,異所性胃粘膜などによるものがあり,第2〜3層に主座をもつ境界明瞭,辺縁整,無エコー病変として描出される.

嚢胞.
a:貯留嚢胞 通常内視鏡像.
b:EUS像.第3層を主座境界明瞭で辺縁整内部均一な無エコーとして描出される.
c:気管支原性嚢胞 通常内視鏡像.
d,e:EUS像.第4層と連続した辺縁整内部均一な低エコー病変として描出される.
血管腫は全消化管に発生し,海綿状血管腫,毛細血管腫,混合型に分類され,主に粘膜固有層,粘膜下層に存在する.EUS像は第2〜3層で,不均一な等〜高エコーを呈し一部に拡張した低エコー領域を認めパワードブラで血流が検出できることもある.サイズが大きくなると腫瘍内の血栓,石灰化の病理像を反映した音響陰影を伴う高エコー領域や点状高エコースポットを認める(Figure 7).

血管腫.
a:通常内視鏡像.
b:EUS像.第2〜3層で,内部不均一な低〜高エコーを呈する.
リンパ管腫は全消化管に発生し,粘膜固有層から粘膜下層に存在し,単純性,嚢胞状,海綿状の三つのサブタイプに分類される.EUS像では,第3層を主座とする境界明瞭な無エコー病変として描出される場合や隔壁を伴う多房性病変の無エコー病変として描出される場合がある(Figure 8).

リンパ管腫.
a:通常内視鏡像.
b:EUS像.第3層を主座とする隔壁を伴う無エコー病変として描出される.
動静脈奇形は全消化管に発生し,拡張かつ肥厚した動脈と静脈から構成され,動静脈間に吻合ないし移行像が認められる.EUS像では第3層から第4層に主座をおくやや高エコー病変で拡張蛇行した血管を反映する無エコー域を認める(Figure 9).

動静脈奇形.
a:通常内視鏡像.
b:EUS像.第3層に主座をおくやや高エコーな腫瘤や,拡張蛇行した血管を認める.
glomus腫瘍は全消化管に発生するが,毛細血管の先端にある動静脈吻合叢の神経筋装置に由来する腫瘍で,粘膜下層や固有筋層に発生する.EUS像では通常第4層に類円形の境界明瞭な腫瘤として認識されるが第3層や第2層にみられることもある.内部エコーは腫瘍が組織的に血管に富み,出血や血栓,硝子化することを反映して不均一な高エコーを呈することが多く,腫瘍の血管によるドップラー信号を伴う場合もある.
(15)腸管子宮内膜症腸管子宮内膜症は直腸,S状結腸,小腸に認められることが多いが,異所性に増生した子宮内膜が漿膜を超えて固有筋層〜粘膜固有層にかけて増殖する.EUS像では低エコー腫瘤として描出されるが,病変の深部境界は不明瞭な場合が多い(Figure 10).

腸管子宮内膜症.
a:通常内視鏡像.
b:EUS像.第3〜4層に境界不明瞭な低エコー腫瘤として描出される.
腸管嚢腫状気腫症は小腸,大腸に発生するが,腸管壁の粘膜下層や漿膜下層に主に窒素の気体が貯留した嚢胞が多発性にみられる状態で,EUS像は第3層に気体を反映した高エコーとacoustic shadow,および多重反射を認める(Figure 11).

腸管嚢腫状気腫症.
a:通常内視鏡像.
b:EUS像.EUS像は第3層に気体を反映した高エコーとacoustic shadow,および多重反射を認める.
直腸粘膜脱症候群は粘膜表層の毛細血管の増生,拡張と線維筋症(fibromuscular obliteration)が特徴的所見として認められる.EUS像では第2,3層の肥厚および境界の不明瞭化,第3層の不均一な低エコー域を認め,嚢胞様の小さな無エコー域が散見される場合もある(Figure 12).

粘膜脱症候群.
a:通常内視鏡像.
b,c:EUS像.第2,3層の肥厚,第3層の不均一な低エコー域を認め,第2層と第3層の境界が不明瞭で嚢胞様の小さな無エコー域が散見される場合もある.
NETは全消化管に発生するが,粘膜深層の腺底部の内分泌細胞より発生し,粘膜固有層から粘膜下層へ膨張性に発育する.EUS像は粘膜深層からの発生を反映し第2層深層〜第3層浅層に主座をおく境界明瞭,内部エコー均一な低〜等エコー病変として描出されるが,浸潤するに従い層構造を破壊する(Figure 13).

NET.
a:通常内視鏡像.
b:EUS像.第2層深層〜第3層浅層に主座をおく境界明瞭,内部エコー均一な低エコー腫瘍として描出される.
直腸良性リンパ濾胞性ポリープは粘膜下層の正常なリンパ濾胞が限局性に増殖したものでEUS像では第2〜3層に境界明瞭,内部エコー均一な低エコー病変として描出される.
(20)悪性リンパ腫悪性リンパ腫の肉眼形態は多彩であり,SMT様の形態を示すものもある.EUS像は表層型の病変は第2層あるいは第3層に主座をおき,進行に伴い全層性の比較的内部均一な低〜等エコー病変として描出される.
(21)悪性黒色腫主に食道や肛門直腸部に発生するがその他の消化管にも認められることがある.非上皮性腫瘍であり腫瘍辺縁の立ち上がりは非腫瘍性粘膜に覆われておりSMT様の形態を示すことがある.EUS像では内部が不均一な低〜等エコー病変として描出される.
(22)SMT様の形態を示す癌上皮性腫瘍である癌は粘膜固有層より発生するが,稀に癌のほとんどが非癌部に覆われたSMT様の形態を示すことがある.EUS像ではエコーパターンは組織像にも関連するため一定の特徴はないが低エコー病変として描出され癌浸潤に伴い壁層構造の破壊を認める(Figure 14).

SMT様胃癌(tub2>por2,SS).
a:通常内視鏡像.
b:EUS像.第2〜4層にかけて低エコー病変を認める.
腹部臓器から直接浸潤あるいは播種する場合と他臓器から血行性あるいはリンパ行性に遠隔転移する場合とに大別される.遠隔転移では粘膜下層や固有筋層に初発転移巣を形成し定着した腫瘍細胞が増殖することにより粘膜下腫瘍様の肉眼型を呈し,次第に粘膜面や漿膜に拡大すると考えられる.EUS像のエコーパターンは原発巣にも関連するため一定の特徴はないが低エコー病変として描出され癌浸潤により壁層構造の破壊が認められることが多い(Figure 15).

転移性腫瘍(胃癌大腸転移).
a:通常内視鏡像.
b:EUS像.第3〜4層にかけて低エコー病変を認める.
腸管内のガスや糞便貯留,他臓器などが消化管壁が圧排することにより,SMT様隆起を呈することがある.壁外性圧排の確定診断にはEUSにより壁外に臓器や臓器に由来する病変の描出により診断が可能である.
EUSで特徴的な所見を示す脂肪腫,異所性膵,嚢胞,リンパ管腫などのSMTでは,通常内視鏡およびEUSで診断がほぼ可能であり,組織採取は必要ない.一方,粘膜下層および固有筋層の内部が低エコーや不整なエコーの病変は多くの鑑別診断があり,これらの病変を確定診断するには,組織採取による病理診断が推奨される.また,GIST診療ガイドライン(第3版) 2)には胃SMTの治療方針が記載されているがGISTでは病理組織学的に診断が得られれば,転移のない症例は大きさにかかわらず手術適応であることが記載されている.SMTは通常,上皮層より深部に位置し,ほとんどの場合粘膜下層または固有筋層に由来するため,通常の内視鏡下鉗子生検では病理組織学的診断が困難であることが多いため,ジャンボ生検 46),ボーリング生検 47),EUS-FNA 48)~50),開窓生検法 51)~53)など様々な手法が行われている.特にEUS-FNAは,1992年にVilmannら 48)の報告以来,膵腫瘍を中心に普及し,その後消化管SMTにおいても標準的な病理組織学的診断法の一つとして位置づけられている.また,開窓生検法は直視下にEMRやESDの手技を応用し,粘膜を切開してSMTを露出させて鉗子生検を行う方法でEUS-FNAが困難な施設でも可能である.
低音圧にて共振し二次高調波成分を発生するという特徴をもつ第2世代超音波造影剤であるソナゾイドⓇ(ペルフルブタン)の開発により,低メカニカルインデックスイメージングによるリアルタイムCE-EUSが利用可能になり血流動態の観察が可能となった.CE-EUSによるGISTと非GISTの検討ではhyper-enhancementがGISTの所見であると報告され 22)~24),また,Low-grade malignancy GISTとhigh-grade malignancy GISTの検討ではirregular vesselsがhigh-grade malignancyの所見であると報告されている 19)~21).なお,現在のところ,これらの疾患に対する精査として,造影ハーモニックEUSは保険収載されておらず,研究目的で行われているため,消化管疾患に使用する場合には各施設において治験(倫理)審査委員会などの承認が必要である.
(2)EUS elastographyelastographyは組織に圧を加えた時の組織の弾性,硬度の違いによる変形の差を超音波で検出し,組織の弾性情報をリアルタイムに表示する技術である 24)~30).SMTの診断に関する報告ではTsujiら 25)はGISTもしくは神経鞘腫はかたく,非GISTは柔らかいと報告している.一方,Igneeら 24)はGISTと平滑筋腫では差を認めなかったものの,評価方法の検討の必要性について述べている.これらの手法に関してもさらに研究が進むことを望みたい.
SMTの超音波内視鏡診断について概説した.SMTはEUSがその診断に有用な領域であるが,その診断には病変の特徴を描出することが不可欠である.しかし,EUS診断でも確定診断を行うことが難しい病変も多く存在する.そのような病変に対しては,EUS-FNAおよび開窓生検法など様々な手法で組織採取が行われているが,今後新しい診断技術の開発による画像診断の進歩を期待したい.
本論文内容に関連する著者の利益相反:なし