2021 年 63 巻 6 号 p. 1232-1240
2021 年 63 巻 6 号 p. 1232-1240
【目的】最近,Class Activation Mapping(CAM)という手法により人工知能(AI)の関心領域(ROI)を可視化できるようになった.本研究ではAIの大腸T1b癌診断におけるROIの特徴を明らかとすることを目的とした.
【方法】大腸pT1b癌の通常内視鏡画像114病変226枚を使用した.CAMにより,AIのROIは赤色領域として示され,大腸内視鏡医のROIと比較した.評価項目は,内視鏡医とのROI一致性,AIのROIの性状とした.ROI一致性の評価は,excellent:75%以上が一致,poor:25%未満,good:その中間とした.
【結果】全画像でCAM画像が作成可能だった.ROI一致性は,excellent 39%,good 34%,poor 27%であった.poor例を除いたAIのROIは,多くが発赤部位であり(91%),明らかに血液が付着した領域(21%)やヒダ集中(34%)は少なく,隆起(57%)や陥凹(39%)が多かった.
【結論】ROIが一致する場合には内視鏡医との類似性がみられた.アノテーションによりROIの不一致を克服することが,AIの学習効率の改善につながる可能性がある.
近年,治療内視鏡の進歩により大腸cT1癌に対する内視鏡治療の適応が広がっている 1)~6).しかし,粘膜下層に1mm以上浸潤する大腸T1b癌はリンパ節転移のリスク因子となることから深達度診断の重要性は高い.したがってcT1癌が疑われる場合は術前の拡大内視鏡観察や超音波内視鏡で適応を判断したうえで 7)~12),病変を一括切除し,詳細な病理学的評価を行うことが求められる.このような病変は内視鏡的粘膜下層剝離術(endoscopic submucosal dissection:ESD)の良い適応である.しかし,cT1b癌と内視鏡切除で根治が望めるcT1a癌,cTis癌は内視鏡所見が似ていることから,診断が困難となることも少なくなく 13),14),不十分な診断から分割切除が施行され,正確な病理診断が損なわれる危険性も否めない.日常内視鏡診療の中でこのような深達度診断が重要となる早期癌を通常内視鏡画像から簡便に診断し,深達度を推測できる技術があればその有用性は高い.
人工知能(AI)を内視鏡的深達度診断に応用する研究も始まってはいるが,pT1b癌のAI診断の報告は未だ少ない現状にある 15)~17).最近,われわれが行った先行研究 18)において,通常内視鏡画像を用いたAIによる大腸pT1b癌の診断精度は比較的高い結果が得られた(感度80%,特異度87%,正診率84%).更なる診断精度の向上が求められるが,AIが学習する過程はブラックボックスとされ,少なからず精度向上の妨げとなっていた.近年,Class Activation Mapping(CAM)という手法の開発により,AIの画像認識モデルにおいて画像認識に寄与したとされる領域を可視化することが可能となった 19).これはAIが画像を認識する過程で,診断の根拠として用いた部分を,その重要度に応じて色分けして出力する手法である.すなわちCAMを用いることで,AIが何をみて診断しているかを認識できるようになった.CAMは元来,AIが効率良く学習するために開発されたものであるが,CAMを用いてAIの関心領域(Region of Interest,ROI)を知ることにより,内視鏡医の診断能力の向上につながる可能性も考えられる.しかし,著者らの知る限り,CAMを用いたROIの報告は英文誌を含めてもない.本研究では,AIのROIの特徴を明らかとすることを主たる目的とし,内視鏡専門医との類似性についても検討を加えた.
本研究は,大腸pT1b癌のAI診断に関するpost hoc研究である.CAM画像を作成することにより,AIの内視鏡診断におけるROIを明らかにすることを目的とした.なお,先行研究(福島県立医科大学倫理委員会登録番号2952) 18)では,福島県立医科大学会津医療センター及び自治医科大学から収集した内視鏡画像を用いて,AIの学習を行い,小樽掖済会病院の内視鏡画像によりAIの診断能を評価した.
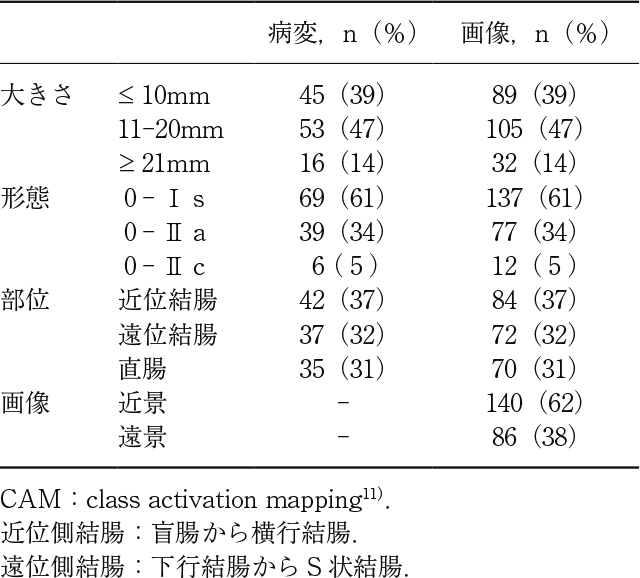
使用した内視鏡画像CAMを作成する内視鏡画像は,先行研究のために国内3施設から集積したものを用いた.教師データ及び試験データとして用いた内視鏡画像のうち,組織学的にT1b癌と判断された114病変(0-Ⅰs 69,0-Ⅱa 39,0-Ⅱc 6;最大径16.5±13.4mm)の内視鏡画像226枚(近景140枚,遠景86枚)を使用した(Table 1).それぞれの画像においてT1b癌と診断できるものに限定し,画質も考慮して1病変につき最大2枚の内視鏡画像を選択した(Figure 1).最終的に,1枚選択したものが2病変,2枚選択したものが114病変であり,2枚選択した場合はそれぞれ別病変として取り扱った.
CAM画像を作成したpT1b癌の特徴.

CAM画像作成に使用した内視鏡画像の選定.
CAM画像の作成は,会津大学コンピュータ理工学部の共同研究グループが行った.先行研究 13)においてAIの学習にはResNet50 20)を使用した.ResNet50とは,画像認識に用いられる畳み込みニューラルネットワークの一つである.ResNet50を用いた画像認識の過程で重み付けられた領域をヒートマップ化することでCAM画像を作成した.作成されたCAM画像ではAIのROIは赤色領域として示された.
内視鏡医によるROIの評価内視鏡医のROIは,従来から報告されている陥凹や表面不整,潰瘍,びらん,血液付着,ヒダ集中などのcT1bと診断可能な内視鏡所見 9)を有する領域を画像毎に大腸内視鏡専門医2名が合議制で,AIのROI結果をblindとして決定した.なお,大腸内視鏡専門医2名(DN,YN)はそれぞれ12年目,8年目の消化器病学会/消化器内視鏡学会の専門医であるばかりでなく,日常的に大腸内視鏡検査を行い,毎週行われる大腸内視鏡検査に関する院内グループカンファランスに参加し,少なくとも500例以上の早期大腸癌に対する内視鏡診断の経験を有する.
AIと内視鏡医の比較評価項目は,内視鏡医とのROI一致性,色調,凹凸,血液の付着,ヒダ集中とした.ROI一致性の評価は,excellent:AIのROIの75%以上が内視鏡医のROIに含まれる,poor:25%未満が含まれる,good:その中間とした(Figure 2).本研究では,上記の記述統計を主たる目的とし,統計学的検定は行っていない.

ROI一致性の評価基準.
a:CAM画像作成に用いる内視鏡画像.
b:aにおける内視鏡医のROI(黄色四角).
c~e:CAM画像.赤い領域がAIのROI.黄色点線の四角が内視鏡医のROI.
c:excellent.AIと内視鏡医のROI一致性が75%以上.
d:good.AIと内視鏡医のROI一致性が25-74%.
e:poor.AIと内視鏡医のROI一致性が25%未満.
226枚の全画像でCAM画像が作成可能だった.CAM画像から得られたAIと内視鏡医とのROI一致性は,excellent 27%,good 34%,poor 40%であり,excellentとgoodを合わせた一致例は60%程度であった(Table 2).病変の内視鏡画像を,1ヒダ以内の近接像を近景画像,2ヒダ以上離れた画像を遠景画像と定義して検討すると,遠景画像でexcellentが増加する傾向がみられた.しかし,病変の大きさ・形態・部位別の解析では特徴的な所見は認められなかった.poor例を除いたAIのROIは,多くが赤色調を呈したが,明らかに血液が付着した領域は少なかった(Table 3).凹凸は,隆起56%,陥凹39%,平坦5%であった.ヒダ集中は34%に認められた.

AIと内視鏡医間ROIの一致性.

AIと内視鏡医で一致したROI*の特徴.
poor例ではROIが病変外に存在するものは60例(66%)あった(Table 4).一方,内視鏡医とのROIの一致性が評価基準を満たさないがROIが病変内に存在するものや,内視鏡医のROI内に存在するが25%の一致を満たさないものが31例(34%)あった.

不一致(poor)例におけるAIのROI:病変との関係.
症例を2例提示する.症例1は,径10mm,肉眼型0-ⅠsのpT1b病変である.発赤が目立ち,形態はやや分葉状であるが,隆起部の陥凹は目立たず,ヒダ集中は認めない.AIのROIは,発赤調,隆起部であった(Figure 3).症例2は,径10mm,肉眼型0-ⅠsのpT1b病変である.発赤調で頂部の陥凹が目立つ.AIのROIは,発赤調,陥凹を含めた隆起部であった(Figure 4).

症例1.
径10mmの0-Ⅰs.3-aは元画像.3-bはCAM画像.AIのROIは,発赤調,隆起部である.

症例2.
径10mmの0-Ⅰs.4-aは元画像.4-bはCAM画像.AIのROIは,発赤調,陥凹を含めた隆起部が含まれている.
近年,AIによる内視鏡診断の研究が進み,高い診断能力が報告されている.今後,実用化に向けて更なる診断精度の向上が求められるが,AIの学習や診断の過程はブラックボックスとされており,学習過程の最適化を図ることは困難であった.しかし,今回用いたCAMは,AIの画像認識モデルにおいて,認識に寄与したとされる領域を可視化できるため,AIが診断に用いたROIを知ることが可能であり,AIの診断精度の向上の一助となる可能性がある.
われわれはpT1b癌の内視鏡画像からCAM画像を作成することが可能であった.今回CAM画像作成には,今回先行研究で用いた白色光非拡大画像のみを使用しており,特殊光や拡大観察画像は用いていない.この理由を説明する.画像強調内視鏡や拡大内視鏡での観察や超音波内視鏡による深達度診断法は,きわめて有用であることは誰もが認めるところであるが,正確に診断するためには専門的な知識・技術を要し,この国際化が進んでいない現状がある.今後,グローバルな早期大腸癌診療の展望を考えたときに,内視鏡医なら誰もが用いる白色光非拡大画像でのAI診断が可能となれば,国際的なインパクトは計り知れないと著者らは考えているので,敢えて白色光非拡大画像のみを使用した.
本研究の結果から,AIと内視鏡医のROI一致性はexcellentとgoodを合わせて61%と一致しているものが多く,一致している場合は,隆起部や陥凹部をROIとしており,内視鏡医のROIと酷似していた.一方,poor例が39%と必ずしも内視鏡医と一致していない症例もあった.これらは異なるROIにより大腸pT1癌を診断している可能性が考えられた.
近年のAI技術の進歩は目覚ましいものがあり,日常生活で実用化されているものも少なくない.多くの場合,AIがいかに人間の行う動作や判断に近づき,ヒューマンエラーを防止できるかを目的としており,AIを用いた内視鏡診断も同様の理念で研究が進んでいる.既報では,AIを用いた大腸pT1b癌診断の正診率は81.2%と報告されており 10),内視鏡医の正診率 9)には及んでいないのが現状である.そのため,まずは内視鏡医と同等の診断能力に近づくために,AIのROIを内視鏡医に近づけることは有効な方法論と考えられる.今回の結果で,ROI不一致例が約40%を占めていたことからは,AIの学習段階でpT1bと診断可能な内視鏡医のROIを学習させることができれば,AIの診断精度向上につながる可能性がある.そのため,内視鏡医のROIを四角などで囲ってタグ付けするアノテーションという作業を加えることにより,AIの学習効率が改善し,診断精度が向上することが期待される.
一方,ROI不一致例については,内視鏡医と異なるROIでT1b癌を診断している可能性があり,そのROIを診断価値のないものと位置付けるのは時期尚早である.特にROI不一致例の66%が病変外をROIとしていたことからは,病変外の何らかの要素を診断根拠としていた可能性も考えられる(Table 4).今後そのような観点から,現在の内視鏡医のT1b診断におけるROI以外に精度の高い診断基準が明らかとなる可能性もあり,その所見が今回のROI不一致例に含まれているかもしれない.その場合は,内視鏡医のROIをアノテーションするのではなく,より多くの画像を教師データとして用いることが診断精度向上に有用となるだろう.現時点で,アノテーションと教師データ数の増量による学習効率の改善,診断精度上昇などの比較はできておらず,今後の研究課題としたい.
本研究の強みは,多施設共同研究であるため,比較的多く症例を集積し,解析できたことである.本研究では114例のT1b癌を集積できたことが,今回のような一定の結論につながったと考えられる.一方,本研究にはいくつかの問題も潜んでいる.第1に,画像選択の段階で画質の低いものを除外した対象としたために,研究結果は限定的である可能性がある.第2には,ROIの性状を2名の大腸内視鏡専門医による合議制で評価していることである.そのため,評価の妥当性を客観的に検証することができておらず,将来的に多くの専門医による再検証が必要になるのかもしれない.第3には,ROIが一致していない症例が1/3程度存在し,この原因が完全には解明できていない点がある.今後,CAMに熟知した工学者との更なる議論が必要と考えられる.第4には,本研究において組織型や深達度別の解析ができていないことである.特に深達度については,今回の研究に用いられた内視鏡画像のほとんどが内視鏡治療適応となった病変であったため,cTisやcT1aの診断で内視鏡治療が行われた病変が多く含まれており,典型的なpT1bの所見が多くなかった可能性がある.今後,初回治療として外科切除が施行されたpT1b病変も含めた検討ができれば,AIの診断傾向が明瞭となる可能性がある.
本研究は,T1b癌の拾い上げ(存在診断)に寄与できる側面もあると考えられる.著者らは,スクリーニング内視鏡検査中にT1b癌に遭遇した際,AIがred flagなどにより注意喚起できるようなAIシステムを構築したいと考えている.本研究がそのようなAIシステムを構築するための契機となることにも期待している.
多施設から収集したpT1b画像を用いてCAM画像を作成し,AIのROIについて検討した.AIと内視鏡医のROIは概ね一致しており,その場合のAIのROIは内視鏡医と類似性があると考えられた.またT1b癌と診断可能な領域をアノテーションすることによりROIの不一致を克服することが,AIの学習効率の改善につながる可能性があると考えられた.
本論文内容に関連する著者の利益相反:朱欣(日本学術振興会(2018年-2020年度科研費基礎研究C 研究課題番号18K11532 18K08010)),山本博徳(富士フイルムメディカル株式会社)