2022 年 64 巻 11 号 p. 2371-2377
2022 年 64 巻 11 号 p. 2371-2377
症例は43歳男性.2016年より年1回上部消化管内視鏡検査を受けており,胃角部から前庭部に多発する褪色斑を認めていたが生検がされていなかった.2020年に同病変を生検したところ印環細胞癌と診断された.幽門側胃切除を施行し,手術検体の病理検査では42カ所の小病変を認め,すべて粘膜内癌であった.遺伝性びまん性胃癌が疑われ遺伝学的検査を行い,CDH1遺伝子に病的変異を認め,診断に至った.
A 43-year-old man underwent annual gastrointestinal endoscopy since 2016 for surveillance of multiple small pale antral lesions, which were not evaluated histopathologically. Biopsy performed for the first time in 2020 revealed a signet-ring cell carcinoma. He underwent distal gastrectomy, and histopathological examination of the surgical specimen revealed 42 small lesions, all of which were diagnosed as carcinoma in situ. We suspected hereditary diffuse gastric cancer (HDGC) and performed genetic analysis, which revealed the CDH1 germline pathogenic variant of the cancer, and the patient was definitively diagnosed with HDGC.
日本において胃癌はHelicobacter pylori(H. pylori)感染が誘因となり発症することが多いが,遺伝性腫瘍症候群として発症する胃癌も少ないながら存在する.代表的な遺伝性胃癌として遺伝性びまん性胃癌(Hereditary Diffuse Gastric Cancer: HDGC)が挙げられる.本疾患は細胞接着因子であるEカドヘリン蛋白をコードするCDH1遺伝子のgermline pathogenic variantが原因で起こる常染色体優性遺伝形式の疾患で,病理学的には胃内に印環細胞癌の小さな集簇が多発し,内視鏡所見では,それら癌細胞の集簇が多発する褪色斑として描出されるのが特徴的である.今回われわれは4年間内視鏡像に変化を認めなかったHDGC症例を経験したので,文献的考察を加えて報告する.
症例:43歳,男性.
主訴:なし.
既往歴:31歳時に十二指腸潰瘍,H. pylori感染胃炎に対して除菌治療を施行.33歳時よりCastleman病に対して治療継続中.
家族歴:兄が37歳時に胃体下部胃癌(por2+sig,pT1bN0M0,pStage IA.)に対して幽門側胃切除を受けており,手術時はH. pylori感染状態であった.
定期処方薬:プレドニゾロン2.5mg,ランソプラゾール15mg,トシリズマブ8mg/kg(2週に1回静注).
現病歴:H. pylori既感染に対する経過観察目的に,2016年より年に1回上部消化管内視鏡検査を受けていた.当初より胃角部から前庭部に多発する褪色斑を認めていたが当時の担当医より腸上皮化生と判定され,その後も形態に変化がないことから1度も生検がされていなかった.2020年も内視鏡スクリーニング目的に当科紹介となった.
入院時現症:特記すべき事項なし.
血液検査所見:血算,生化学検査で異常は認めなかった.腫瘍マーカー(CEA,CA19-9)の上昇は認めなかった.血清抗H. pylori抗体<3.0U/mlで陰性であった.
上部消化管内視鏡検査(Figure 1):胃角部のregular arrangement of collecting venules(RAC)陽性で,萎縮変化は乏しかった.胃角部から前庭部に,全周性に多発する径5mm前後の褪色斑を認めた.病変はBlue light imaging(BLI)モードでより明瞭に描出された.同病変の拡大内視鏡観察では,非病変部と比較して血管像が明瞭に視認できたが,血管構築や表面構造の異型は乏しく,demarcation line(DL)の同定は困難であった.5カ所の褪色斑を生検し,すべてがGroup 5;印環細胞癌(signet ring cell carcinoma:sig)と診断された.過去画像を確認したところ,この褪色斑は2016年の内視鏡画像から認められており(Figure 2),4年の経過で形態変化は認められなかった.
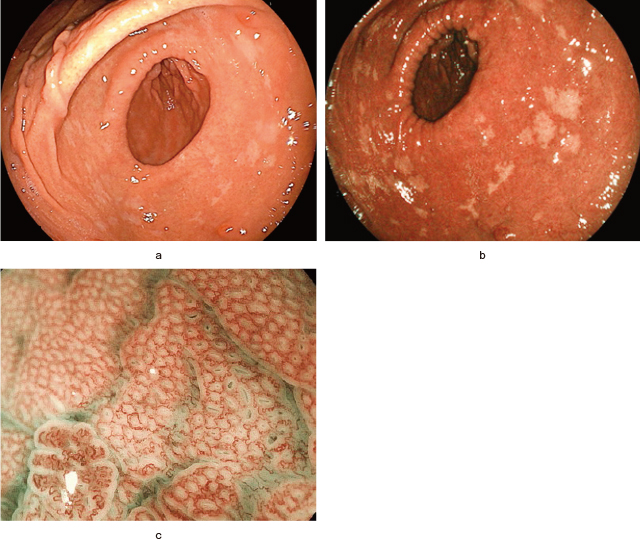
上部消化管内視鏡画像.
a:白色光観察では胃角部から前庭部に多発する径5mm前後の平坦な褪色斑を認めた.
b:Blue light imagingモードでは,病変はより明瞭に描出された.
c:拡大内視鏡観察では,病変部は非病変部と比較して血管像が明瞭に視認できたが,明らかな血管構築や表面構造の異型は乏しく,demarcation lineの同定は困難であった.

過去の上部消化管内視鏡画像.
a:2016年.
b:2017年.
このころから前庭部に多発する褪色斑を認めていた.
胸腹部造影CT所見:明らかな胃壁の肥厚はなく,リンパ節転移,遠隔転移を認めなかった.
臨床経過:再度上部消化管内視鏡検査を行い,病変より口側(穹窿部~胃体部)の陰性生検を10カ所施行し,病変が胃角部から前庭部に現局していることを確認し,幽門側胃切除+D2郭清+Roux-en-Y再建術を行った.
病理組織検査所見(Figure 3):摘出標本では前庭部に42カ所の小さなsig病変を認めたが,すべて腺頸部に現局した粘膜内癌であった.Ki-67 indexは1%未満で増殖能は乏しかった.口側,肛門側断端は陰性だった.病期はpT1aN0M0 pStage IAであった.背景胃粘膜に炎症細胞浸潤はほとんど認めなかった.
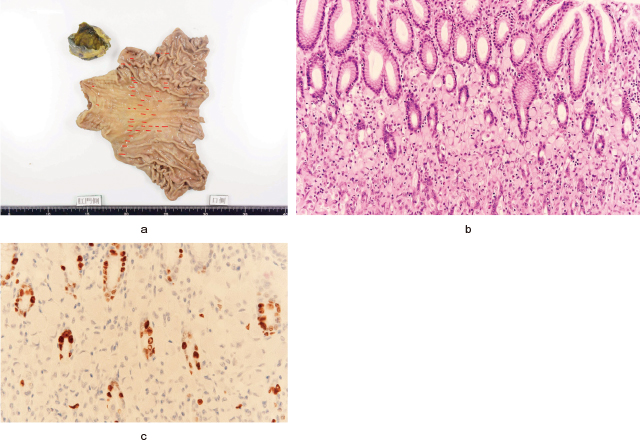
病理組織像.
a:摘出標本では前庭部から胃体下部に42カ所のsig病変(赤線)を認めた.
b:腺頸部に限局した印環細胞癌の集簇を認めた.炎症細胞浸潤はほとんど認めなかった(HE染色,×10倍).
c:Ki-67 indexは1%未満で増殖能は乏しかった(×20倍).
特徴的な所見よりHDGCを疑い,術後にインフォームドコンセントを得て遺伝学的検査を施行し,CDH1遺伝子の病的変異(c.142A>T,p.Arg48Ter)が認められたため,HDGCの診断に至った.残胃の発癌リスクを考慮し,追加切除を提案したが同意は得られなかった.術後は半年毎に内視鏡による経過観察を行い,その度10カ所以上のランダム生検を行っているが,残胃に新規病変の出現はなく1年経過している.
血縁者スクリーニングを行い,母,妹に同様の遺伝子変異が確認された.胃癌手術歴のある兄からは遺伝学的検査の同意が得られず,検査ができなかった(Figure 4).今後家族に対しても病変検索を予定している.

家系図とCDH1遺伝子変異の有無.
本邦における胃癌発症経路としては,H. pyloriの持続感染により萎縮性胃炎・腸上皮化生をきたし,そこから癌が発生してくるパターンがほとんどである.しかし,稀ながら本症例のような遺伝的素因が原因で発症する胃癌も存在する.
HDGCはCDH1遺伝子変異により細胞接着因子であるEカドヘリン蛋白が異常をきたし印環細胞癌を発症する常染色体優性遺伝形式の疾患である 1).最近の報告によれば,胃癌累積発症リスクは男性で42%,女性で33%とされており,女性の場合は小葉乳癌(Lobular breast cancer:LBC)の罹患リスクも55%となっている 2).近年では,Eカドヘリンと結合することで細胞接着に関与しているα-カテニンをコードするCTNNA1遺伝子もHDGC発症に関連することが報告されており 3),このためHDGCが疑われるがCDH1の病的変異が確認されなかった場合は,CTNNA1の遺伝学的検査も推奨されている 4).
本症例は内視鏡像が4年間変化なく経過しており,病理検査でもKi-67 indexが1%未満と増殖能の乏しい腫瘍であった.HDGCではない一般的な早期印環細胞癌に関しては,年単位で進行を認めなかった症例の報告は本邦でも数例あり 5)~7),近年では純粋な印環細胞癌は進行が遅く,H. pylori感染などの炎症性変化が加わることで増殖能・浸潤能が上がる可能性が示唆されている 8),9).
HDGCは前述のようにCDH1遺伝子変異が原因で印環細胞癌を発症する.マウスの研究では,CDH1を欠損させたマウスの胃内にはsignet ring like cellが出現するが,それらは粘膜下層への浸潤はきたさず 10),CDH1に加えてがん抑制遺伝子であるTP53を欠損させたダブルノックアウトマウスは進行癌となると報告されている 11).H. pylori感染者の胃上皮細胞では炎症によりTP53の変異が蓄積されていることが報告されており 12),これらのことからHDGCにおいてもH. pylori感染は病態を進行させる一因であると考える.本症例と同様に同一家系内で進行度が異なったHDGCの症例報告でも,進行癌症例はH. pylori現感染状態で早期癌症例はH. pylori未感染だった 13).本症例はH. pylori未感染ではなく除菌後であるが,30代の早い時期で除菌を行い,胃粘膜の炎症性変化が改善されたことが,兄と比較して長期間進行をきたさなかった一因ではないかと考察した.しかし,H. pylori陰性でも進行癌となったHDGC症例の報告もあるため 14),H. pylori以外にも増殖能に影響を与える因子の存在が考えられる.
HDGCガイドライン 4)ではCDH1遺伝子に病的変異を認めた場合は予防的胃全摘が推奨されているが,予防的胃全摘の同意が得られない場合も多い.その場合は半年毎の内視鏡スクリーニングを行い,ターゲット生検・ランダム生検を28~30個(噴門部3~5個,穹窿部5個,胃体部10個,移行部5個,前庭部5個)行うことを推奨している 4).Emmaらの報告ではCDH1遺伝子変異を有する患者に対して上記プロトコルでスクリーニングを行ったところ,印環細胞癌検出率はランダム生検で75%,ターゲット生検で41%だったと報告している 15).本邦におけるHDGCの症例報告は,本症例と同様に多発する褪色斑のターゲット生検がきっかけになり診断に至る例が多く 16),このことからもランダム生検とターゲット生検を組み合わせてスクリーニングを行うことが重要と考える.
本症例は数年間にわたり腸上皮化生と判定されていた.確かに前庭部に多発する白色調病変として鑑別が必要だが,腸上皮化生は一般的に扁平隆起型であり,narrow band imaging(NBI)拡大観察では青い縁取り(light blue crest:LBC)や,化生粘膜上皮下の白色透明物質(white opaque substance:WOS)が認められる点 17)から鑑別が可能と考える.
今回,病変部の拡大内視鏡観察では明らかなDL,血管・腺管構造の異型を特定できなかったが,腺頸部に限局している早期印環細胞癌は表層の腺窩上皮と上皮下血管網の構築は破壊されていないため表面構造と血管構築をもとにしたDLの設定は困難とされている 18),19).本症例で認めた血管構造の明瞭化は,印環細胞の豊富な粘液により周囲の粘膜と比べて窩間部が白色化するために生じる所見であり,腺頸部に限局するH. pylori未感染印環細胞癌の拡大内視鏡所見の一つとされているが 19),この所見のみで質的診断や範囲診断を行うことは困難であり,褪色調を呈する病変は生検を行うことが重要である.
一般的なH. pylori未感染印環細胞癌は胃角部から前庭部に発症することが多いと報告されている 7).HDGCも同様に大きな病変は胃角部から前庭部に好発し,それが契機となり診断されるが,術後標本を評価すると体上部から穹窿部には術前内視鏡では同定できなかった微小な病変が併発していることが多く 20),本症例も内視鏡で視認できていない小さな病巣が残胃に存在している可能性は否定できない.本症例と同様に胃前庭部切除を行ったHDGCの報告もあるが,その症例は術後8カ月目の内視鏡スクリーニングで残胃に新規病変を認め残胃摘出が行われている 21).これらのことより,本症例が4年間進行しなかった点を考慮すると,遺伝学的検査の結果が出るまでの数カ月は治療を待機しても病態は進行しなかった可能性があり,術前に遺伝学的検査まで行い,HDGCの確定診断を行った上で胃全摘の必要性を評価するべきであった.現時点では患者より残胃切除の同意は得られておらず,今後も注意深く内視鏡フォローを行っていく方針である.
内視鏡所見上,4年間進行を認めなかったHDGCを経験した.若年患者に多発する印環細胞癌を認めた場合は本疾患を考えて遺伝学的検査を行うことが必要である.また,H. pylori感染がない場合,早期印環細胞癌は比較的進行が遅い可能性が示唆されており,今後症例の蓄積と更なる検討が必要である.
本稿の要旨は,第2回Helicobacter pylori未感染と除菌後時代の胃癌発見に役立つ内視鏡診断の構築研究会(2021.5.16)にて発表した.
HDGCの遺伝学的検査についてはAMED吉田班19ck0106268h0003“多施設共同遺伝性腫瘍「汎用プロトコル」の臨床疫学的データに基づく,ゲノム情報で規定される超高リスク群捕捉法の確立”の支援を受けていることを明記いたします.
本論文内容に関連する著者の利益相反:なし