2012 年 29 巻 3 号 p. 230-233
2012 年 29 巻 3 号 p. 230-233
我が国の分化型甲状腺癌に対しての放射性ヨード内用療法は年々,実施数が増えてきている。しかし,実施に必要な放射線治療病室が少なく,その稼動病室も減少してきているため,患者の待機期間が長くなってきている。しかし近年,内用療法を取り巻く環境が変わってきた。一つは,遠隔転移のない全摘術後の患者には1,110MBq(30mCi)投与の残存甲状腺に対するアブレーションが外来で実施可能となった。さらにリコンビナントヒトTSH(rhTSH,タイロゲンⓇ)にアブレーションの補助としての効能追加が認められたことである。今後,タイロゲンを併用することで,患者のQOLを低下させずにアブレーションを実施できることが期待される。
分化型甲状腺における甲状腺全摘術(準全摘)後のアブレーションは甲状腺腫瘍診療ガイドライン[1]によると,特にハイリスク症例では行う意義がある(推奨グレードB)とされている。しかしながら我が国における放射性ヨード内用療法は実施できる放射線治療病室が少なく,遠隔転移に対する治療も十分に行えない状況であるためアブレーションを行う環境が整っていない。
2010年,厚労省からの患者の退出基準の通知[2]により,1,110MBqのI-131投与であれば外来においてアブレーションを行うことが可能となった。さらに今春にrhTSH(タイロゲン)がアブレーションの補助として効能追加され,アブレーションの実施が増えてきている。
我が国の分化型甲状腺癌の治療件数は年々増加している。しかしながら稼動している放射線治療病室は減少傾向にある。それにより患者の待機期間は長くなる傾向にあり2010年では平均5.2カ月となっている(図1-3)[3]。

I-131治療用カプセル(大包装)の使用推移。

RI治療病室を保有する施設数および病床数の推移。

RI治療病室稼動施設におけるRI内用療法の待機期間。
一方,東らは遠隔転移のある甲状腺癌患者の全摘術から初回の放射性ヨード内用療法実施までの期間が180日を超える群は,180日以内の群に比べ死亡率が4.2倍高くなり[4],さらに再発例だけに絞って検討してみると同様の群間比較で死亡率は15.7倍高くなると報告している[5]。
2010年11月に厚労省から退出基準の通知[2]が出され,遠隔転移のない分化型甲状腺癌で甲状腺全摘術後のアブレーションはI-131の投与量が1,110MBqまでなら外来で実施できるようになった。この退出基準では介護者の被ばく積算線量が5mSvを超えないこととされているが,安全管理の研究の結果,ほとんどが0.2mSv以下であることが検証された(図4)[6]。

Measured radiation exposure dose of caregivers versus integrated contact time of patients and caregivers during 7 days after administration of I-131.
ただし,外来アブレーションを実施するには,医師と診療放射線技師が安全管理の講習会を受講し,関連学会の発行する実施要綱に従って行わなければならない。
甲状腺腫瘍診療ガイドライン[1]によるとアブレーションには30mCi~100mCiのI-131投与量が必要とされているが,その投与量は残存甲状腺組織の重量によっても成否が分かれる。
海外では遠隔転移のない分化型甲状腺癌の1,110MBq投与でのアブレーションの奏効率は83.6%という報告がある[7]。我が国でも渋谷らにより76.7%,筒井らにより96%の奏効率が報告されている[8]。
分化型甲状腺癌に対する治療環境は近年大きく変化してきている。外来での1,110MBqアブレーションの承認により,治療ベッドを有さない施設においても実施可能となった。それに加えて,タイロゲンが2012年5月に『分化型甲状腺癌で甲状腺全摘又は準全摘を施行された遠隔転移を認めない患者における残存甲状腺組織の放射性ヨウ素によるアブレーションの補助』の効能が追加となり,今後,安全かつ患者のQOLを向上させたアブレーションの実施が期待される。今回の承認は,医療上必要性の高い未承認薬・適応外薬検討会議にて新たに臨床試験を行わず,既存の情報を用いて申請し,早期に臨床現場に供することが適切と判断され早期承認に至った。
アブレーションを行うには先立って,血中のTSH 濃度を上昇させる必要がある。従来の方法では甲状腺ホルモン剤の投与を一定期間中止する必要があり,患者は甲状腺機能低下のため,疲労や思考能力の低下,耐寒性の低下,便秘など精神的,身体的な苦痛を伴った。また,腎機能の低下および血清脂質の上昇もみられるとの報告がある[9,10]。タイロゲンは24時間間隔で2回筋肉内注射し,翌日I-131を服用させる(図5)。ヨード制限は従来通り行うが,甲状腺ホルモン剤の投与は中断する必要がなく,確実にTSHは上昇し甲状腺機能低下させることなくアブレーションが実現できる。

タイロゲン投与スケジュール。
海外におけるタイロゲン(Thyrogen,Genzyme Corporation,Cambridge,MA,USA)によるアブレーションは,2000年にEU,2007年に米国にて既に承認され,数多くの臨床報告がされておりエビデンスは豊富である[11,12]。本邦の甲状腺腫瘍診療ガイドラインにおいても,「質の高いエビデンスがあり,診療で利用・実践することが強く勧められている」とされ,推奨度Aである(図6)。タイロゲンは甲状腺機能低下による諸症状を抑え,患者のQOLを向上させることに加えて,腎クリアランスを正常に保つことで被ばく量の軽減や長期癌細胞刺激の回避も期待されるとしている[1]。

甲状腺腫瘍診療ガイドライン CQ44。
タイロゲンのアブレーションとしての有用性は,欧米において確認されている[11,12]。甲状腺全摘後の患者を対象として,タイロゲンを使用した群と甲状腺ホルモン休薬群の100mCiによる I-131 アブレーションの奏効を,8カ月後の頸部シンチグラフィおよび血清Tgにて評価している[9]。両群とも100%でアブレーション奏効と判定され,そのうち甲状腺床の完全消失が認められた完全奏効率はそれぞれ75.0%,85.7%であった。また,血清Tg値が2ng/mL未満の症例はタイロゲン群で96%,甲状腺ホルモン休薬法群で86%であり,有意差は認められなかった(図7)。同一症例に対する3.4年~4.4年後のシンチグラフィおよび血清Tgによる追跡調査においても,両群の被験者の100%が奏効したままであり,血清Tg値が2ng/mL未満の症例はタイロゲン群の96%,甲状腺ホルモン休薬群の95%であった(図8)[12]。副作用の発現率は,海外の臨床試験において419例中96例(22.9%)であり,主なものは吐気,頭痛,めまい,嘔吐といずれも軽微なもので安全性は高い。

タイロゲンアブレーションの有効性。
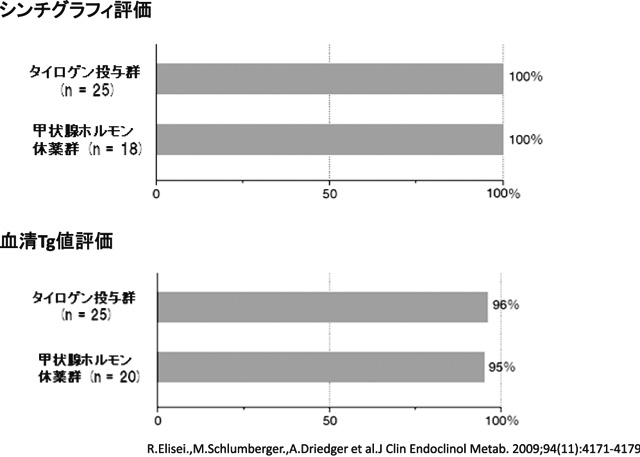
追跡調査による有効性。
甲状腺全摘術後の残存甲状腺組織の存在は,再発・転移の術後経過観察における鋭敏な指標である血清サイログロブリン値の妨げとなり,また,微小な腫瘍組織の残存による局所再発の心配がある。
欧米では,一般的に腫瘍径が1.5cmを超えるもの,45歳以上,多発性病巣,腺外浸潤,脈管侵襲,リンパ節転移,全摘後のサイログロブリン高値などがある場合には甲状腺全摘後のアブレーションが考慮されているが,本邦においては治療可能施設数の問題などにより,明らかな被膜外浸潤,脈管侵襲,リンパ節転移が累々とみられる症例,全摘後サイログロブリン高値の症例など比較的高危険群な症例に対してアブレーションが施行される傾向にある[1]。近年,低危険群の患者において,30mCiを用いたタイロゲンによるアブレーションは,100mCiによるアブレーション(タイロゲン,甲状腺ホルモン休薬法)と同等の奏効率があると報告されている[13]。従来の甲状腺ホルモン休薬法は,甲状腺機能低下による諸症状が発現するため,タイロゲンを併用したアブレーションの有用性は高いと考えられる。