2018 年 35 巻 1 号 p. 8-12
2018 年 35 巻 1 号 p. 8-12
原発性アルドステロン症(Primary aldosteronism;PA)は,病的副腎組織からの自律性のアルドステロン過剰産生・分泌に起因する疾患である。病理組織学的には,PA副腎病変は腫瘍性ないし非腫瘍性病変に分類される。とくに近年,副腎静脈サンプリング(AVS)などの発達により画像では同定されない非腫瘍性PA病変の検出が可能となり,形態学的所見のみではPAの病理組織診断が難しいケースも少なくない。現在のPA副腎病変における病理診断では,組織学的検索に加え必要に応じてアルドステロン合成酵素であるCYP11B2に対する免疫組織化学的検討を行うことが重要となってきている。一方,PA副腎病変では各種イオンチャネルやイオン交換ポンプをコードする遺伝子の体細胞変異が報告されており,同病変でのCYP11B2の発現亢進と関連付けられている。以上を踏まえ,本稿ではPA副腎病変に対する病理診断の現状とその背景となる形態学的,免疫組織化学的,分子病理学的特徴について解説する。
原発性アルドステロン症(Primary aldosteronism;PA)は二次性高血圧症や低K血症などをきたす疾患で,本邦の全高血圧症例の約5~10%を占める[1]。PAの原因は,病的副腎組織からの自律性のアルドステロン過剰産生・分泌である。臨床的には,PA病変の局在診断はCTやMRIなどの画像診断,副腎静脈サンプリング(Adrenal vein sampling;AVS)により行われ,各症例は片側性ないし両側性に分類される。従来,病理組織学的には片側性PA症例の主要因はアルドステロン産生副腎皮質腺腫(Aldosterone-producing adenoma;APA)とされ,また両側性PA症例(Bilateral hyperaldosteronism;BHA)では非腫瘍性病変が主な責任病因とされてきた。治療法は,前者では手術による病変の切除が標準的であり,後者では薬物療法が原則とされてきた。しかし近年のCTやMRIなどの画像検査の進歩に伴い,結節として検出可能となる症例が増えてきており,また画像上は結節として認識されないもののAVS技術の改良により片側性PA病変と診断され手術適応となるものも少なくない。そのため,病理診断においても微小APA症例,また切除された副腎組織にて形態学的所見のみではPAの責任病変が指摘できず,アルドステロン合成酵素であるCYP11B2などに対する免疫組織化学的検索を併用して確定診断に至る症例も数多く経験されるようになってきた。本稿では,最近の文献的考察も踏まえ,(1)腫瘤性PA病変における病理組織学的検討の現状,(2)形態学的所見と免疫組織化学的検索によるアルドステロン責任病巣の同定の実際,(3)われわれが最近提唱した非腫瘍性PA副腎病変に対する新しい組織学的分類とその意義について述べる。
腫瘍性PA病変の病理診断においては,①切除された副腎検体にて腫瘤が存在するか,②腫瘤性病変が良悪性のいずれであるか,③腫瘤性病変がPAに特徴的であるか,を丁寧に評価することが大切である。典型的なAPA症例では,肉眼的には通常片側性かつ単発性の境界明瞭な腫瘤を認めることが多い。APAの腫瘍径は3cm以下のものが殆どで,腫瘤内部は均一な黄色調を示し(いわゆる“golden yellow”),出血や壊死,周囲への浸潤はみられない[2]。組織学的には,小型類円形で軽度の小不同を示す核と脂質空胞を豊富に含有した明るい細胞質を有する淡明細胞(clear cells)と小型類円形の核と好酸性の細胞質を有する緻密細胞(compact cells)が種々の程度に混在しているが,多くの症例では前者が優勢である(図1)[2]。また病変内での腫瘍細胞の配列は,正常副腎皮質にみられるような配列の極性(zonation)が消失している。これらの腫瘍細胞では核の腫大や大小不同はみられるものの高度の核異型は認められず,核分裂像の増加,異常核分裂像,毛細血管(Sinusoid),静脈,被膜などへの浸潤もみられない[2]。副腎皮質腫瘍の良悪性鑑別において用いられるWeiss criteria(表1)[3]による評価では,APA症例は基本的にほぼ全例0~1点(緻密細胞が有意の腺腫の場合など)に相当する。またAPA症例ではコルチゾール産生副腎皮質腺腫(cortisol-producing adrenocortical adenoma;CPA)例とは異なり腫瘍内でのリンパ球浸潤,脂肪変性(lipomatous change),骨髄形成を伴う脂肪変性(myelolipomatous change)は通常みられない[2]。

典型的なアルドステロン産生副腎皮質腺腫(Aldosterone-producing adenoma;APA)の病理組織像:小型類円形で軽度の小不同を示す核と脂質空胞を豊富に含有した明るい細胞質を有する淡明細胞(clear cells)が主体に増殖している。高度異型,核分裂像,壊死など悪性を示唆する所見はみられない。

Weiss criteriaの評価項目
一方,微小なAPA症例(とくに数mm以下)では副腎皮質での非腫瘍性結節性変化との鑑別が重要である。その場合,被膜形成,核異型,Zonationの保持の有無などを丁寧に評価することが求められるが,これらの組織学的特徴が観察されない症例も少なくないため,両者の鑑別は時に非常に困難である。
APAに比して,アルドステロン産生副腎皮質癌Aldosterone-producing carcinoma;APC)の頻度は非常に稀とされてきた。しかし近年,悪性度の非常に高いAPC症例も報告も複数報告されており,常にその存在は念頭に入れておく必要がある[4,5]。副腎皮質癌の肉眼的特徴として,大きな重量,黄褐色~暗褐色調で不均一な割面,線維性被膜や腫瘍内の隔壁,出血や壊死などが挙げられ[2],組織学的特徴としては腫瘍部を構成する細胞の種類(緻密細胞が主体),高度な核異型,核分裂像の増加,異常核分裂像,毛細血管(Sinusoid),静脈,被膜などへの浸潤がある[2]。よって,APAとAPCの組織学的鑑別には,Weiss criteriaの他,種々の形態学的(亜型)variantに適した指標による慎重な評価が大切である。
高血圧の治療としてアルドステロン拮抗薬であるスピロノラクトンを投与されていた患者のAPA症例では,時に腫瘤内に「スピロノラクトン小体」という好酸性同心円状の構造をとり周囲明庭を有する腫瘍細胞核の大きさ前後の細胞質内封入体が観察されることがある(図2)[2]。これは,変性した滑面小胞体であり,腫瘤がアルドステロン過剰産生・分泌を示す一つの指標とされ,この存在は切除された副腎組織内でのアルドステロン過剰産生部位の同定に有用である。また,後述する非腫瘍性PA副腎症例でも副腎皮質球状層細胞内にこのスピロノラクトン小体を認めることもある。ただし,この所見はAPAのうち術前にスピロノラクトンを投与されていた症例にほぼ限定され,かつ必ずしもその全例でみられるわけではないので,アルドステロン過剰産生・分泌の責任病巣の同定に常に有用であるとは言い難い。一方,アルドステロン合成の最終段階を担う酵素であるCYP11B2に対する特異的な単クローン性抗体の確立により,アルドステロン合成のポテンシャルを有する細胞を病理組織標本上で可視化することができるようになった[6,7]。APAにおけるCYP11B2陽性細胞の分布は,症例によっては腫瘍全体にみられるものもあるが,非常にheterogeneous な染色性を示すような症例は少なくない(図3)[8,9]。これに関して,最近われわれはAPA症例ではCYP11B2の陽性スコアと腫瘍径が逆相関を示すことを報告した[10]。
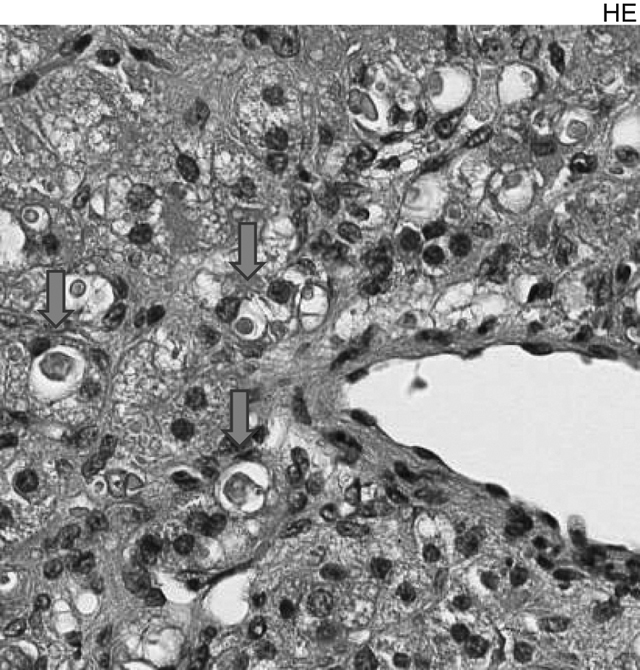
アルドステロン産生副腎皮質腺腫(Aldosterone-producing adenoma;APA)にみられる「スピロノラクトン小体」:好酸性同心円状の構造をとり周囲明庭を有する腫瘍細胞核の大きさ前後の細胞質内封入体(↓)である。

HeterogeneousなCYP11B2陽性所見を示すアルドステロン産生副腎皮質腺腫(Aldosterone-producing adenoma;APA)症例
非腫瘍性PA病変に対する病理組診断名はこれまで十分に確立しているとは言い難かった。最近,われわれはアルドステロン過剰産生・分泌をきたす非腫瘍性副腎病変に対して形態学的,免疫組織化学的検索を行った[11]。その結果,同病変では球状層においてCYP11B2陽性細胞集塊が副腎皮質面積の1%以上を占めており,またその陽性細胞の分布により①Multiple adrenocortical micronodules;MN(CYP11B2陽性細胞が結節状に集塊をなして,限局性に分布し,非結節部球状層ではCYP11B2が陰性を示す病型)と②Diffuse adrenocortical hyperplasia of the zona glomerulosa;DH(CYP11B2陽性細胞が結節部および非結節部球状層の双方に分布する瀰漫性の病型)の2種類に分類した(図4,5)[11]。また,MN症例は片側,両側症例ともほぼ同等数みられたのに対して,DH症例では両側症例が多い傾向であった[11]。更に,次世代シークエンス法により両病型でのCYP11B2陽性細胞集塊でのゲノム解析を行ったところ,MN症例ではCACNA1Dの変異が65.4%(17/26),ATP1A1が3.8%(1/26),ATP2B3が3.8%(1/26),KCNJ5が7.7%(2/26)で検出され,19.2%(5/26)は野生型であった[9]。一方,DHにおいては,6 CACNA1Dの変異が17%(1/6)で検出され,83%が野生型であった[11]。すなわち,MNではDHより『自律性』のアルドステロン過剰産生が顕著であることが示唆された[11]。以上より,MNとDHは形態像だけでは鑑別が困難な病型であるが,CYP11B2の発現動態およびアルドステロン過剰産生に関与する体細胞遺伝子変異ステータスは全く異なっており,両者は区別されるべき病変と考えられた[11]。更に,従来APAでしかみられなかったKCNJ5の体細胞遺伝子変異がMNの結節の7.7%にて検出されたことから,MNの結節の一部がAPAの発生母地となり得る可能性も示唆された[11]。しかし,APAの発症メカニズムについては今後更なる検討が必要と考えられた。

Multiple adrenocortical micronodules(MN)症例でのHE所見とCYP11B2に対する免疫染色像:CYP11B2陽性細胞が結節状に集塊をなして球状層に限局性に分布している。

Diffuse adrenocortical hyperplasia of the zona glomerulosa(DH)症例でのHE所見とCYP11B2に対する免疫染色像:CYP11B2陽性細胞が球状層において結節状および線状を呈しながら瀰漫性に分布している。
信頼性のある非常に特異性の高いCYP11B2モノクローナル抗体の開発により,非腫瘍性病変を含むPA副腎病変の病理学的評価,責任病変の同定がより行いやすくなった一方で,免疫組織化学的検索結果の判定は時として難しいこともあり,またその結果に依存しすぎると誤った判断を行うことが危惧される。腫瘍性病変,非腫瘍性病変を問わず,あくまでも正確な形態学的評価がPA病変に対する病理診断には必須であり,更に画像所見を含む臨床情報と併せて慎重に判断することが重要である。