褐色細胞腫とパラガングリオーマ(PPGL)はカテコールアミン産生腫瘍であるため,術前より適切に選択的α1遮断薬(主にドキサゾシン)を投与して周術期合併症リスクを軽減させる必要がある。本邦および各国の主なPPGLのガイドラインでは,術前のドキサゾシンの推奨投与量や投与期間,メチロシンの併用や生理食塩水の点滴負荷の有無などについてそれぞれ推奨度がやや異なる。当院での126例のPPGL手術症例経験に基づくと,ドキサゾシンの術前投与は約2カ月前から開始し,最終投与量目標は16mgに設定し,緩やかに漸増させ,その間は塩分や水分の経口摂取を励行することで安全かつ十分な術前準備が可能であり,メチロシン投与や生食点滴負荷は必須ではないと考える。また正常高血圧で自覚症状がない無症候性症例や,カテコールアミン産生が診断基準に満たない非機能性症例に対しても,術前ドキサゾシンの非投与時のリスクが大きいため,画像上PPGLと診断された症例は全例に術前ドキサゾシン投与することを推奨する。
褐色細胞腫・パラガングリオーマ(pheochromocytoma・paraganglioma:PPGL)は,根治治癒切除可能な場合は手術による腫瘍切除術が第一選択となる疾患である。 PPGLはカテコールアミン産生腫瘍であるため,術前にα遮断薬による前処置が必要であり,術後低血圧や低血糖などに対する対策を行う必要がある[1]。本稿では,本邦および各国のガイドラインを比較した上で,当院での治療経験を基にα遮断薬の適切な投与方法を中心に現時点での周術期管理の指針を示したい。
PPGLは高血圧や頻脈・動悸・頭痛など多彩な臨床症状がみられるが,その一方で高血圧や自覚症状のみられない無症候性PPGLが約35%存在する[1~3]。また,画像検査上PPGLを疑われるが,臨床検査でカテコールアミン産生の有意な上昇を認めない非機能性PPGLの存在も一定の割合で存在し[4],当科のPPGL手術症例では38.9%が非機能性に該当した。
PPGLの病態はカテコールアミンの過剰による血管収縮,それに引き続く循環血液量減少が主要な部分を占める[5]。一見無症候性であっても循環血液量はかなり減少しているようである。また,自験例からは,非機能性と診断された症例でも術中異常高血圧を呈する例があり,術前の臨床検査で確実に非機能性を証明できるわけではない。これら無症候性/非機能性PPGLに対してα遮断薬投与が行われないまま外科治療に至ると,術中血圧の急激な変動(特に問題となるのは腫瘍摘出後の急激な低血圧)を招き心血管系合併症による周術期手術死亡を引き起こしかねない[4]。本稿では,正常血圧で自覚症状もない症例を“無症候性”,PPGLの機能診断基準の一つである24時間尿中メタネフリン分画が施設基準の正常上限の3倍に満たない症例を“非機能性”と定義し,無症候性/非機能性PPGLに対する術前α遮断薬投与のリスクベネフィットについても詳述する。
PPGLの手術治療は,1927年にCharles H Mayoらが後腹膜の神経原生腫瘍を切除し,発作性高血圧を治癒したことに始まる[6]。1949年に即効性の選択的α遮断薬フェントラミン(レギチーン®)が実用化されるが,それ以前のPPGLに対する手術は術中の急激な血圧変動に対応できず周術期手術死亡率は約25%と非常に高かった[7,8]。その後,1960年代に経口の非特異的α遮断剤(フェノキシベンザミン)が臨床導入されPPGLの術前管理に用いられるようになり,周術期死亡率は劇的に低下した[9]。これは,術前にα遮断薬による前処置を行うことにより,循環血液量を回復させ,摘出後の循環血液量減少性ショックを回避できるようになったことが大きいと思われる。その後,選択的α1遮断薬の術前投与が一般的となり,2020年には周術期手術死亡率は0.5%まで改善している[10]。現在検討されるべきは,より安全に,よりリスクを抑えた周術期管理の一般化であろう。
2018年に刊行された本邦のPPGL診療ガイドラインでは,術前の選択的α遮断薬は半減期の長いドキサゾシン(カルデナリン®)が推奨されている。他のα1遮断薬であるプラゾシン(ミニプレス®)やテラゾシン(ハイトラシン®)に比べドキサゾシンは1日1回の内服で済むため,これは当院を含め多くの施設で既にコンセンサスが得られているだろう。
本邦のガイドラインで特徴的な点を挙げると,ドキサゾシンは術前の7~14日の間に行われ,2~3日毎に 32mg/dayまで増量するように示されている。しかしドキサゾシンの添付文書では一日最高投与量は16mgとされており,実臨床においてそのまま導入するのは難しい。またカテコールアミン合成阻害薬であるメチロシンが,さらなる血圧低下と循環血漿量減少の是正による循環動態の安定に期待できるとされている。その他,ドキサゾシン内服3日目以降より食塩9g/dayの摂取を開始し,手術前日夕より手術まで1~2Lの生理食塩水の点滴投与を行うことが推奨されている。
これらの項目について,各国のPPGLガイドラインをまとめた(表1)[1,11~14]。概ね近しい基準が示されているが,中には記載のない項目もあり一定の見解とはいえない。

本邦と各国(地域)のPPGLガイドライン比較
名古屋大学医学部附属病院乳腺・内分泌外科における2007年から2020年の間に施行した126例のPPGLの外科的手術経験を提示する(表2)。手術時の年齢は21~78歳(中央値52歳),男性57例で女性69例であった。狭義の褐色細胞腫は104例であり,右側が49例で左側が54例,両側が1例,パラガングリオーマは22例であった。腫瘍径は10~140mm(中央値46mm)であった。開腹手術は37例で,腹腔鏡下摘出術が86例,腹腔鏡から開腹手術に移行したのは3例であった。正常血圧で自覚症状のない無症候性症例は49症例(38.9%)であり,術前24時間尿中メタネフリン分画が施設基準の正常上限の3倍にあたる1.8mg/day以下の非機能性症例は46例(36.5%)であった。症候性症例は無症候性症例に比べて術前24時間尿中メタネフリン分画値が有意に高値であったが,無症候性症例のなかにも尿中メタネフリン高値を示す症例を数例認めた。また腫瘍径は,症候性/無症候性症例において差を認めないが,機能性/非機能性症例においては機能性症例の方が有意に腫瘍径が大きかった(図1)。

当院でのPPGL手術症例背景

A:症候の有無による術前24時間尿中メタネフリン分画値の比較,B:症候の有無による腫瘍径の比較,C:機能性の有無による腫瘍径の比較
当科ではPPGLと診断された症例は原則全例選択的α1遮断薬ドキサゾシンを術前投与の方針であるが,実際には126例中123例(97.6%)が術前投与されていた。ドキサゾシンの術前投与期間は0~303日(中央値73日)(図2),最大最終投与量は16mg/dayだが,当院では最終投与量が8mg/dayの症例数が最も多かった(図3)。周術期に褐色細胞腫クリーゼを起こした例は認めなかった。ドキサゾシン投与中は,特に増量直後に起立性低血圧症状が生じやすいとされているが,投与を中断した症例はなかった。各種ガイドラインで推奨されている投与期間よりかなり時間をかけて増量していることが,安全な術前管理に寄与していると考えられた。
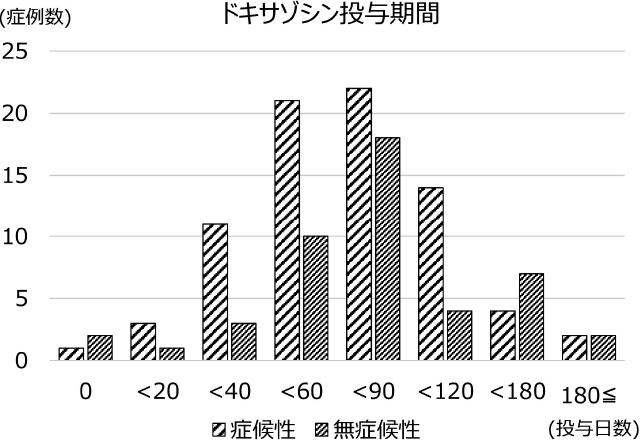
術前ドキサゾシン投与期間

術前ドキサゾシン最終投与量
PPGLの切除手術時の収縮期血圧と心拍数に着目して周術期リスクを検討した(図4)。機能性/非機能性症例において術中収縮期血圧と最高心拍数を比較すると,術中最高収縮期血圧は機能性症例の方が有意に高かった。しかし非機能性症例の一部においては,術中最高収縮期血圧や最高心拍数が著明高値を示す症例を認めた。また,術中最低収縮期血圧は機能性症例において,異常低値を示す症例を認めたものの,機能性と非機能性の間に有意差は認めなかった。これは,術前のα-遮断薬による前処置が一定程度寄与していたと考えられる。

機能性/非機能性における術中血圧と心拍数
術後カテコールアミン投与を要した症例は,機能性症例で20例,非機能性症例で4例認めたが,いずれもその投与は術後1日目までに終了されており,投与が遷延した症例はなかった。術死はなかった。
当院でのドキサゾシン導入の実際を示す(図5)。まず1mg/dayから開始し,約1週毎に2mgずつ緩やかに2カ月ほどかけて増量している。これは当院の手術待機時間が平均約2~3カ月ほどあることも起因しているが,その間に緩徐増量することが起立性低血圧に伴うドキサゾシンの副作用を軽減できていると考えている。

当科におけるPPGL周術期管理チャート
ドキサゾシン内服中は血管拡張による循環血漿量需要が増加するため,水分および塩分を十分に摂取する必要があり,たちくらみなどの副作用の大部分はこれらの摂取不足が原因で引き起こされる。たちくらみが頻発する場合は水分および塩分が足りていない証拠なので,その場合は摂取量の増量を患者自身に自己調整してもらっている。また適切な塩分および水分が摂取できていれば,循環血漿量の増加により体重が増えることも事前に伝えている。幸い現代の日本の食製品には塩分が多いものが溢れており摂取には事欠かないため,食塩を処方する必要性は乏しいと考える。また術前日の生理食塩水の点滴投与は行っていないが,重篤な周術期合併症は認めておらず,これも塩分および水分の経口摂取が十分施行されていれば必須ではないと考えている。
PPGLはエピネフリン優位タイプとノルエピネフリン優位タイプに大別され,パラガングリオーマのほとんどと副腎由来の一部がノルエピネフリン優位であるが,エピネフリンがαとβ受容体に,ノルエピネフリンがα受容体のみに作用することが,術後の低血糖リスクに差を生じさせている[15]。α受容体刺激の主体は血管収縮作用であるため血圧や脈拍以外に与える影響は少ない。一方,β受容体刺激はその作用が多岐に渡るため,その刺激が解除されると糖新生低下やグルカゴン分泌低下,インスリン感受性亢進が起こり,低血糖発作が引き起こされる場合がある。そのため,エピネフリン優位タイプの術後は低血糖に留意する必要がある。当科ではタイプにかかわらず,術当日夜は4時間毎に血糖測定を行い,低血糖発作を予防している。
無症候性および非機能性PPGLに対して,近年まで術前α遮断薬投与は不要と考えられてきた。しかし,画像上PPGLと診断されても,非機能性であることからα遮断薬投与が行われないと,術中血圧が大きく変動しコントロールに難渋するケースは少なくない。術前に過小評価されたPPGLのうち,8%程が周術期手術死亡に至るとの報告もある[16]。また術前のカテコールアミン産生能は術前の血圧と比例しないとの報告もあるため[17],術前診断から周術期リスクを予想することは難しく,無症候性PPGLに対するα1遮断薬の必要性について十分な考慮が必要と考えられる。
術前にドキサゾシンを投与する最大の目的は周術期の急激な血圧変動(特に腫瘍摘出後の低血圧)から引き起こされる循環血液量減少性ショックのリスクを抑えることにある。先にわれわれの解析で示したように,術前α-遮断薬による前処置にもかかわらず,無症候性PPGLであっても術中異常高血圧や術後カテコラミン補充を必要とするケースがあり,無症候性または非機能性PPGLに対してドキサゾシンの投与省略する理由は見当たらない。またドキサゾシン自体は比較的安価な薬剤であるため,投与による患者負担もそれほど大きくはなく,内服による副作用も食事指導により十分予防可能であり,内服によるデメリットはリスクを凌駕することはない。患者の命を守り,かつ手術に関わる外科医および麻酔科医の立場を守るためにも,ドキサゾシンの術前投与は積極的に行うべきと考える。
今回はPPGLの各国のガイドラインを踏まえた上で当科での手術症例を解析し,PPGLの周術期管理の実際を示しその意義について解説した。特に,非機能性PPGLであっても周術期合併症が引き起こされるリスクがあることを踏まえれば,α1遮断薬は積極的に術前投与することが推奨される。