認知症関連の脳脊髄液検査として,2012年4月の診療報酬改定に伴い,脳脊髄液中の総タウ蛋白(total tau; t-tau)とリン酸化タウ蛋白(phosphorylated tau; p-tau)の測定が保険収載となった。t-tauやp-tau以外にもアミロイドβ(amyloid β; Aβ)42も重要なバイオマーカーであり,今後,保険適用となることが期待されている。基準値に関しては,報告されている研究の結果も様々で明確に設定されていないのが現状である。また,脳脊髄液中のt-tau,p-tau,Aβ42といったバイオマーカーの測定は,施設間差があることや,測定キットのLotの違いによっても結果にばらつきが生じる。日内変動がみられる項目や採取容器の種類によっても結果に影響を及ぼすことがわかっており,測定および採取条件の設定は極めて重要である。頻繁にオーダーが入る検査ではないので,費用対効果の面から自施設で測定している病院は少ないが,外注に提出するまでの検体採取からその処理までに認知症の脳脊髄液バイオマーカーについて熟知した臨床検査技師が関わることは,より信頼性の高い結果を提供するために重要であると考える。
現在,認知症診断のための脳脊髄液バイオマーカーとして,総タウ蛋白(total tau; t-tau),リン酸化タウ蛋白(phosphorylated tau; p-tau),アミロイドβ蛋白(amyloid β; Aβ)が有用であると考えられている。2012年4月の診療報酬改定に伴い,脳脊髄液中t-tauの測定がクロイツフェルト・ヤコブ病(Creutzfeldt-Jakob disease; CJD)を,脳脊髄液中p-tauの測定が認知症を対象として保険収載された。残念ながらAβに関しては保険適用とはなっていないが,Aβがアルツハイマー型認知症(Alzheimer’s disease; AD)発症の最上流にあるとするアミロイドカスケード仮説が提唱されており(Figure 1)1),重要なバイオマーカーである。
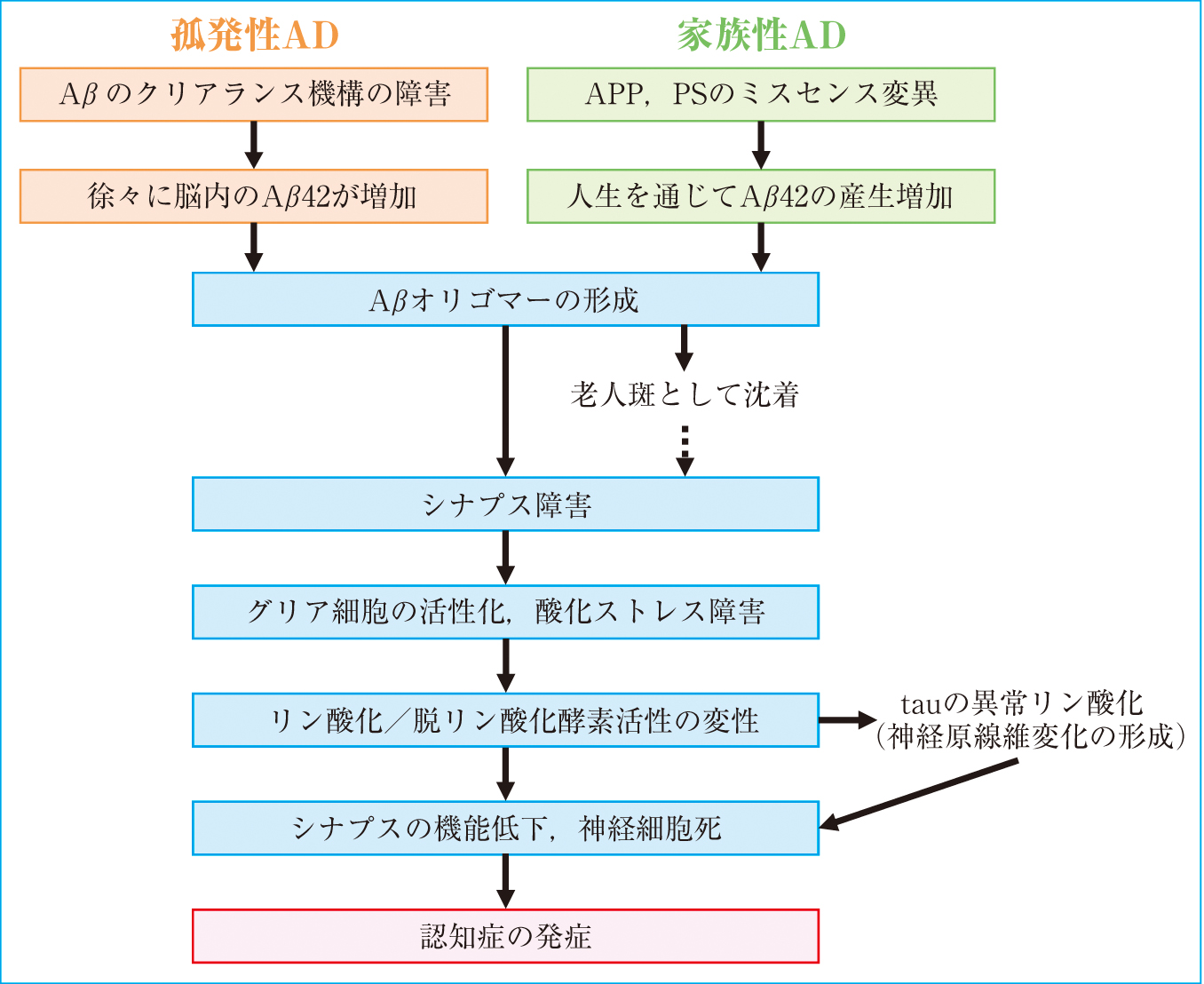
アミロイドカスケード仮説に基づくアルツハイマー型認知症(AD)発症の機序
Aβ: Amyloid β
tauは,微小管結合蛋白の一つで,微小管の安定化や構造の維持に関与する因子である(Figure 2)。微小管は,細胞骨格の一つであり,細胞分裂や細胞内輸送などの役割を担っている。ヒトのtau遺伝子は第17番染色体長腕17q21に存在し,16個のエクソンから構成されている。選択的スプライシングによってN末端側のエクソン2,3とC末端側のエクソン10が挿入されるかによってアミノ酸352~441個からなる6つのアイソフォームが存在する2)。C末端側には31~32アミノ酸からなる繰り返し配列があり,エクソン10の挿入がないものは3つ,エクソン10の挿入があるものは4つになり,3リピートタウおよび4リピートタウに分類される3)。この領域を介して微小管に結合しているが,4リピートタウの方が,微小管重合能が高いことがわかっている。タウ蛋白が細胞内に異常に蓄積する疾患は「タウオパチー」と総称され,3リピートタウが主に蓄積する疾患には前頭側頭型認知症(frontotemporal dementia; FTD)の一つでありピック球を認めるピック病が,4リピートタウが主に蓄積する疾患には大脳皮質基底核変性症(corticobasal degeneration; CBD),進行性核上性麻痺(progressive supranuclear palsy; PSP)が,両者が蓄積する疾患としてはADが挙げられる。
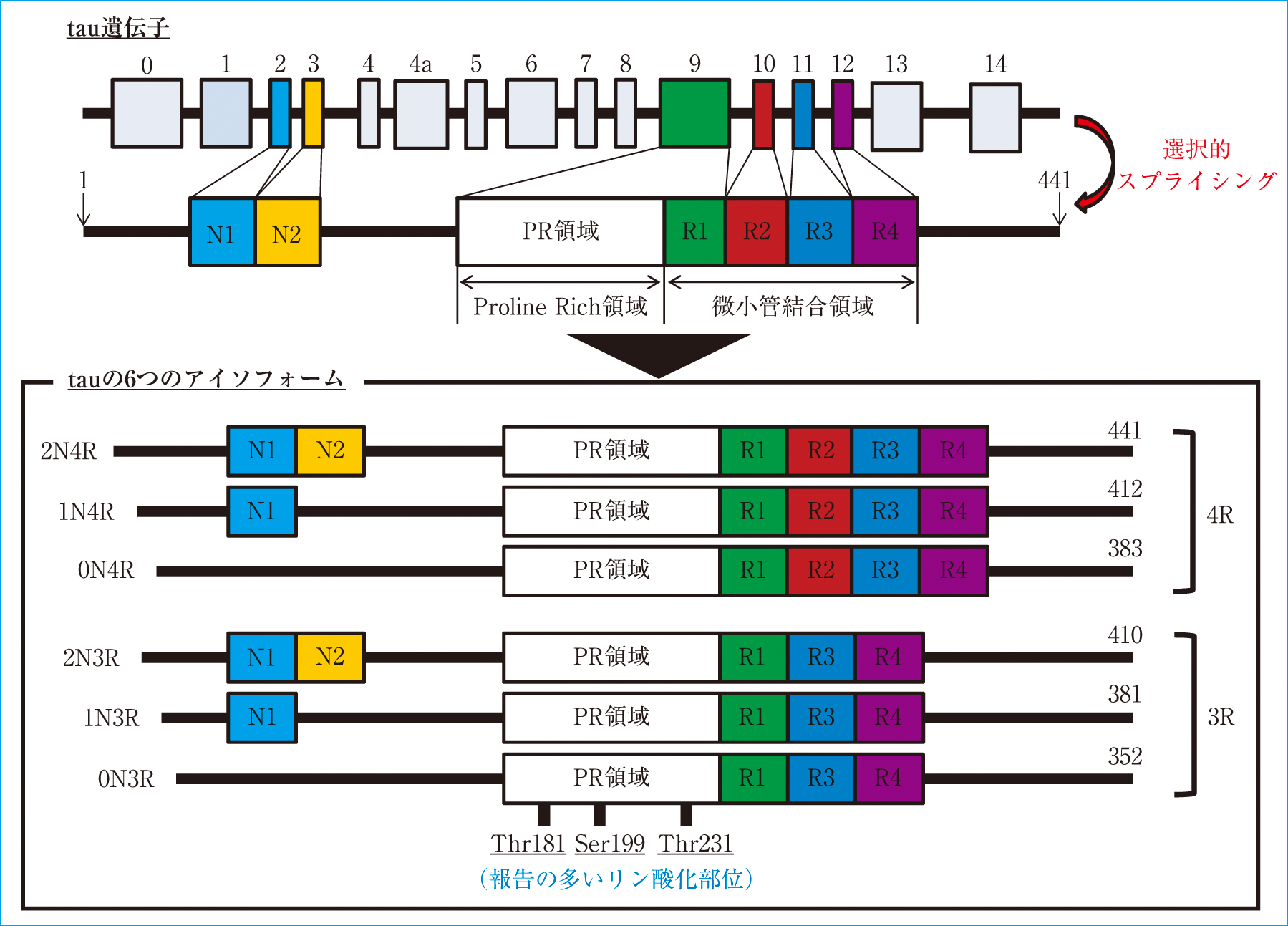
タウ蛋白(tau)のアイソフォームとリン酸化部位
tauには6種類のアイソフォームが存在し,3リピートタウと4リピートタウに分類できる。tauの配列の中には多くのリン酸化部位が存在し,特にThr181,Ser199,Thr231はアルツハイマー型認知症で上昇するリン酸化タウ蛋白の種類として報告が多い。
tauの特徴として,セリン,スレオニン,チロシンといったリン酸化部位が多数存在し(2N4Rのtauでは85箇所),ADでは約45箇所で異常リン酸化が報告されている4)。リン酸化酵素には,サイクリン依存性キナーゼ5(cyclin-dependent kinase 5; CDK5),MAPキナーゼ,グリコーゲンシンターゼキナーゼ3β(glycogen synthase kinase 3β; GSK 3β),分裂促進因子活性化タンパク質キナーゼ(mitogen-activated protein kinase; MAPK)など多数報告されている5),6)。病気でなくてもタウ蛋白は生体内で一部リン酸化され,微小管の重合能を調節しているが,過剰なリン酸化は微小管を不安定化し,軸索輸送を障害させる。異常にリン酸化されたp-tauは凝集・重合して神経原線維変化を形成する。脳脊髄液中に排出されるtauは,神経細胞が脱落した際に,一部分解されたものであり,細胞内にあったものが浸出していることを示し,脳内の神経変性・神経細胞死の指標と考えることができる7)。
2) 検査方法一般的にt-tau,p-tauの測定は,Enzyme-Linked Immuno Sorbent Assay(ELISA)で行われている。測定キットはいくつかの会社から販売されており,自施設で検査を行う際は選定を行う必要があるとともに,測定キットは安価とは言えないため費用対効果を考慮して,外注での検査を検討することも必要である。検査方法の詳細は,各キットに添付されている説明書を参照していただきたい。ELISAは,マイクロプレートリーダー,マイクロピペット,インキュベーター,試薬調整用の実験器具があれば検査可能であり,容易に行うことができる。検査に要する時間は,患者検体を反応させるのにovernightを要するキットが多く,検査開始日の翌日に結果を返すことができる。
また,最近はt-tau,p-tau,Aβ42を同時に測定出来るLuminex assayを用いた測定キットも販売されている8)。AD発症の予測や治療薬の効果を確認するための方法を確立するための研究である米国のAlzheimer’s Disease Neuroimaging Initiative(ADNI)では脳脊髄絵液バイオマーカーの測定は本法を用いて行っている。t-tauやp-tauは,ELISAでの測定結果との相関も得られており9),有用性が注目されているが,測定には専用のLuminexシステムが必要である点は注意が必要である。
3) 検査データ脳脊髄液中のt-tauは,いくつかの神経変性疾患で上昇するが,最も顕著である疾患としてCJDや髄膜脳炎が挙げられる10),11)。特にCJDは急速に進行し,死に至る病気であるため,我々医療従事者への感染対策の面においてもその診断は重要である。カットオフ値は,多くの検査会社で1,200 pg/mL未満を採用している。しかし,t-tauのカットオフ値を1,300 pg/mLとして評価した研究で,血管性認知症(vascular dementia; VaD)の7.8%,ADの7.6%,レビー小体型認知症(dementia with Lewy bodies; DLB)の1.8%がカットオフ値を超えていたという報告もある12)。したがって,CJDが疑われた場合は,臨床所見と合わせて評価するとともに,後に述べる14-3-3蛋白や異常プリオン蛋白の検査(但し,保険適用外の検査であり,一般の検査会社ではほとんど行われていない),MRI検査等についても実施することが大事である。
米国ADNIの研究では,ADと認知機能が正常な高齢者を識別するには,t-tauのカットオフ値を93 pg/mLとしたとき,感度69.6%,特異度92.3%だったと報告しているが,これはあくまで一つの参考値としてご覧いただきたい13)。また,この結果は,一晩絶食した後の朝に採取する等の条件を厳密に規定しており,後にも述べるが採取や測定条件により結果が変動することがわかっているため解釈には注意が必要である。
一方,p-tauについてはADで上昇すると考えられているが,その基準値は一致した見解が得られていない。前述したとおり,tauは多くのリン酸化部位を持っており,現在のELISAではそのうちのどこか1つのアミノ酸がリン酸化している部位を認識する抗体を用いているので,全てのp-tauを測定できるわけではない。多くの研究では,181番目のスレオニンがリン酸化されたp-tau181,199番目のセリンがリン酸化されたp-tau199,231番目のスレオニンがリン酸化されたp-tau231を測定する方法を採用している。また,いくつかの認知症が合併している可能性も考慮する必要がある。実際に剖検により,神経病理学的に検討した研究において,142人のうち41人(28.9%)は2つの神経変性疾患の病理が存在していたと報告されており14),その1つにAD病態があった患者は多数を占めていた。さらに,AD以外にもp-tauが脳内に蓄積する疾患として,神経原線維変化優位型認知症や嗜銀顆粒性認知症がある。したがって,脳脊髄液中のp-tauが上昇していれば脳内ではp-tau関連病理が存在している可能性は高いと考えることができるが,p-tauの結果のみで認知症を特定するのではなく他の検査結果と合わせて評価することが大事である。
米国ADNIの研究では,ADと認知機能が正常な高齢者を識別するには,p-tau181のカットオフ値を23 pg/mLとしたとき,感度67.9%,特異度73.1%だったと報告しているが,これはあくまで一つの参考値としてご覧いただきたい13)。また,この結果はt-tauのところでも説明したが,条件を厳密に規定しているため,実臨床で用いる際は注意が必要である。また,国内の検査会社の多くは50 pg/mL未満をカットオフ値として採用している。
4) 検査実施上の留意点ガラスやポリスチレンの容器に吸着する傾向があるため15),タンパク質が吸着しやすい採取容器を使用すると,実際よりも低値を示すことになる。したがってタンパク質の吸着を起こしにくいポリプロピレン製の採取容器を用いる必要がある。また,p-tauの測定の際には,採取管にethylenediaminetetraacetic acid(EDTA)入りのものを使用し,採取管内での脱リン酸化を防ぐようにすることが望ましい16)。採取後はできれば遠心し,保存する場合は−80℃で凍結保存する。また,頻回の凍結/融解の影響として,t-tauに関しては6回の凍結/融解でも比較的安定していたとの報告があるが17),必要ない限りは頻回の凍結/融解は避けるようにする。各施設で検体の採取や処理の条件について設定しておくことが大事であり,後に記載するAβの項に,文献からの情報も加味した脳脊髄液の採取条件をまとめたので参照していただきたい。
検査に関しては,Lot間での測定結果のばらつきより,検査を行う施設間差の方が大きかったと報告されているため18),出来る限り測定施設を変更しないようにすることが望ましいと考える。
5) 認知症患者への対応と注意事項t-tauやp-tauは保険収載されているが,明確な基準値が設定されていないのが現状であることと,いくつかの疾患が合併していることもあるため,結果の解釈には他の検査結果と合わせて評価する必要がある。例えば,ADの診断基準を満たしていても脳脊髄液中のp-tauやAβ42の変化が顕著でない例もあるため,全ての症例に推奨されるものではないが,鑑別診断に迷うケース等には脳脊髄液バイオマーカーを測定する意義は大いにある16)。
また,カットオフ値が設定されていない原因の一つに,認知機能の低下と脳内の病態の進行にはタイムラグが生じていることが挙げられる。若年でADを発症する常染色体優性遺伝のAD家系を対象としたDominantly Inherited Alzheimer Network(DIAN)研究で,臨床症状が出てくる約15~20年も前から脳内にtauやAβが沈着していることが報告されており19),現時点では認知機能は正常に保たれているが,既に脳内では病気が進行している状態である,preclinical ADという概念が提唱されている20)。認知機能障害のない高齢者の脳脊髄液バイオマーカーを測定した結果,ADの特徴を示した人は36%もいたとの報告もあり21),認知機能が低下していなくても,脳内では病態が進行していれば,脳脊髄液中のバイオマーカーは異常値を示す。したがって,バイオマーカー研究において,pureな認知機能障害のない高齢者を対照群に設けることは,極めて重要であると考える。
軽度認知障害(mild cognitive impairment; MCI)の早期発見のための脳脊髄液バイオマーカーの測定の有用性については,後に記載するAβの項にまとめたので参照していただきたい。
6) 診療報酬点数2016年度現在の診療報酬は,脳脊髄液中t-tauの測定がCJDを,脳脊髄液中p-tauの測定が認知症を対象として1患者につき1回の測定に限り660点となっている。但し,保険適用において測定するp-tauのリン酸化部位は規定されていない。
2. Aβ 1) 臨床的意義Aβは,1回膜貫通蛋白であるアミロイド前駆体タンパク質(β-amyloid precursor protein; APP)が切断されることで産生される(Figure 3)。APPの切断酵素として,αセクレターゼ,βセクレターゼ,γセクレターゼが存在する。切断の順序は,最初にAPPの細胞外領域をαセクレターゼまたはβセクレターゼのどちらかによって切断され,続いて細胞膜内領域がγセクレターゼによって切断される。αセクレターゼとγセクレターゼによって切断される経路ではp3と呼ばれる短い断片が産生されるためAβ非産生経路であり,βセクレターゼとγセクレターゼによって切断される経路がAβ産生経路となる22)。Aβは,γセクレターゼの切断部位により,40個のアミノ酸からなるAβ40や42個のアミノ酸からなるAβ42等が産生される。特にAβ42は凝集性が強く,老人斑を形成する主な原因と考えられている。健康な人でもAβは産生されているが,血液脳関門を介して血液中に排泄する経路や,ネプリライシン等のAβ分解酵素による分解を受けるといったクリアランス機構が保たれている。しかし,ADではその破綻が生じており,病態を加速させる要因になっていると考えられている23),24)。また,Aβの産生には遺伝的な関与も報告されている。常染色体優性遺伝形式を示す家族性ADではAPPの変異により,γセクレターゼの切断に影響を及ぼしAβ42の産生比率を増加させる変異であるLondon型変異25),βセクレターゼの切断に影響を及ぼしAβの産生量を増加させる変異であるSweden型変異26),βやγセクレターゼの切断部位ではないが,Aβ中間部分の変異によりAβの凝集性を亢進させる変異が見出されている。また,γセクレターゼは,プレセニリン,ニカストリン,APH-1,PEN-2を最低の構成因子とする膜タンパク質複合体であるが,プレセニリンの変異によりAβ42の産生が増加することが知られている27)~29)。したがって,Aβのクリアランス機構が障害されることや,産生が増加することが原因で,脳内でAβが過剰になった後に凝集し老人斑として沈着する。その結果,老人斑の構成成分であるAβ42の脳脊髄液中の値は病気の進行とともに減少すると考えられている。
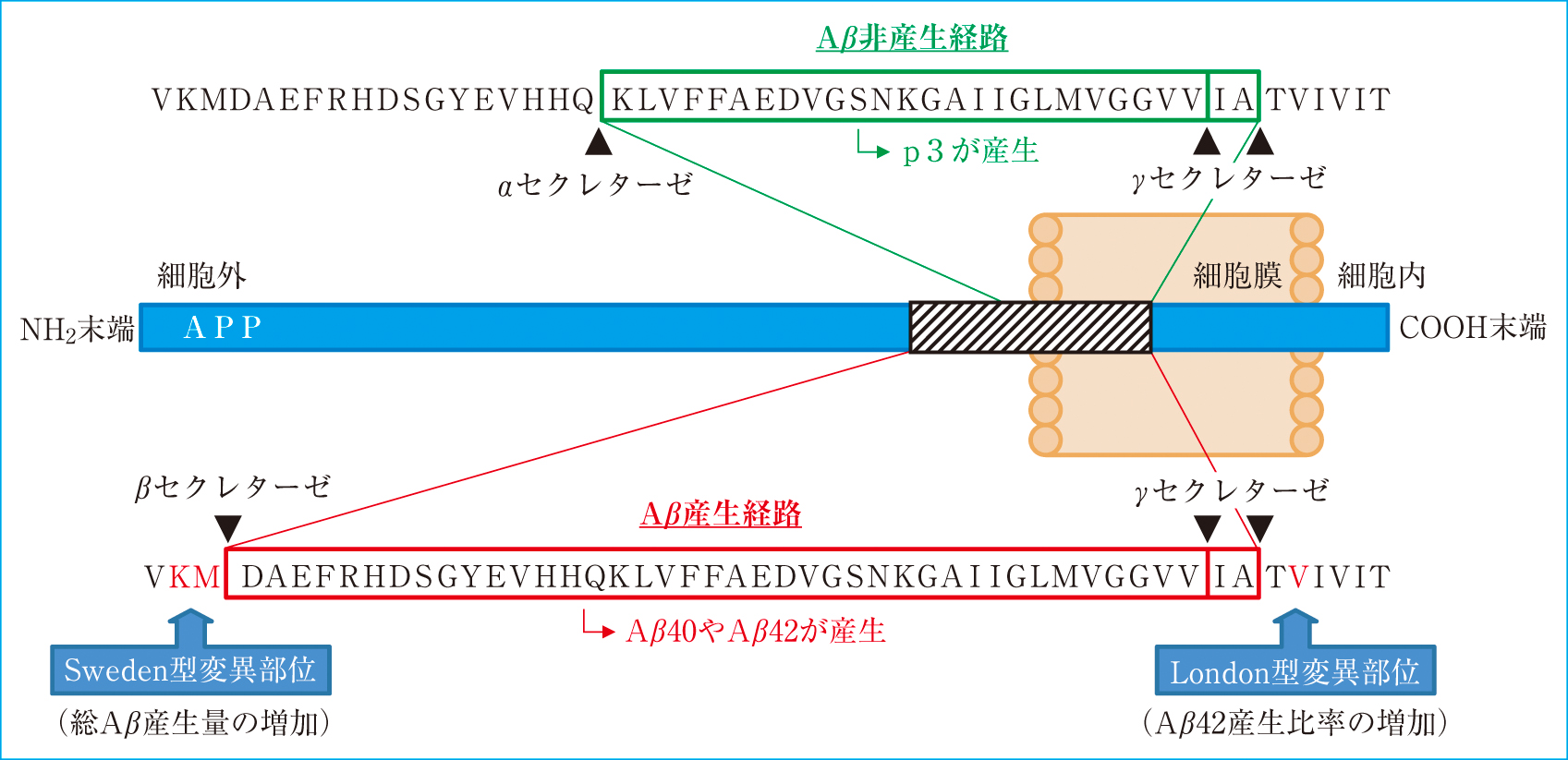
アミロイド前駆体タンパク質(APP)の代謝(Aβ産生経路とAβ非産生経路)
αセクレターゼとγセクレターゼによって切断されるとp3が産生され,Aβ非産生経路となる。一方,βセクレターゼとγセクレターゼによって切断されるとAβが産生されAβ産生経路となる。また,APPにはいくつかの遺伝子変異が報告されており,Aβの産生や凝集性に関与している。
Aβ: Amyloid β
一般的にAβ42の測定は,ELISAで行われている。測定キットはいくつかの会社から販売されており,自施設で検査を行う際は選定を行う必要がある。自施設での検査が難しい場合は外注での検査を検討する必要があるが,保険適用外の検査であるため,検査受託を行っていない会社が多いのが現状である。また,t-tau,p-tauの項でも記載したが,t-tau,p-tau,Aβ42を同時に測定出来るLuminex assayを用いた測定キットも販売されている8)。米国のADNIでは脳脊髄絵液バイオマーカーの測定は本法を用いて行っており,その有用性が注目されている。
3) 検査データAβにはアミノ酸が40個からなるAβ40や42個からなるAβ42等があると述べたが,主に測定されているのはAβ42である。脳脊髄液中のAβ42はADで減少することはわかっているが,その測定結果は報告により差があり,基準値は決まっていない。Aβは後にも述べるが,測定条件による影響をうけやすいため,結果のばらつきが大きくなっている可能性が考えられる。また,p-tauの項でも記載したが,いくつかの疾患が合併している可能性もあるため14),脳脊髄液中のAβ42が低下していた時は,脳内にAβが沈着している可能性は高いと解釈することができるが,Aβ42の値だけで疾患を断定することには注意が必要である。アミロイドカスケード仮説というように,ADではアミロイドが発症の最上流に位置しているので,Aβの測定は極めて重要であるが,今後検査の標準化が求められる領域であると考える。
米国ADNIの研究では,ADと認知機能が正常な高齢者を識別するには,Aβ42のカットオフ値を192 pg/mLとしたとき,感度96.4%,特異度76.9%だったと報告しているが,これはあくまで一つの参考値としてご覧いただきたい13)。この研究では,t-tauやp-tauよりもAβ42の方が,感度が高いことが示されている。さらに,t-tau/Aβ42やp-tau181/Aβ42のように各バイオマーカーの比をとることも有用であると考えられている。一方,ELISAで測定した場合のカットオフ値は,500 pg/mL未満と報告している文献もある30)。
4) 検査実施上の留意点ガラスやポリスチレンの容器に吸着する傾向があるため15),タンパク質の吸着を起こしにくいポリプロピレン製の採取容器を用いる必要がある。採取後はできれば遠心し,保存する場合は−80℃で凍結保存する。また,頻回の凍結/融解の影響として,Aβ42は3回の凍結/融解で測定値が約20%減少していたと報告されている17)。これは,Aβの立体構造の変性や他のタンパク質がAβのエピトープに結合することに由来すると考えられている。したがって,頻回の凍結/融解は出来る限り避けるようにし,その回数を記録しておくことも正しい結果を解釈することにつながると考える。
また,Aβは日内変動があることがわかっている。Aβは睡眠中にクリアランスされていることや,産生が減少している可能性が考えられているため,サーカディアンリズムを考慮する必要がある。Aβは最大睡眠時間(1時間の間のREM睡眠の時間が最も多くなった時間)から遅れること6時間後に最小値を示すと報告されている31)こともあり,早朝空腹時の採取が望ましいと考えられている。しかし,60歳未満の若年者に比べて60歳以上の者ではその変動は減少していたことも報告されている31)。高齢者では早朝空腹時の採取が困難な場合もあるため,出来るだけ採取時間や条件を統一することで日内変動の影響を軽減するような対応が重要であると考える。
Vandersticheleら32)がADのバイオマーカー測定の標準化にむけたコンセンサスレポートを報告しており,その他の文献からの情報も加味した脳脊髄液の採取条件をTable 1にまとめた。様々な報告があるのが現状であり,十分なエビデンスが得られていない項目もあるため,検査をする前に各施設で検体の採取や処理の条件を設定しておくことが大事である。また,Aβ42やt-tauあるいはp-tauは基本的には一つの検体で測定することが多いので,採取条件は検査項目によって差別化するのではなく,統一されることが望ましいと考える。
| 推奨条件 | |
|---|---|
| 採取時間 | 日内変動を考慮して,同一時間帯に採取することが望ましい ※早朝空腹時が望ましいという見解はあるが,高齢者では日内変動が少ないとされている |
| 採取量 | 濃度の勾配効果はないため,常に一定量を採取する必要はない ※再検査の可能性を考慮すると最低1.5 mLは必要である |
| 食事の影響 | 食事の影響に関するエビデンスは十分でないため,絶食は必須ではない ※現実的には認知機能の低下した高齢者に絶食を強要するのは難しい場合が多い |
| 採取容器 | ガラスやポリスチレンの容器は使用せず,ポリプロピレンの容器を使用する |
| 遠心 | 血性の検体は遠心が必須であるが,非血性の検体も遠心をしておくことが望ましい 回転数は結果に影響がないとされているが,室温で2,000 g,10分を推奨している報告がある |
| 保存 | できる限り早く−80℃で凍結することが望ましい(遅くとも2時間以内には凍結する) |
| 保存期間の安定性 | 2年間の安定性は確認している報告はあるが,それ以上の長期間保存でのエビデンスはない |
| 凍結/融解の回数 | 2回以内に抑えることが望ましい |
| 溶血検体 | 最初の1–2 mLは捨て,必ず遠心してから測定する |
検査に関しては,検査を行う施設間や測定キットのLot間で測定結果にばらつきが生じることが報告されているため18),出来る限り測定施設を変更せず,Lotも同じものを入手できるようにすることが重要である。残念ながら精度管理用の標準品は提供されていないが,安定した結果を提供するためには必要であり,今後の課題であると考える。
5) 認知症患者への対応と注意事項t-tauやp-tauと同様に,明確な基準値が設定されていないため,結果の解釈には他の検査結果と合わせて評価する必要がある。また,MCIに対してt-tauやp-tauと合わせてAβ42を測定する有用性も報告されている。MCIの脳脊髄液バイオマーカーを調査した研究では,約4年以上の追跡後にADに移行したMCIは,MCIのまま(stable MCI)だった人に比べて,追跡開始時のt-tau,p-tau181が高く,Aβ42が低かったと報告されている33)。また,t-tau,p-tauおよびAβ42を組み合わせると,ADに移行する人を感度95%,特異度87%で分類でき,追跡開始時に脳脊髄液バイオマーカーが異常値を示していると,ADに進行する人が1年間で27%だったのに対して,異常値を示していなかった人は1%だったとされている。したがって,脳脊髄液検査はその後の進行を予測するマーカーとしても有用であり,MCIで異常値を示した場合は認知症へ移行するリスクが極めて高いと考えることができる。但し,侵襲性が無い検査というわけではないので,患者の身体的な負担も考慮する必要があると考える。
6) 診療報酬点数2016年度現在は,保険適用外の検査である。
3. 14-3-3蛋白14-3-3蛋白は,CJDの脳脊髄液中で検出されるタンパク質である。測定はウェスタンブロット法による判定量法で,シグナルの強度をポジティブコントロールとネガティブコントロールとの比較により評価している。但し,14-3-3蛋白はVaDの10.7%,ADの5.8%,DLBの5.3%で陽性を示したと報告されている12)。CJDに関しては,real-time quaking-induced conversion(RT-QUIC)法による異常プリオン蛋白の検出法も開発されており,脳脊髄液検査の有用性は高いと考える。但し,2016年度現在は,保険適用外の検査であり,検査の際は専門の研究施設等に依頼する必要がある。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。