2018 年 67 巻 3 号 p. 360-365
2018 年 67 巻 3 号 p. 360-365
Neisseria animalorisは犬や猫の咬傷から検出されるショ糖分解性のグラム陰性桿菌であり,Pasteurella属に類似したグラム染色像やコロニー所見を呈する。我々は,猫による咬傷感染部位から分離頻度の高いPasteurella multocida,血液培養からは分離頻度の稀なNeisseria animalorisが同時期に検出された敗血症の1症例を経験した。症例は60歳代女性。数年前に乳癌の治療を受け,末期状態であった。全身倦怠感と左腋窩の疼痛により当院に救急搬送された。自宅にはネコを10匹飼育しており,患者の右手背部に猫咬傷,発赤・腫脹が認められた。猫による咬傷部位から分離された菌は,MALDI Biotyperを用いて,P. multocidaと同定した。血液培養から分離された菌は,16S rRNA遺伝子解析を用いて,N. animalorisと同定した。N. animalorisは症例報告が少なく,臨床的意義はあまりよく知られていない。本症例では咬傷感染部位と血液培養から検出された菌は乖離していたが,2菌種は共に犬や猫の口腔内常在菌であることから,猫咬傷感染にて敗血症を発症したと考えられる。
ネコの口腔内には数多くの細菌が常在しており,猫咬傷により細菌が傷口に入り込むことで感染症を引き起こす。多くは蜂窩織炎にとどまるが,壊死性筋膜炎や敗血症性ショックを発症する場合があり,起炎菌としては好気性のPasteurella属やStreptococcus属,嫌気性のFusobacterium属やPorphyromonas属が多く分離される1)。外科的処置としては十分な洗浄と消毒,デブリドマンが重要であり,抗菌薬投与ではアモキシリン-クラブラン酸,アンピシリン-スルバクタム,キノロン系薬剤,テトラサイクリン系薬が用いられる。
咬傷感染による敗血症では,咬傷感染部位と血液培養から検出される菌は同一菌種の場合が多い。今回我々は,血液培養からは分離頻度の稀なN. animaloris,咬傷感染部位からはP. multocidaと異なる2菌種の人畜共通感染菌を検出した。
1974年,N. animaloris は犬や猫の咬傷から検出されるショ糖分解性のグラム陰性桿菌で,Centers for Disease Control Group Eugonic Fermenter 4(CDCグループ EF4)に分類された2)。1981年,アルギニンデヒドロラーゼの有無によりEF4-aとEF4-bに分類され3),その後1990年にEF4-aをN. animaloris,EF4-bをN. zoodegmatisとして命名された4)。このN. animalorisはネコの口腔内に常在するにもかかわらず,ネコ咬傷感染としてヒトから分離された報告は極めて稀であり,我々が検索した限りでは本邦初の症例報告である。
患者:60歳代,女性。
主訴:全身倦怠感,左腋窩の疼痛。
既往歴:乳癌。
家族歴:特記事項なし。
現病歴:末期乳癌および全身倦怠感と左腋窩の疼痛。
搬送時現症:BT 35.0℃,HR 88 bpm,BP 143/82 mmHg,RR 26/min。左腋窩リンパ節の腫大および潰瘍の形成と多発性肝転移を認めた。また,自宅には猫を10匹飼育しており,患者の右手背部には猫咬傷,発赤・腫脹を認め(Figure 1),右手背猫咬傷による蜂窩織炎と診断された。血液・生化学検査ではCRP 2.32 mg/dL,プレセプシン3,550 pg/mL,好中球比率93.8%と著名な炎症反応の上昇と,肝機能障害:AST 209 U/L,ALT 128 U/Lを認めた(Table 1)。

右手背の猫咬傷
傷は深く浸出液・発赤・腫脹を認めた。
| 生化学検査 | 血液検査 | ||||
|---|---|---|---|---|---|
| AST | 209 U/L | ↑ | WBC | 6.7 × 103/μL | |
| ALT | 128 U/L | ↑ | Neutro | 93.80% | ↑ |
| LD | 468 U/L | ↑ | RBC | 4.16 × 106/μL | |
| ALP | 2,508 U/L | ↑ | Hb | 13.2 g/dL | |
| rGTP | 438 U/L | ↑ | Ht | 37.0% | |
| UN | 50.3 mg/dL | ↑ | PLT | 167 × 103/μL | |
| CRP | 2.32 mg/dL | ↑ | |||
| プレセプシン | 3,550 pg/mL | ↑ | |||
CRP,プレセプシン,好中球比率が高値であり,著名な炎症反応の上昇を認めた。
治療経過:倦怠感・疼痛の増強を訴え,入院1日目に右手背部のデブリドマンを施行し,また猫咬傷による敗血症を疑い血液培養2セットを採取した。その後,直ちにABPC/SBTの投与を開始したが,終末期医療の適応であり,入院3日目に死亡した。
血液培養検査は,SA好気用ボトル(シスメックス・ビオメリュー),SN嫌気用ボトル(シスメックス・ビオメリュー)を1セットとし,BacT/ALERT® 3D微生物培養検査システム(シスメックス・ビオメリュー)で2セット実施した。1日目にSA好気用ボトル1本,SN嫌気用ボトルボトル2本共に陽性となり,ガス非産生,非溶血であった。陽性ボトルの培養液をグラム染色した結果,小型のグラム陰性桿菌が観察された(Figure 2)。分離培養では5%ヒツジ血液寒天培地(日本ベクトン・ディッキンソン,以下日本BD)を用いて35℃の5%CO2環境下で18時間培養した結果,白~淡黄色のS型コロニーを認めた(Figure 3)。また同定検査後に追加検証項目としてドリガルスキー寒天培地(日水製薬)やサイヤー・マーチン寒天培地(日本BD)への発育の有無を調査したが,35℃の好気環境下で18時間培養しても発育は認めなかった。
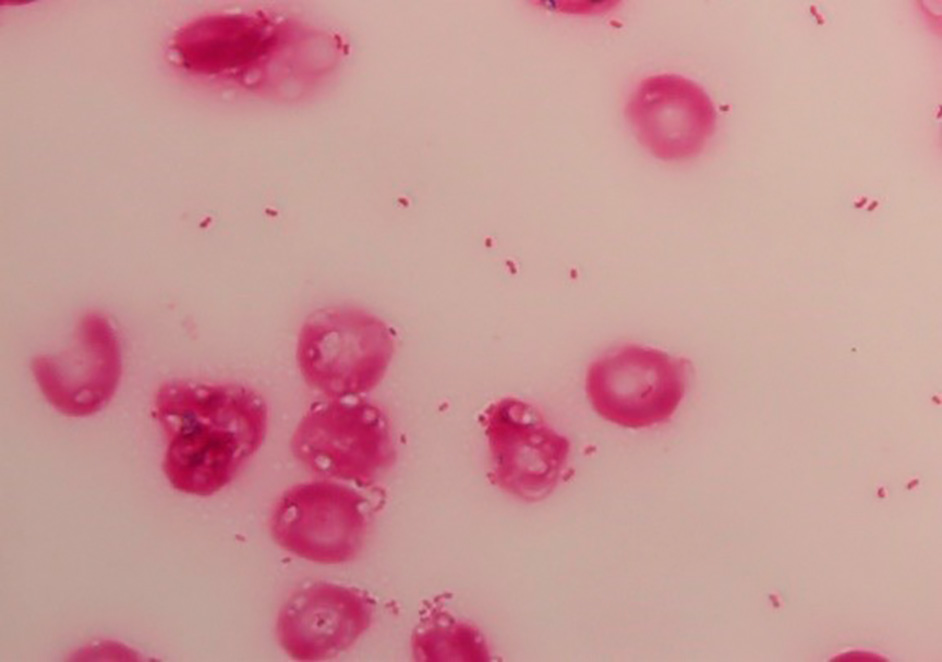
血液培養からのグラム染色所見(×1,000)
菌体は小型のグラム陰性短桿菌が観られた。
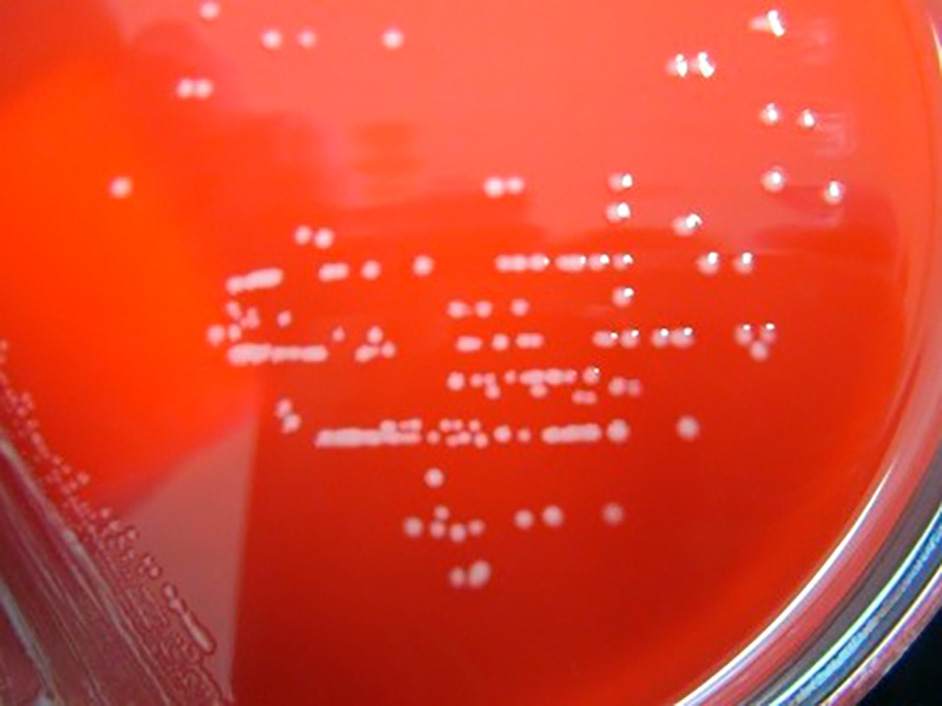
血液培養からのサブカルチャー
35℃の5%CO2環境下で,18時間培養後に白~淡黄色のS型コロニーを認めた。
同定試験ではVITEK 2 GN同定カード(シスメックス・ビオメリュー)で,N. animaloris/zoodegmatis(99%)と同定された。精査目的のためにMALDI Biotyper(ブルカー・ダルトニクス)を使用したがデータベースになく同定不能であったため,16S rRNA遺伝子解析を追加実施した。その結果,99%の相同性でN. animalorisと同定された。
薬剤感受性試験では,栄養要求性の厳しい肺炎球菌の測定と同様,ストレプト・ヘモ サプリメント‘栄研’を添加したミュラーヒントンブイヨン‘栄研’とドライプレート‘栄研’GP17を用い,CLSI M100-S22の測定法に準じた微量液体希釈法にて測定を実施した5),6)。感受性成績では,クリンダマイシン(CLDM),バンコマイシン(VCM),ダプトマイシン(DAP)以外の薬剤は感性を示した(Table 2)。
| N. animaloris | P. multocida | |||
|---|---|---|---|---|
| Antibiotics | MIC(μg/mL) | 判定 | MIC(μg/mL) | 判定 |
| PCG | 1 | — | ≤ 0.06 | S |
| ABPC | 2 | — | ≤ 0.25 | S |
| ABPC/SBT | 1 | — | ≤ 0.5 | — |
| CDTR-PI | 0.5 | — | ≤ 0.25 | — |
| CTRX | ≤ 0.25 | — | ≤ 0.25 | — |
| MEPM | ≤ 0.25 | — | ≤ 0.25 | — |
| TBPM | ≤ 0.12 | — | ≤ 0.12 | — |
| MINO | ≤ 1 | — | ≤ 1 | — |
| CAM | ≤ 0.25 | — | 2 | — |
| AZM | ≤ 0.25 | — | 0.5 | S |
| CLDM | > 4 | — | > 4 | — |
| GM | 4 | — | 8 | — |
| VCM | > 32 | — | > 32 | — |
| DAP | > 8 | — | > 8 | — |
| LVFX | ≤ 0.12 | — | ≤ 0.12 | — |
| GRNX | ≤ 0.12 | — | ≤ 0.12 | — |
S: susceptible
CLSI M100-S22の測定法に準じた微量液体希釈法にて測定
N. animaloris,P. multocidaともに高いMIC値を示した薬剤は,CLDM,VCM,DAPであった。その他の薬剤では感性を示した。
入院3日目に採取した右手背部の皮膚組織を検体として,5%ヒツジ血液寒天培地を用い35℃の5%CO2環境下で,18時間培養を行ったが発育は認めなかった。皮膚組織擦過スワブをHK半流動増菌培地(極東製薬工業)に接種し,35℃の好気環境下で2日間増菌培養後に発育が認められたため,5%ヒツジ血液寒天培地を用いて35℃の5%CO2環境下で,18時間分離培養した結果,灰白色のS型コロニーが認められ(Figure 4),グラム染色では小型のグラム陰性桿菌が観察された(Figure 5)。
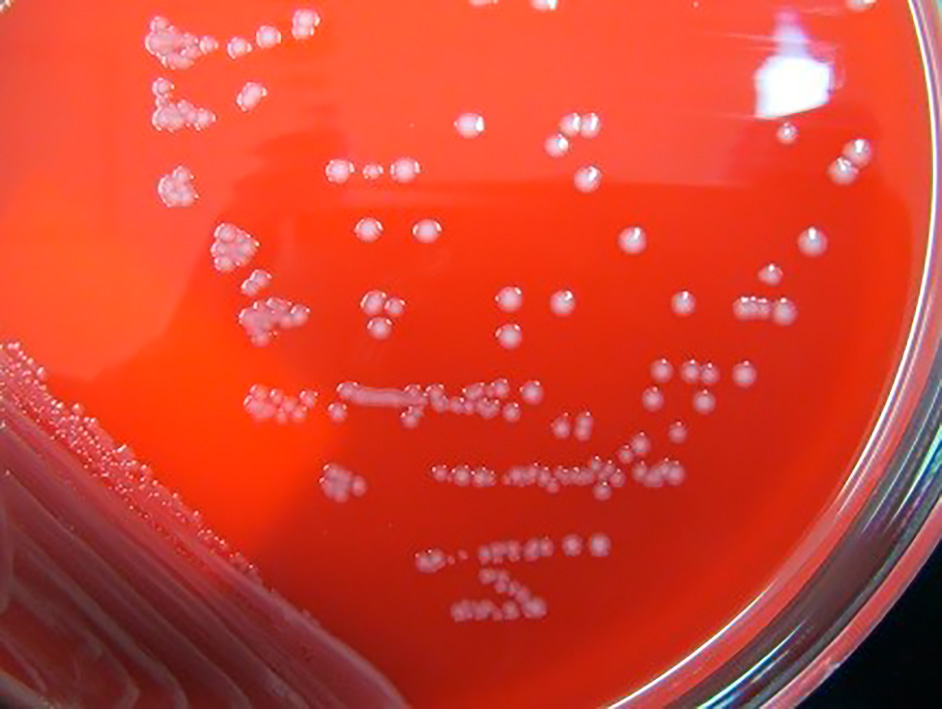
増菌培養した皮膚組織擦過スワブからのサブカルチャー
35℃の好気環境下で,2日間増菌培養後,5%ヒツジ血液寒天培地を用いて35℃の5%CO2環境下で,18時間分離培養したところ,灰白色のS型コロニーを認めた。
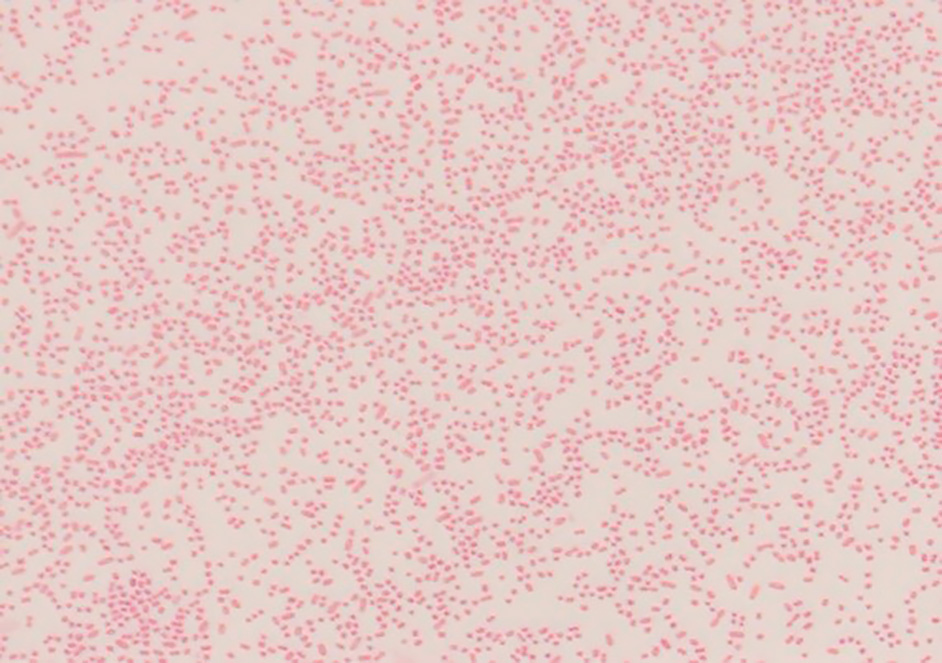
増菌培養した皮膚組織擦過スワブから得られたコロニーのグラム染色所見(×1,000)
菌体は小型のグラム陰性短桿菌が見られた。
同定試験として,VITEK 2 GN同定カードを用い,P. multocida(95%)と同定された。精査目的のためにMALDI Biotyperによる同定を実施した。MALDI Biotyperでの結果はVITEK 2 GN同定カードと同様,P. multocida(score value 2.348)と高いスコア値を示した。
薬剤感受性試験は,N. animalorisと同様に実施し,感受性成績もCLDM,VCM,DAP以外は感性を示した(Table 2)。
今回,我々は猫咬傷部位からは分離頻度の高いP. multocida,血液培養からは分離頻度の稀なN. animalorisが同時期に検出された敗血症例を経験した。血液培養ボトルから検出されたN. animalorisのグラム染色像は小型のグラム陰性短桿菌であった。また翌日の分離培養では,Pasteurella属に類似したS型コロニー所見が血液寒天培地に認められた。本症例では質量分析計のMALDI Biotyperおよび16S rRNA遺伝子解析など特殊な検査手法にて同定を追加検討したが,N. animalorisはインドール陰性であるのに対し7),P. multocidaはインドール陽性という生化学的性状を示す8)。このことより,2菌種の違いは簡易なインドールの生化学的性状で鑑別が可能といえる。実際に本症例で分離されたN. animalorisとP. multocidaの生化学的性状はRapID NHシステム(アムコ)の結果(Table 3)と,コバック試薬IND(ベックマンコールター)の結果(Figure 6a, b)において,N. animalorisはインドール陰性,P. multocidaはインドール陽性を示した。
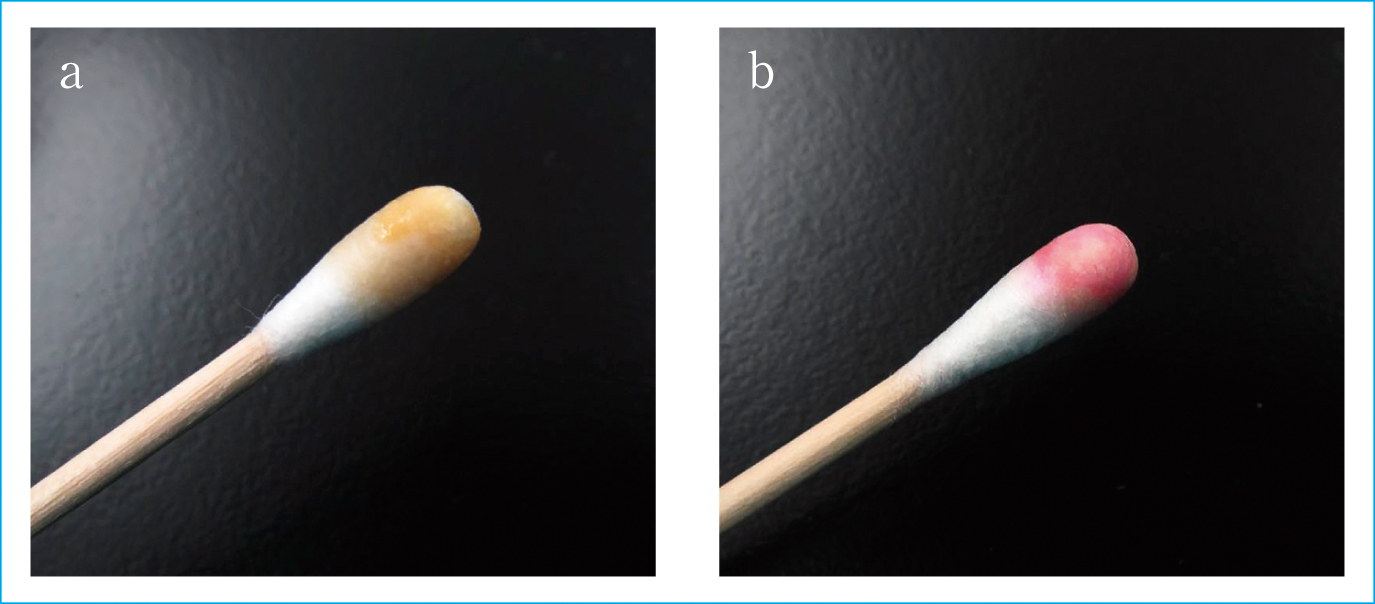
コバック試薬INDを用いたインドールテスト
(a) インドール試薬滴下後,変色しなかったN. animaloris,(b) インドール試薬滴下後,赤変したP. multocida。
| N. animaloris | P. multocida | |
|---|---|---|
| PRO | + | − |
| GGT | − | − |
| ONPG | − | − |
| GLU | + | + |
| SUC | − | + |
| EST | − | + |
| RES | − | + |
| PO4 | − | + |
| ORN | − | + |
| URE | − | − |
| NO2 | + | − |
| NO3 | − | + |
| IND | − | + |
N. animalorisはインドール試験陰性,P. multocidaはインドール試験陽性を示した。
今回は咬傷部位と血液培養から検出された菌種が異なる極めて稀な症例であり,その理由については不明である。しかし我々はN. animalorisのヒトへの定着性の弱さがひとつの要因と考えている。推察としては,猫の咬傷により患者の傷口にはN. animalorisとP. multocidaが咬傷部位に付着したが,N. animalorisは咬傷部位の皮膚組織には定着できず,P. multocidaのみが定着した。さらに牙の外力により傷深く血液まで入り込んだのはN. animalorisのみで,偶発的にP. multocidaは表層に留まり増殖,蜂窩織炎を引き起こしたものと考えている。その他の理由としては,皮膚組織からの採取がデブリドマン施行2日後のため,N. animalorisは除菌され,残存したP. multocidaのみが増菌培地で増殖されたのも要因と思われる。あるいはN. animalorisのHK半流動培地への発育性が乏しい可能性も示唆される。
N. animalorisは皮膚汚染菌として扱われ,過小評価されているという報告9)もあるが,動物の咬傷歴等の患者背景を視野に入れ,安易に汚染菌と考えずに起炎菌であることを疑う必要があると考える。
本症例では咬傷感染部位と血液培養から検出された菌は乖離していたが,2菌種は共に犬や猫の口腔内常在菌であることからも,猫咬傷により感染したN. animalorisによる敗血症であることは明確である。しかしN. animalorisの報告例は数少ないことから,さらに疫学的背景や臨床症状のデータを収集し,病原性や定着性などを明確にしていく必要があると考える。
本論文の要旨は,第28回臨床微生物学会にて発表した。
本論文は佐賀県医療センター好生館の倫理委員会で承認済みである(承認番号17-06-05-01)。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。