2019 年 68 巻 1 号 p. 186-191
2019 年 68 巻 1 号 p. 186-191
血液培養よりAerococcus urinaeを分離した重症感染性心内膜炎の1症例を経験した。患者は大動脈弁閉鎖不全症による大動脈弁置換術,慢性膀胱炎の既往のある70歳代の男性。来院時の血液培養よりCluster状のグラム陽性球菌を認めた。分離培養を行ったところ血液寒天培地に小型のα溶血性レンサ球菌様のコロニーが発育し,質量分析装置による同定を実施したところA. urinaeと同定された。心エコー検査によって感染性心内膜炎と診断され,VCMやSBT/ABPC,カルバペネム系抗菌薬などによる加療を行ったが,心原性脳梗塞を合併し第26病日に死亡した。A. urinaeはGram染色ではブドウ球菌様の形態を示すのに対し,血液寒天培地上ではα溶血を呈するレンサ球菌様のコロニーとして発育するため,Staphylococcus属やStreptococcus属と誤同定されやすい。高齢者の尿路感染症の原因となりうるほか,稀に敗血症や感染性心内膜炎を引き起こす。本菌による感染性心内膜炎は臨床経過の急激な悪化をたどり,重症化しやすいとの報告がある。血液培養にて本菌を疑う所見を得た際は迅速に同定し,早期に適切な治療を開始することが重要である。その点で質量分析装置による同定は非常に有用であると思われた。
Aerococcus urinaeは好気性のグラム陽性球菌であり,高齢者の尿路感染症の原因となる1)ほか,稀に敗血症2)や感染性心内膜炎,腹膜炎,リンパ節炎,椎間板炎を引き起こすことがある3),4)。Aerococcus属はGram染色ではブドウ球菌様の形態を示すのに対し,血液寒天培地上ではα溶血性レンサ球菌に類似したコロニーとして発育する5)。そのためStaphylococcus属やStreptococcus属と誤同定されやすく6),本菌を念頭に置いていなければ正しく同定するのが困難な菌種とも言える。今回,血液培養より本菌を分離し,質量分析装置を用いて迅速に菌種を同定し得た感染性心内膜炎の1例を経験したので報告する。
患者:70歳台,男性。
既往歴:小脳出血,大動脈弁閉鎖不全症,大動脈生体人工弁置換術,排尿障害,慢性膀胱炎,認知症。
現病歴:2週間前より発熱・排尿痛にて近医で膀胱炎と診断され,levofloxacin(LVFX)を投与後軽快するも時折発熱や身体の痛みの訴えがあり,徐々に食餌の摂取が困難になっていった。その後,居宅にて意識消失・嘔吐があり当院に救急搬送された。受診中にも痙攣を伴う意識消失があり,尿路感染症疑いで入院・治療を開始した。
来院時身体所見:意識清明,体温35.7℃,血圧152/78 mmHg,心拍数72/min,SpO2 96%,呼吸数20/min。
入院時検査所見:血液検査ではWBC 16.1 × 103/μL,CRP 17.0 mg/dLと炎症マーカーの上昇を認めた。髄液検査では細胞数の上昇はなく,明らかな異常を認めなかった。尿検査は尿蛋白,潜血,白血球が陽性となり尿路感染症が疑われる所見であった(Table 1)。
| 項目 | 値 | 項目 | 値 |
|---|---|---|---|
| Na | 138 mmol/L | WBC | 16.1 × 103/μL |
| K | 4.2 mmol/L | Hb | 8.7 g/dL |
| Cl | 103 mmol/L | PLT | 189 × 103/μL |
| UN | 27.8 mg/dL | SEGMENT | 89.3% |
| CRE | 1.22 mg/dL | eGFR | 45.6 |
| TP | 6.4 g/dL | 髄液細胞数 | 9/μL |
| ALB | 2.1 g/dL | 単核球数 | 6/μL |
| AST | 24 U/L | 糖定量 | 72 mg/dL |
| ALT | 11 U/L | 尿蛋白 | 1+ |
| LD | 275 U/L | 尿糖 | − |
| GLU | 161 mg/dL | 尿潜血 | 2+ |
| CRP | 17.0 mg/dL | 尿白血球 | 2+ |
臨床経過:入院後の経過と使用抗菌薬を示す(Figure 1)。救急外来にて各種培養の採取後,ceftriaxone(CTRX)にて治療が開始された。しかし解熱はみられず血圧低下傾向となり,血液培養よりブドウ球菌様のグラム陽性球菌が検出されたため第3病日にvancomycin(VCM)に変更された。大動脈弁置換術の既往があることもあり,感染性心内膜炎精査のため経胸壁心エコーが施行された。置換された生体人工弁型大動脈弁に肥厚を認め,可動性のフィラメント状の構造物が観察されたため,疣腫を否定できないことから第5病日には経食道エコーを行い(Figure 2),感染性心内膜炎と診断され循環器内科へ転科となった。
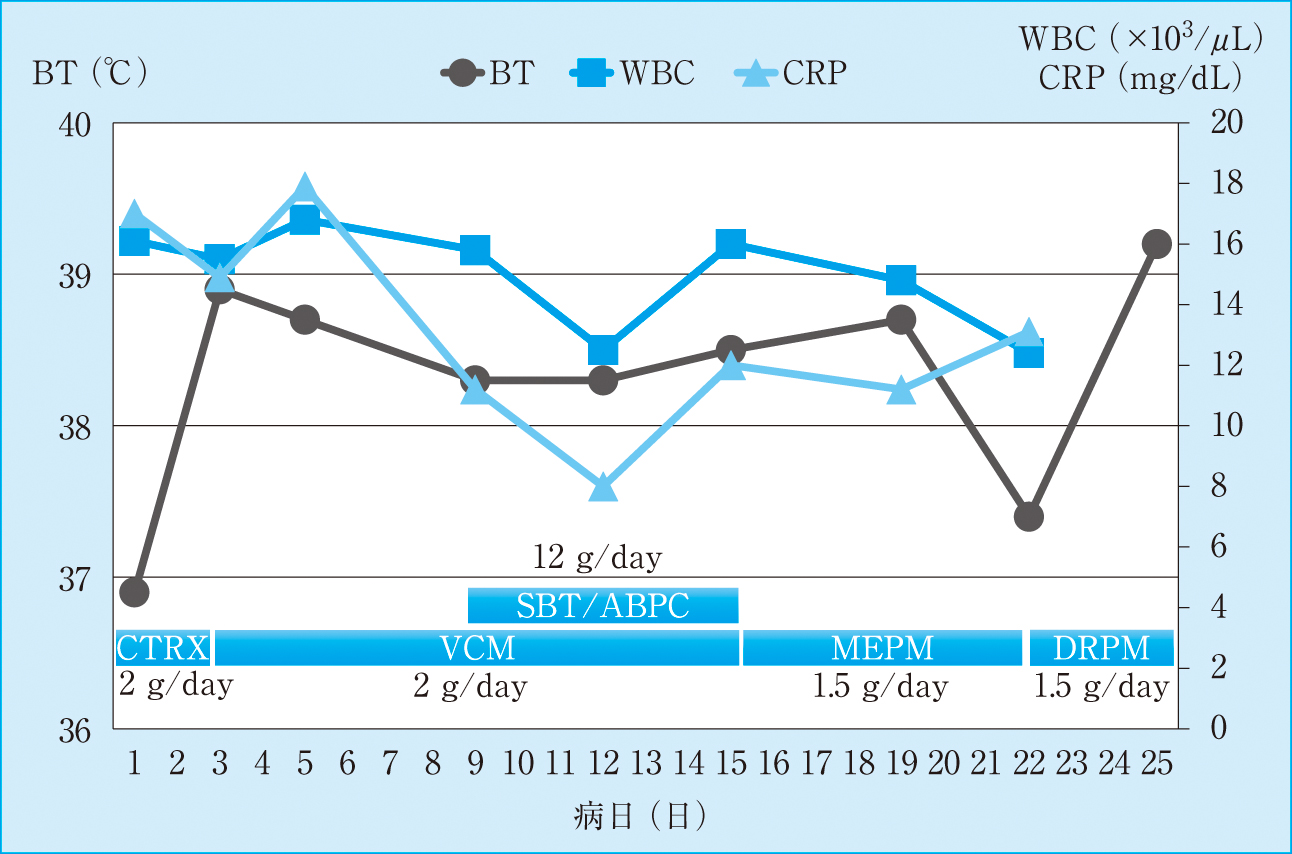
臨床経過
CTRX: ceftriaxone, VCM: vancomycin, SBT/ABPC: sulbactam/ampicillin, MEPM: meropenem, DRPM: doripenem
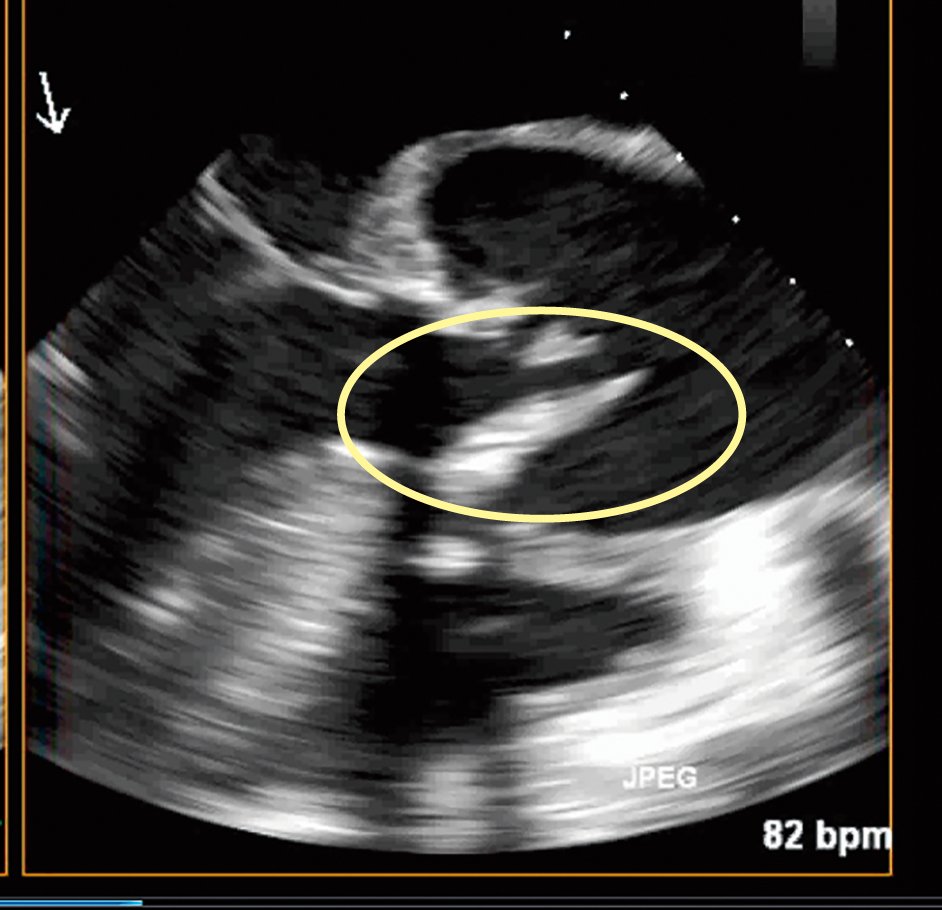
心エコー所見
肥厚した生体人工弁型大動脈弁(第5病日,経食道)
菌名・抗菌薬感受性検査結果判明後にもVCMのトラフ値のモニタリングを行いながら1週間VCM治療を継続した。しかし発熱は持続し,病棟薬剤師よりペニシリン系抗菌薬併用の助言を受けてsulbactam/ampicillin(SBT/ABPC)が第9病日より追加となった。
その後体位変換時に頭痛が出現し,第11病日に実施した頭部MRIにて右後頭葉に新規の梗塞を認め,感染性心内膜炎による心原性の脳梗塞と診断された。元々認知症もあり,ご家族から感染性心内膜炎および脳梗塞に対する積極的治療は希望されなかった。VCM + SBT/ABPCの併用,meropenem(MEPM)をそれぞれ1週間継続し経過観察となったが効果は見られず,第22病日にdoripenem(DRPM)に変更となったが,次第に貧血傾向となり,心不全・肺炎を合併して入院26日目に永眠された。
来院時,救急外来にて血液培養が2セット採取された。血液培養検査は血液培養自動検出装置BD BACTEC FX(日本BD)にて好気用レズンボトルおよび嫌気用レズンボトルを用いて実施し,培養後25時間以内に全てのボトルが陽転化した。陽性ボトルから作成したGram染色標本ではCluster状のグラム陽性球菌を認め(Figure 3),Staphylococcus属が疑われる旨を主治医に報告した。分離培養は5%ヒツジ血液寒天/BTB乳糖加寒天培地(日本BD)にて35℃好気環境下で培養を行った。翌日,ヒツジ血液寒天培地上にα溶血を呈する1 mmに満たない微小なレンサ球菌様の小型コロニーが発育した(Figure 4)。一方で,BTB乳糖加寒天培地には発育を認めなかった。
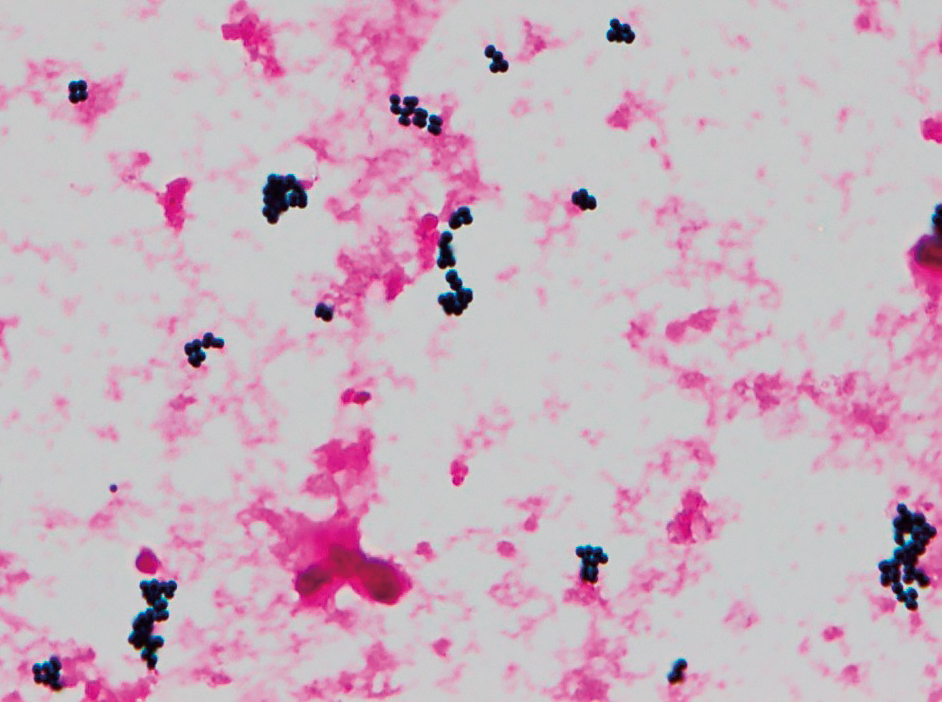
血液培養液Gram染色
Cluster状のグラム陽性球菌を認めた(100×)。
グラム染色液neo-B&Mワコー(和光純薬)
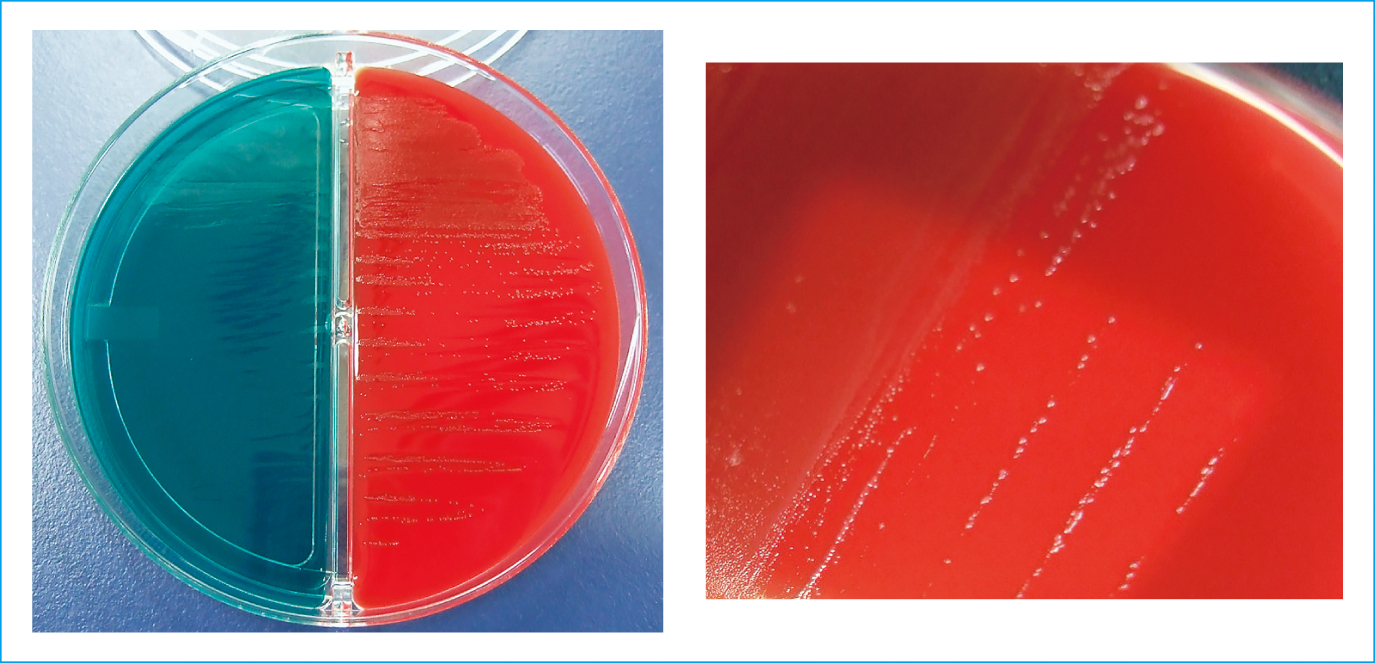
培養所見
ヒツジ血液寒天/BTB乳糖加寒天培地における24時間培養後のコロニー(左)
血液寒天培地上でα溶血を呈する微小なレンサ球菌様のコロニー(右)
来院時に提出された髄液および中間尿の培養は陰性であった。また血液培養検査のフォローとして,抗菌薬変更の際に血液培養のフォローを2度(第9・15病日)実施したが,陰性であった。
2. 同定検査Gram染色所見からStaphylococcus属を想定していたが,カタラーゼ試験は陰性であった。質量分析装置MALDI Biotyper(ブルカー・ダルトニクス)にてギ酸添加セルスメア法で測定を行ったところ,Aerococcus urinae(Score value: 2.259)と同定された。
3. 薬剤感受性試験当院処方のドライプレート‘栄研’(栄研化学)レンサ球菌用プレートを用いた微量液体希釈法による薬剤感受性試験を実施した。ストレプト・ヘモサプリメント‘栄研’(栄研化学)を規定量添加し,35℃にて好気環境下で16時間培養後に判定を行い,参考値として報告した(Table 2)。
| 薬剤名 | MIC(μg/mL) |
|---|---|
| ampicillin | ≤ 0.12 |
| penicilin G | ≤ 0.06 |
| sulbactam/ampicillin | ≤ 0.25 |
| cefazolin | 0.5 |
| cefotiam | ≤ 0.25 |
| ceftriaxone | ≤ 0.25 |
| cefaclor | ≤ 0.5 |
| cefditoren povoxil | ≤ 0.12 |
| meropenem | ≤ 0.12 |
| erythromycin | 0.25 |
| clindamycin | ≤ 0.12 |
| minocycline | ≤ 0.25 |
| trimethoprim-sulfamethoxazole | ≤ 5 |
| levofloxacin | 8 |
| vancomycin | 0.5 |
ドライプレート‘栄研’(当院レンサ球菌用)にて参考値報告
本症例はA. urinaeによる重症感染性心内膜炎で患者背景より侵襲的な治療は希望されず救命に至らない1例であった。本菌による感染性心内膜炎は稀であるが,臨床経過の急激な悪化をたどり,重症化しやすいことが報告されている7)。
本菌はGram染色ではCluster状のグラム陽性球菌として観察されるためにStaphylococcus属と判定されやすく6),本症例でも主治医への最初の電話連絡の際にはStaphylococcus属が疑われる旨を報告した。しかし分離培養の結果,血液寒天培地に小型のα溶血を呈するレンサ球菌様のコロニーの発育を認めたため,Gram染色所見と発育所見の相違に違和感を覚えてカタラーゼ試験ならびに質量分析装置による同定を実施した。このようなミスマッチを経験した場合には本菌の可能性を念頭に置き検査を行う必要があると考える。
Aerococcus属の同定にはピロリドニルアリルアミダーゼ(pyrrolidonylarylamidase; PYR)試験とロイシンアミノペプチダーゼ(leucineaminopeptidase; LAP)試験,ソルビトール分解能などの生化学的性状の確認が必要である6),8)。一方でA. urinaeは自動同定機器や同定キットを用いた場合にStreptococcus acidominimusと誤同定されるとの報告があり9),注意を要する。このため信頼性の高い同定結果を得るには最終的には遺伝子学的検査を用いるのが確実とされている。当院でも従来BD Phoenix100のグラム陽性菌用パネルBD Phoenix PMIC-86(日本BD)やrapid ID 32 STREP(シスメックス・ビオメリュー)を用いて同定を実施しており,両手法にて二重で同定を行った2例の血液培養陽性症例では1例目はPMIC-86にてA. urinae,rapid ID 32 STREPにてS. acidominimusと同定され,2例目はPMIC-86にてS. acidominimus,rapid ID 32 STREPにてAerococcus viridansと同定された。本症例においても追加測定を実施したところrapid ID 32 STREPではプロファイル0160-0010-500となり,データベース(V 4.0)で検索を行った結果A. urinae(%ID 99.9)と同定され,注釈欄にS. acidominimusまたはStreptococcus pluranimaliumの可能性を伴うという記載がみられた。S. acidominimusはデータベースがV 2.0からV 3.0にバージョンアップした際に菌名が削除されており,過去に古いデータベースを用いてS. acidominimusと同定されたプロファイルは現在のデータベースを用いるとA. urinaeと同定され,S. acidominimusの可能性について注釈欄に記載される。またグラム陽性菌同定専用パネルBD Phoenix PID(日本BD)では信頼値99%にてA. urinaeと同定された。今回は接種菌液をMcFarland濁度0.25に調整し測定を行ったが,過去の測定はMcFarland濁度0.5にて測定していたため,摂取菌濃度の違いによる影響も示唆された。
当院における過去10年間のAerococcus属の検出推移を見ると,2008年から2015年10月のMALDI Biotyper導入以前は血液培養からの分離4例を含む合計7件(A. viridans 6件,A. urinae 1件)であったが,7件すべての同定が正確であったかどうかは不明である。MALDI Biotyper導入後の2015年11月以降は尿路系材料および血液培養から年間約40件ずつ分離されるようになった。血液培養陽性症例は本症例を含め2例であり,ともにA. urinaeによる敗血症であった。尿路系材料からの検出菌の内訳としてはA. urinaeが大半を占め,Aerococcus sanguinicolaが12%程度で,A. viridansの検出はなかった。尿培養で血液寒天培地にα溶血を呈するレンサ球菌様のコロニーが観察された場合,以前は詳細な菌名の同定は行わずにα溶血性レンサ球菌と同定してそのまま検査を進めていたが,MALDI Biotyper導入以降は迅速かつ安価に同定結果が得られるため積極的に同定を行うようになったことがAerococcus属の検出増加の要因であると考えられた。本菌は尿路感染症の原因となるが,臨床検体からの分離頻度は低いとされ,臨床的意義については未だ明らかでない部分が多い。本菌についての正確な知識がなければ塗抹所見やコロニー所見から,Staphylococcus属や他のα溶血性レンサ球菌と誤認される可能性が高く,Aerococcus属の同定まで至らないケースが多数存在しているものと思われる。しかし質量分析装置の普及や各種同定法の精度の向上に伴い,尿路系材料由来のα溶血性レンサ球菌様コロニーの同定が正確に実施される施設が増加すると,分離頻度に変化が見られる可能性もあると考えられる。
Aerococcus属はペニシリン系をはじめとして多くの抗菌薬に対して小さいMIC値を示すが,アミノグリコシド系抗菌薬には耐性化傾向を示す。キノロン系抗菌薬についても,分離されたA. urinaeの約半数以上で高いMICを示したという報告があり6),10),当院で実施したA. urinaeの薬剤感受性成績も上記と同様の傾向であった。
本菌による感染性心内膜炎の治療と予後については,死亡率は約5割と高率であり,内科的治療のみでの生存症例が少ないのに対して手術症例は全例生存していた8)。治療については各種ガイドラインでも標準的な治療は未だ確立されておらず,ペニシリン系などのβ-ラクタム系抗菌薬を主体に行うことが多い。またアミノグリコシド系やVCMの併用例もみられた9),11)。本症例は再手術などの侵襲的な治療は希望されず,VCMやSBT/ABPC,カルバペネム系抗菌薬など感受性検査成績上は比較的良好である薬剤を使用して加療を行ったが,救命にはいたらなかった。
本症例はコロニー発育後すぐに質量分析装置による同定を実施したことにより,血液培養陽性後の翌朝にはA. urinaeと菌名を報告することができた。本菌は自動同定機器や同定キットを用いても信頼性の高い結果が得られないケースが存在するが,Aerococcus属の推定を行うことができればPYR試験とLAP試験を実施することで質量分析装置のない施設でも菌種の同定が可能となるため,本菌の特徴や関連疾患を把握しておくことが重要であると考えられた。
血液培養よりA. urinaeを分離した重症感染性心内膜炎の1症例を経験した。本菌による感染性心内膜炎は稀であるが,急激な臨床経過の悪化をたどり,重症化しやすいとの報告がある7)。血液培養にて本菌を疑う所見を得た際は,正確かつ迅速に同定し,早期に適切な治療を開始することが重要である。その点で質量分析装置による迅速かつ正確な同定は非常に有用であると思われた。
本論文の要旨は第28回日本臨床微生物学会(長崎市,2016年)において発表を行った。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。